碎米制备果葡糖浆液化及糖化工艺
2022-03-27郭宏文钱朋智徐婷婷刘晓兰李冠龙
郭宏文,钱朋智,徐婷婷,刘晓兰,李冠龙
(1.齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.黑龙江省普通高校农产品加工重点实验室,黑龙江 齐齐哈尔 161006)
我国是一个稻谷生产大国,据统计,2019年我国稻谷总产量达到2.096亿吨[1]。稻米加工过程中会产生15%~20%的碎米[2-3]。碎米的用途很多,可以作为酒、醋和糖等的原材料[4-6]。我国每年的碎米产量较大,多作为饲料进行加工,若综合利用率很低[7],会造成一定的资源浪费。碎米的淀粉含量较高,价格较低,可利用它的这一优势来制备淀粉糖类产品,以提高碎米的经济价值。
在工业生产中,来自玉米、大米等原料的淀粉经过液化酶、糖化酶水解成葡萄糖,葡萄糖在异构化酶的作用下转化为果糖,获得的果糖和葡萄糖混合的产品被称为果葡糖浆[8-9]。果葡糖浆是一种重要的甜味剂,风味有些类似于天然果汁,具有清香、爽口的口感[10-11]。果葡糖浆甜度与蔗糖相近,且具有渗透压大、易于吸收、抗结晶性强、溶解度高、抗龋齿性、保湿性好等优良特性,被广泛应用到医疗行业与食品工业中[12-14]。果葡糖浆应用性广、特性优越、功效性能多样,在世界范围内受到人们广泛认可,逐渐成为甘蔗糖和甜菜糖以外的第三类糖源[15]。在国内市场,随着果葡糖浆应用范围的拓宽,其需求量也在增加,开发玉米淀粉以外更多来源的果葡糖浆产品已成为一个新的趋势。
近年来,国内学者在利用碎米为原料制备果葡糖浆的工艺方面开展了一些研究[16-18]。这些研究中的碎米糖化用酶均为单一型糖化酶,未见使用复合型酶的研究。普鲁兰酶是一类淀粉脱支酶,它可与糖化酶协同作用,联合对直链淀粉和支链淀粉进行切割,提高糖化速度。因此,可以把普鲁兰酶用于碎米的糖化工艺。本研究利用碎米为原料制备果葡糖浆,液化工艺使用耐高温α-淀粉酶,糖化工艺使用含有糖化酶和普鲁兰酶的复合型葡糖淀粉酶,研究其液化和糖化工艺条件,旨在取得较好的糖化效果。本研究可以为提高碎米的经济价值及开发碎米来源的淀粉糖产品提供基础试验依据。
1 材料与方法
1.1 材料与试剂
碎米:市售;耐高温 α-淀粉酶(20 000 U/mL)、糖化酶(110 000 U/mL)-普鲁兰酶(1 000 U/mL)复合型葡糖淀粉酶(均为食品级):沧州夏盛酶生物技术有限公司;亚甲基蓝、酒石酸钾钠、亚铁氰化钾(分析纯):天津市科密欧化学试剂公司;硫酸铜、氢氧化钠(分析纯):哈尔滨化学试剂厂;葡萄糖(分析纯):苏州鹏成化工科技有限公司;碘(分析纯):济南世纪通达化工有限公司;磷酸氢二钠、柠檬酸(分析纯):天津市凯通化学试剂有限公司。
1.2 仪器与设备
粉碎机(CS-700Y型):武义海纳电器有限公司;数显恒温水浴锅(HH-2型):上海力辰科技有限公司;恒速强力搅拌器(AM200L-H型):上海昂尼仪器仪表有限公司;阿贝折光仪(Master-T型):上海图新电子科技有限公司;酸度计(PB10型):广州市授科仪器科技有限公司;高效液相色谱仪(日立Primaide型):天美(中国)科学仪器有限公司。
1.3 方法
1.3.1 碎米前处理
新鲜的碎米放入粉碎机中粉碎,过80目筛。过筛后的碎米粉按一定比例加水后调成米浆用于液化处理。
1.3.2 液化工艺的优化
以测定的液化液葡萄糖值(dextrose equivalent,DE)作为评价液化效果的指标,进行单因素试验。初始条件选定:液化温度90℃,液化时间30 min,加酶量为40 U/g,pH自然。因液化工艺对于后续的糖化有很大的影响,DE值过大不利于水解,过小不利于葡萄糖淀粉酶与底物的结合,一般葡萄糖生产中液化液DE值取15%~20%左右[19]。本试验中以液化液DE值在15%~20%之间为满足要求。
1)料液比优化:料液比分别为 1∶3、1∶4、1∶5、1∶6、1∶7(g/mL)进行液化,测定液化液的DE值,确定最佳的料液比。
2)液化温度优化:液化温度分别为 78、82、86、90、94℃进行液化,测定液化液的DE值,确定最佳液化温度。
3)液化时间优化:液化时间分别为 25、30、35、40、45 min进行液化,测定液化液的DE值,确定最佳液化时间。
4)耐高温α-淀粉酶加酶量的优化:加酶量分别为20、30、40、50、60 U/g进行液化,测定液化液的 DE 值,确定最佳的加酶量。
5)pH 值优化:pH 值分别为 5.0、5.5、6.0、6.5、7.0 进行液化,测定液化液的DE值,确定最佳的液化pH值。
1.3.3 糖化工艺的优化
以测定的糖化液DE值作为评价糖化效果的指标。采用单因素试验及正交试验确定最佳糖化工艺条件。经过预试验,单因素试验选定的初始条件:糖化温度60℃,糖化时间48 h,pH4.5。单因素试验包括糖化加酶量、糖化时间和糖化温度的优化。
1)糖化加酶量的优化:葡糖淀粉酶加酶量分别为110、165、220、275、330 U/g,测定糖化液的 DE 值,确定最佳的加酶量。
2)糖化时间的优化:糖化时间分别为 36、40、44、48、52 h,测定糖化液的DE值,确定最佳的糖化时间。
3)糖化温度优化:糖化温度分别为 56、58、60、62、64℃,测定糖化液的DE值,确定最佳的糖化温度。
糖化正交试验:依据单因素试验结果,设计L9(34)正交试验,确定最佳糖化工艺条件。
1.3.4 碎米糖化液的初步纯化
将糖化液升温至100℃,灭酶5 min,过滤;使用活性炭对糖化液脱色处理:糖化液中添加0.3%的活性炭,60℃条件下脱色30 min,过滤。通过脱色除去糖化液中肉眼可见的杂质、一些蛋白质和有色物质。
1.3.5 指标检测与计算
1)酶解液固形物含量测定:采用阿贝折光仪法。
2)还原糖含量测定:采用菲林试剂法[20]。
3)DE 值计算[19]公式如下。
液化液DE值=液化液中还原糖含量/液化液中固形物含量×100
糖化液DE值=糖化液中还原糖含量/糖化液中固形物含量×100
4)高效液相色谱法分析[21]
样品预处理:将样品和乙腈按体积比1∶1混溶,过0.22 μm针头式过滤器,超声波除气后备用。色谱分析条件为检测器:RID检测器;色谱柱:COSMOSIL sugar-D column(4.5 mm×250 mm,5 μm);流动相:乙腈∶水=75∶25(体积比);流速:1 mL/min;柱温:30 ℃;进样量:20 μL。
2 结果与分析
2.1 液化工艺的优化
2.1.1 料液比对液化效果的影响
料液比对液化效果的影响见图1。
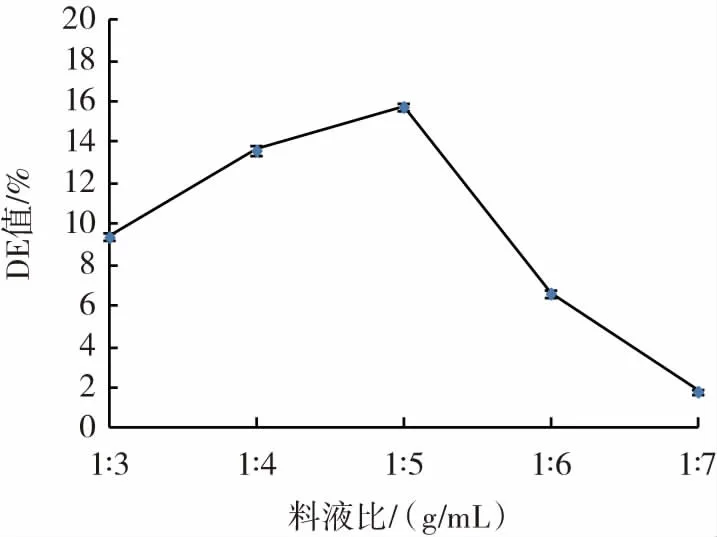
图1 料液比对液化效果的影响Fig.1 Effect of material-liquid ratio on liquefaction
由图1可知,液化液DE值随溶剂量的增大先增加后下降。料液比为1∶5(g/mL)时,DE值最大,之后DE值开始下降。溶剂量较小时米浆浓度过大,耐高温α-淀粉酶的作用不充分,酶解效果差,DE值较低。随着溶剂量的增加,酶作用变得充分,DE值增加。料液比为1∶5(g/mL)时对应的DE值为15.8%,满足在15%~20%之间的要求,因此,选择最佳料液比为1∶5(g/mL)。
2.1.2 液化温度对液化效果的影响
液化温度对液化效果的影响见图2。

图2 液化温度对液化效果的影响Fig.2 Effect of liquefaction temperature on liquefaction
由图2可知,液化温度为78℃时,液化液DE值较低,仅为8.2%。随着液化温度的增加,酶解速度越来越大,液化液DE值逐渐增加,液化温度为90℃时的DE值达到最大,90℃后DE值开始下降。液化温度为90℃时的液化液DE值15.8%,符合15%~20%的要求,因此,选择最佳液化温度为90℃。
2.1.3 液化时间对液化效果的影响
液化时间对液化效果的影响见图3。

图3 液化时间对液化效果的影响Fig.3 Effect of liquefaction time on liquefaction
由图3可知,液化时间25 min对应的液化液DE值为4.6%,随着液化时间的延长,DE值增加,35 min时达到最高,DE值为17.2%。之后再延长液化时间时DE值略微下降,主要是因为碎米淀粉中α-1,6糖苷键的存在影响了酶反应速度。而水解40 min后,由于α-淀粉酶的继续作用,还原糖的含量继续升高,DE值再次升高,45 min时的DE值为17.0%。液化时间35min~45min时,液化液的DE值均符合15%~20%的要求,考虑经济方面原因,选择35min为最佳液化时间。
2.1.4 耐高温α-淀粉酶加酶量对液化效果的影响
耐高温α-淀粉酶加酶量对液化效果的影响见图4。

图4 耐高温α-淀粉酶加酶量对液化效果的影响Fig.4 Effect of thermostable α-amylase amount on liquefaction
由图4可知,液化液的DE值随着耐高温α-淀粉酶加酶量的增加而增加,加酶量为40 U/g时,DE值为17.2%,之后,酶浓度趋于饱和,酶量增加对淀粉液化的速度影响减弱,液化液的DE值增加较少,加酶量为60 U/g时,DE值为17.4%。加酶量在40 U/g~60 U/g时,DE值均符合15%~20%的要求,加酶量40 U/g和60 U/g的DE值相近,考虑经济方面原因,选择耐高温α-淀粉酶最佳加酶量为40 U/g。
2.1.5 pH值对液化效果的影响
pH值对液化效果的影响见图5。

图5 pH值对液化效果的影响Fig.5 Effect of pH on liquefaction
由图5可知,碎米浆pH值对液化效果有一定的影响。pH5.0对应的液化液DE值为11.8%,随着pH值的增加DE值逐渐增加,pH6.5时的DE值最大,为17.2%。pH5.5~pH6.5对应的DE值均符合15%~20%的要求,选择最佳液化pH值为6.5。
2.2 复合酶糖化工艺的优化
2.2.1 糖化加酶量对糖化效果的影响
糖化加酶量对糖化效果的影响见图6。
由图6可知,糖化液DE值起初着随着加酶量加酶量的增加而增加,复合型葡糖淀粉酶加酶量110 U/g对应糖化液的DE值为91.0%,加酶量为275 U/g时,DE值达到最大,为99.4%。加酶量330 U/g时,DE值变化不大,可能是复合型葡糖淀粉酶用量达到275U/g后,酶浓度趋于饱和,酶量的增加对碎米淀粉的水解速率影响减弱。从经济方面考虑,选择最佳加酶量为275 U/g。

图6 糖化加酶量对糖化效果的影响Fig.6 Effect of saccharifying enzyme amount on saccharification
2.2.2 糖化时间对糖化效果的影响
糖化时间对糖化效果的影响见图7。

图7 糖化时间对糖化效果的影响Fig.7 Effect of saccharification time on saccharification
由图7可知,糖化时间36 h的糖化液DE值为89.8%,36 h~40 h糖化液DE值增幅不大,40 h后随着时间的增加糖化液DE值增加迅速,糖化时间48 h时达到最高,DE值为99.4%,糖化52 h时糖化液DE值不再增加。考虑经济方面原因,选择最佳糖化时间为48 h。
2.2.3 糖化温度对糖化效果的影响
糖化温度对糖化效果的影响见图8。

图8 糖化温度对糖化效果的影响Fig.8 Effect of saccharification temperature on saccharification
由图8可知,糖化温度56℃时的糖化液DE值为99.0%,随着温度的增加,糖化液DE值整体变化幅度不大。糖化温度60℃对应的DE值最大,为99.4%。因此,选择最佳糖化温度为60℃。
2.2.4 糖化正交试验
在单因素试验基础上,进行L9(34)正交试验,各因素水平分别选择:糖化加酶量 220、275、330 U/g,糖化温度 58、60、62 ℃,糖化时间 44、48、52 h,pH 值 4.2、4.5、4.8。正交试验对糖化工艺优化后的结果见表1。
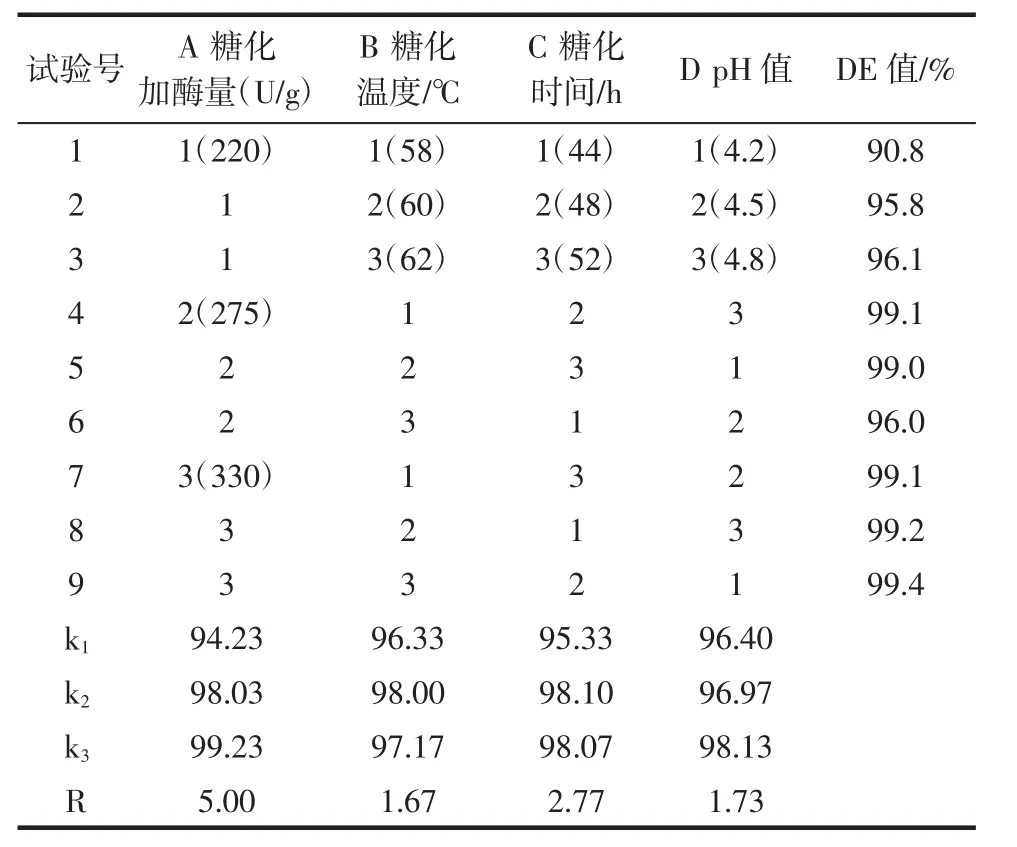
表1 糖化正交试验设计与结果分析Table 1 Design and results of orthogonal test for saccharification
对表1进行数据分析可知,四个因素对糖化效果的影响顺序由大到小依次:A糖化加酶量>B糖化时间>C pH值>D糖化温度,最佳糖化工艺组合应为A3B2C2D3。经过试验,A3B2C2D3条件下糖化得到的糖化液DE值为99.5%,明显优于单一评价指标的结果。因此,糖化工艺条件最佳组合为A3B2C2D3,即糖化加酶量为330 U/g,糖化温度 60℃,糖化时间为48 h,pH4.8。
据李文钊等[22]报道,在利用大米制备果葡糖浆的工艺中,糖化温度控制在60℃~62℃,pH值4.3,糖化时间30 h~40 h,糖化结束后糖化液DE值可以达到95%~98%。将本研究与之进行比较,糖化工艺条件参数都比较接近。但在本研究中糖化时间40 h以上继续增加时,得到糖化液的DE值也随之增大,糖化44 h时的糖化液DE值为99.2%,糖化48 h时DE值达到了99.5%,取得了较好的糖化效果。
2.3 碎米糖化液的糖组分分析
碎米糖化液经过滤和脱色初步纯化后,对其糖类成份进行了分析。糖类物质的分离可以通过高效液相色谱法(high performance liquid chromatography,HPLC)在色谱柱中实现。采用高效液相色谱法分别确定了葡萄糖标准品、果糖标准品出峰保留时间,结果如图9~图10所示。
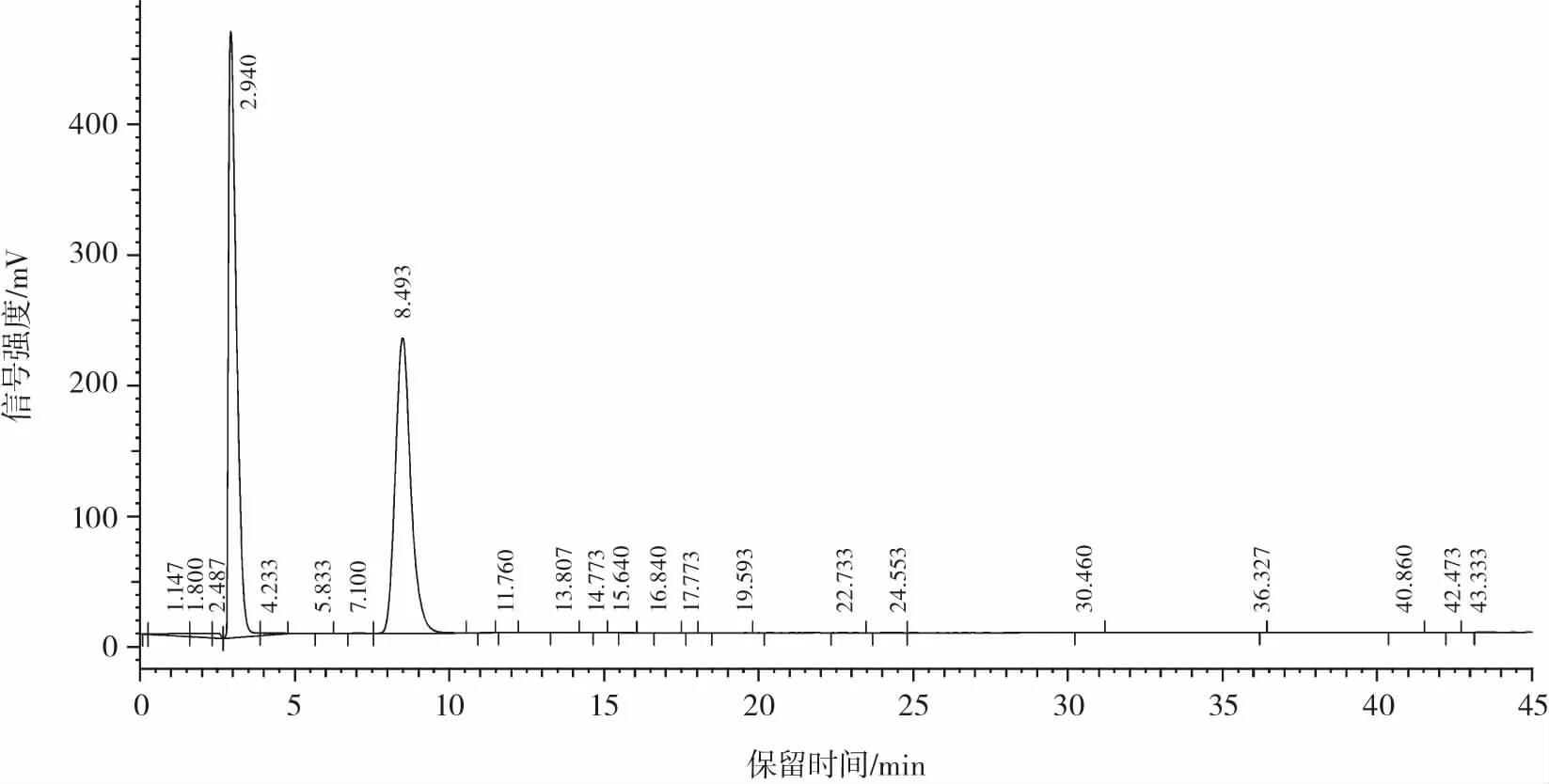
图9 葡萄糖标准品高效液相色谱图Fig.9 HPLC chromatogram of glucose standard
分析图9、图10可知,流动相乙腈对应的峰最大,其出峰保留时间为2.940 min。葡萄糖标准品的出峰保留时间为8.493 min,果糖标准品的出峰保留时间6.973 min。
采用高效液相色谱法对碎米糖化液中的糖组分进行了分析,结果如图11所示。
分析图11可知,碎米糖化液组分色谱图中除乙腈的峰之外,还有1个主峰,出峰保留时间为8.487 min,峰面积为951 705,与图9葡萄糖标准品出峰保留时间8.493 min基本一致,表明碎米糖化液的糖类主要由葡萄糖组成,依据峰面积计算得到葡萄糖的含量为73.2%。此外,色谱图中还有一个组分的出峰保留时间为7.033 min,峰面积为144 048,因其含量相对较低,所对应的峰图显示不明显,其出峰保留时间与图10果糖标准品的出峰保留时间6.973 min基本一致,可以确定糖化液的糖类中还含有果糖,依据峰面积计算得到果糖的含量为11.1%。

图10 果糖标准品高效液相色谱图Fig.10 HPLC chromatogram of fructose standard

图11 碎米糖化液的组分高效液相色谱图Fig.11 HPLC chromatogram of components in saccharified liquid of broken rice
3 结论
本研究碎米液化的最佳工艺条件:料液比为1∶5(g/mL),液化温度 90 ℃,液化时间为 35 min,耐高温α-淀粉酶加酶量40 U/g,pH6.5,得到液化液的DE值为17.2%。糖化的最佳工艺条件:复合型葡糖淀粉酶加酶量330 U/g,糖化温度60℃,糖化时间为48 h,pH4.8,得到的糖化液DE值为99.5%。糖化效果较好。
研究结果表明液化及糖化使用的两种酶用于碎米液化及糖化工艺的作用效果尚佳。采用高效液相色谱法分析了碎米糖化液的糖类成分,其中的葡萄糖、果糖含量分别为73.2%和11.1%。在糖化液中含有少量的果糖,对后续进一步利用葡萄糖异构酶制备果葡糖浆的工艺过程是有利的,可以减少葡萄糖异构酶的用量和缩短异构化反应时间,节约生产成本。
