响应面法优化花椒叶多酚提取工艺及其抗氧化活性
2022-03-27高岳尹帅袁孝瑞刘玉袁一博赵圣明
高岳,尹帅,袁孝瑞,刘玉,袁一博,赵圣明*
(1.苏州农业职业技术学院 食品科技学院,江苏 苏州 215008;2.河南科技学院 食品学院,河南 新乡 453003)
花椒属于芸香科植物,花椒叶多呈卵形和稀披针形,喜爱温暖湿润的环境,耐严寒,抗干旱,抗病性强。全球约有250种花椒,广泛分布在热带和亚热带地区。在我国,花椒主要分布在山东、河南、河北、四川、陕西和长江以南地区[1]。花椒作为一种食品调味料,被誉为“八大调味品”之一,同时又是传统中药,常被用作食品添加剂和药物[2-3]。花椒富含生物碱、挥发油、脂肪酸、香豆素、酰胺和三萜类等生物活性物质[4]。生物碱具有抑菌、抗肿瘤、抑制血小板凝集等生理功能[5];挥发油具有抑菌杀虫、抗氧化等功效[6]。花椒叶和果皮中提取出的香精油可作为植物杀虫剂或驱避剂用于仓库、粮库害虫防治[7]。花椒籽蛋白抗菌肽对枯草芽孢杆菌、大肠杆菌、沙门氏菌、金黄色葡萄球菌等食品中常见有害细菌均有一定抑制作用,且对冷热加工食品均能起到抑菌作用[8]。
植物多酚属于植物次级代谢产物,主要包括花青素、单宁、黄酮、酚酸等活性成分[9]。目前关于植物多酚抗氧化活性的研究较多。张玉娟[10]采用分离纯化技术对花椒叶抗氧化成分进行靶标分离和结构鉴定,明确了花椒叶抗氧化活性基团,并发现黄酮类化合物中抗氧化活性最强的是乙酸乙酯组分和丙酮组分的酚类成分,通过分析活性组分确定花椒叶所含抗氧化物质主要是绿原酸、表儿茶素、芦丁和金丝桃苷等,效果最佳的成分是金丝桃苷和槲皮苷;Sun等[11]测定10种不同品种花椒叶主要黄酮类化合物含量,发现花椒叶主要含金丝桃苷和槲皮苷;范菁华[12]采用超声波辅助提取花椒叶中总黄酮并研究其体外抗氧化活性,发现D4020型树脂纯化的花椒叶总黄酮清除DPPH自由基的效果远优于VC;李君珂等[13]研究发现在白鲢咸鱼加工过程中加入花椒叶多酚可显著降低鱼脂肪氧化程度。响应面法优化已应用于草莓多酚、香水莲花多酚、无花果干等植物多酚的提取[14-16],但目前有关花椒叶多酚的提取工艺优化研究较少。本研究采用响应面法优化正丁醇对花椒叶多酚的提取工艺并对其抗氧化活性进行测定,旨在为有效开发花椒叶提供相关工艺技术参考。
1 材料与方法
1.1 材料与试剂
新鲜花椒叶:采自新乡南太行山区;福林酚试剂:北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):上海源叶生物科技有限公司;没食子酸、碳酸钠:北京奥博星生物技术有限责任公司;正丁醇:湖南汇虹试剂有限公司;乙醇、硫酸亚铁、双氧水:南京化学试剂有限公司;水杨酸:天津市科密欧化学试剂有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸 [2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]:上海阿拉丁生化科技有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
HH-S4型恒温水浴锅:广州一马环保科技有限公司;FW100高速万能粉碎机、WGL-125B电热鼓风干燥箱:天津泰斯特仪器有限公司;WFJ7200型可见分光光度计:尤尼柯(上海)仪器有限公司;MC210S电子天平:赛多利斯科学仪器(北京)有限公司;SHB-III循环水式真空泵:郑州长城科工贸有限公司;RE-2A旋转蒸发仪:上海亚荣生化仪器厂。
1.3 花椒叶多酚提取方法
将新鲜花椒叶清洗干净去除杂质,置于干燥箱中烘干,利用粉碎机粉碎,过20目筛;每个处理组取1.0 g花椒叶粉末用50 mL正丁醇浸提,并抽滤收集各提取液,定容至50 mL备用。
1.4 标准曲线绘制
参考熊汝琴等[17]测定青花椒总酚含量的方法,准确称量0.1 g没食子酸溶解于蒸馏水,定容至100 mL得到质量浓度为1.0 mg/mL的没食子酸溶液,分别取不同体积没食子酸溶液于50 mL容量瓶定容,再取各不同浓度的没食子酸溶液2 mL,加入2 mL福林酚试剂摇匀,静置5 min,加入4 mL体积分数10%的碳酸钠溶液,用蒸馏水定容,用可见分光光度计测定波长765 nm下各标准液吸光度,并绘制标准曲线,得到线性回归方程:y=0.587x-0.026,R2=0.998 6,y 表示吸光度,x表示没食子酸质量浓度(mg/mL)。
1.5 样品多酚含量的测定
吸取0.1 mL多酚提取液按照1.4方法进行显色反应,测定吸光度,利用回归方程求出提取液中多酚含量,利用下式计算样品多酚含量。

式中:Y为样品多酚含量,mg/g;C为提取液多酚浓度,μg/mL;V为提取液体积,mL;X为样品稀释倍数;M为样品取样量,g。

式中:M1为多酚质量,g;M2为花椒叶样品质量,g。
1.6 单因素试验
以花椒叶多酚提取率为因变量,分别以料液比、提取温度、提取时间作为考察因素,探究各单因素对花椒叶多酚提取率的影响。
1.6.1 不同提取温度对花椒叶多酚提取率的影响
准确称量1.0 g花椒叶粉末6份分别置于6个锥形瓶内,并加入50 mL体积分数65%的正丁醇,分别在 40、50、60、70、80、90 ℃下恒温水浴提取 1 h,抽滤收集提取液并定容至50 mL,测量多酚含量,计算多酚提取率。
1.6.2 不同料液比对花椒叶多酚提取率的影响
准确称量1.0g花椒叶粉末6份分别置于6个锥形瓶内,分别以料液比 1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g/mL)于80℃水浴提取1h,抽滤收集提取液并定容至50mL,测量多酚含量,计算多酚提取率。
1.6.3 不同提取时间对花椒叶多酚提取率的影响
准确称量1.0 g花椒叶粉末6份分别置于6个锥形瓶内,并加入50 mL体积分数为65%的正丁醇,在50℃条件下对 6 份样品分别提取 20、40、60、80、100、120 min,抽滤收集提取液并定容至50 mL,测量多酚含量,计算多酚提取率。
1.7 花椒叶多酚提取工艺响应面优化方法
在单因素试验结果基础上,以花椒叶多酚提取率为响应值,进行三因素三水平响应面试验,因素与水平见表1。
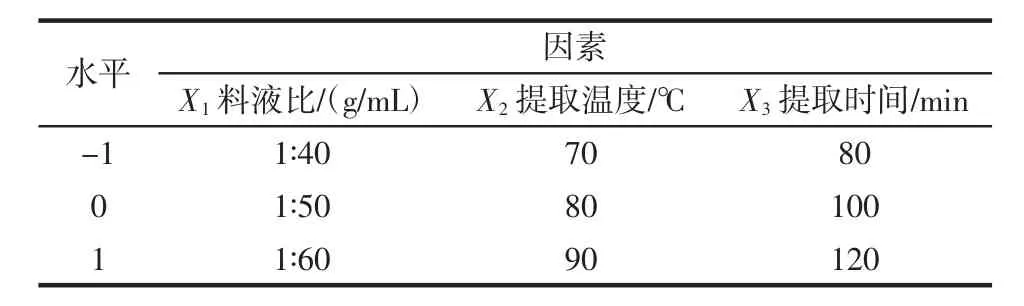
表1 试验因素水平Table 1 Factors and levels of test
1.8 抗氧化活性测定
1.8.1 DPPH自由基清除能力测定
参考王萍等[18]的方法并作修改,称取250 mg的DPPH溶于乙醇,置于250mL容量瓶定容,摇匀静置得到浓度为1 mg/mL的DPPH溶液。取3 mL提取液和3 mL DPPH溶液置于同一比色管混匀,避光静置30 min,以70%乙醇溶液为空白样,在波长517 nm处测得吸光度A1;再分别取3 mL提取液和3 mL 70%乙醇溶液、3 mL DPPH溶液和3 mL 70%乙醇溶液混匀,避光静置30 min,在波长517 nm处分别测得吸光度A2、A3,用下式计算DPPH自由基清除率。
DPPH 自由基清除率/%=[1-(A1-A2)/A3]×100
1.8.2 羟自由基清除能力测定
参考赵楠楠等[19]的方法并作改进,取2 mL提取液于试管中,向试管中加入2 mL FeSO4溶液和2 mL H2O2溶液后振荡摇匀静置10 min,再加入2 mL水杨酸(以50%乙醇溶液为溶剂),静置0.5 h,在510 nm波长处测吸光度,记为A1;并用等体积水代替多酚样液作空白试验测吸光度,记为A2;用等体积水代替水杨酸作对照组测吸光度,记为A3。试验进行3次取平均值,羟自由基清除率计算公式如下。
羟自由基清除率/%=[1-(A1-A3)/A2]×100
1.8.3 ABTS+自由基清除能力测定
参考颜征等[20]的方法,首先配制ABTS溶液,使用7 mmol/L ABTS溶液和4.9 mmol/L过硫酸钾溶液以体积比1∶1混匀,避光静置12 h即得ABTS储备液,取提取液各2 mL加入4 mL的ABTS溶液振荡摇匀,25℃条件下避光充分反应5 min,在734 nm处测样液吸光度,记为A1;取2 mL 95%乙醇和4 mL ABTS溶液在734nm处测对照组溶液吸光度,记为A2;标准管取2mL多酚样液加入4 mL 95%乙醇溶液,波长734 nm处测吸光度,记为A3。试验进行3次取平均值,用下式计算ABTS+自由基清除率。
ABTS+自由基清除率/%=[1-(A1-A3)/A2]×100
1.9 数据处理
采用SPSS 24.0软件进行数据分析,并用Origin 2017软件作图。
2 结果与分析
2.1 花椒叶多酚提取的单因素试验
2.1.1 不同提取温度对花椒叶多酚提取率的影响
提取温度对花椒叶多酚提取率的影响见图1。

图1 提取温度对花椒叶多酚提取率的影响Fig.1 Effect of extraction temperature on the yield of polyphenols from Zanthoxylum bungeanum leaf
如图1所示,花椒叶多酚的提取率随着提取温度的升高而逐渐增大,在90℃时提取率达到最大,为4.5%,可能是较高的提取温度促使分子运动速率加快,利于多酚物质溶出。在40℃~80℃温度范围内,花椒叶多酚提取率随提取温度升高呈显著上升趋势;80、90℃时多酚提取率没有显著性差异。综上,选择提取温度为70、80、90℃进行后续优化试验。
2.1.2 不同料液比对花椒叶多酚提取率的影响
料液比对花椒叶多酚提取率的影响见图2。

图2 料液比对花椒叶多酚提取率的影响Fig.2 Effect of material-to-liquid ratio on the yield of polyphenols from Zanthoxylum bungeanum leaf
由图2可看出,花椒叶多酚提取率随着溶剂体积的增加而逐渐增大,在料液比为1∶60(g/mL)时,多酚提取率达到最大值(4.2%)。料液比在 1∶10(g/mL)~1∶50(g/mL)时,随着溶剂体积增大多酚提取率显著上升,料液比为 1∶50、1∶60(g/mL)时多酚提取率没有显著性差异。综上,选择料液比为 1∶40、1∶50、1∶60(g/mL)进行后续优化试验。
2.1.3 不同提取时间对花椒叶多酚提取率的影响
提取时间对花椒叶多酚提取率的影响见图3。

图3 提取时间对花椒叶多酚提取率的影响Fig.3 Effect of extraction time on the yield of polyphenols from Zanthoxylum bungeanum leaf
由图3可知,花椒叶多酚提取率随着提取时间的延长呈现先显著增大后缓慢减小的趋势,当提取时间为100 min时多酚提取率最大,为4.4%,提取时间超过100 min后多酚的提取率变化不显著。因此选择提取时间80、100、120 min进行后续优化试验。
2.2 响应面结果分析
2.2.1 回归方程的建立及方差分析
响应面试验设计与结果见表2。
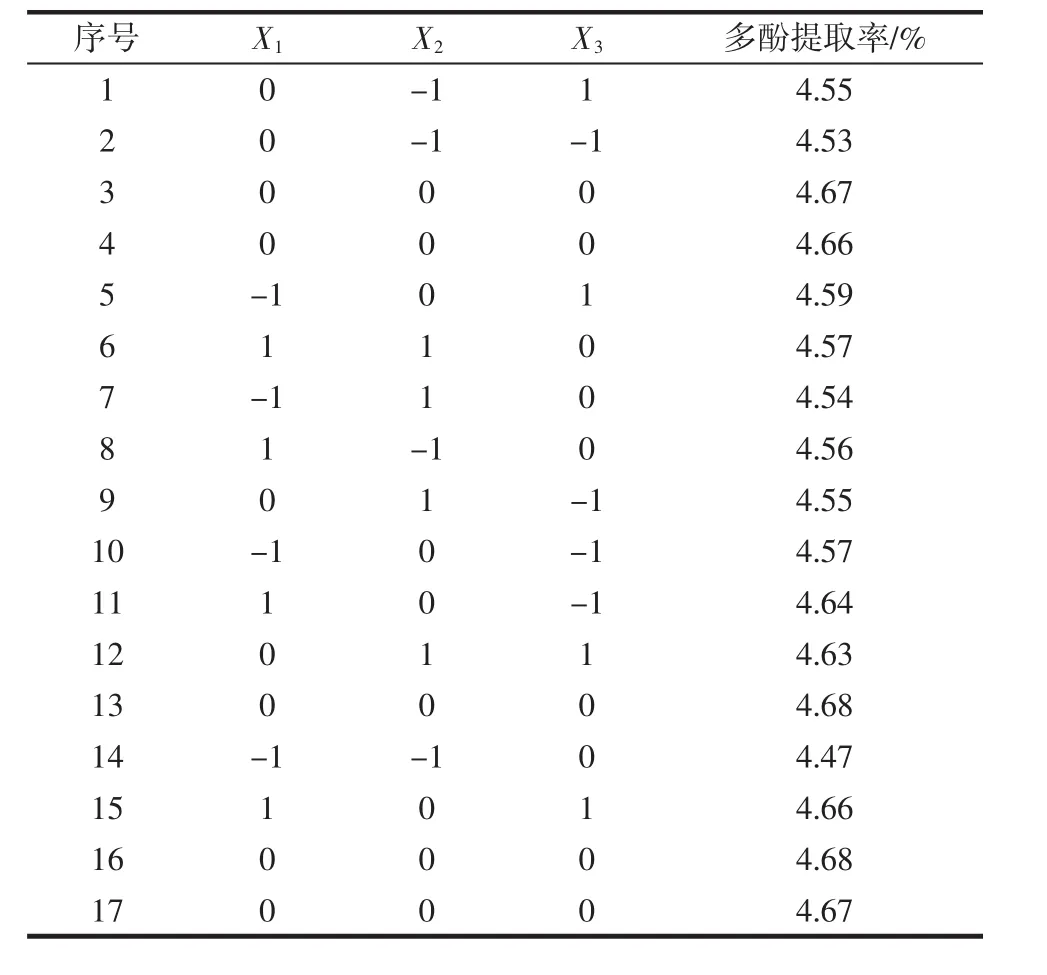
表2 响应面试验设计与结果Table 2 Design and results of response surface methodology
使用Design-Expert 8.0软件对表2结果进行多元回归拟合得到花椒叶多酚提取率(Y)与料液比(X1)、提取温度(X2)、提取时间(X3)之间的回归方程为Y=4.67+0.039X1+0.023X2+0.024X3-0.015X1X2-0.012X1X3+0.015X2X3-0.050X12-0.087X22-0.020X32。
模型方差分析结果如表3所示。

表3 回归模型方差分析Table 3 Variance analysis of regression model
模型F值57.57,P<0.000 1达到了极显著水平,说明该模型具有极显著性;失拟项P=0.144 4>0.05,不显著,表明模型拟合度良好,误差较小。模型相关系数R2=0.986 7,R2Adj=0.969 5,表明使用该模型所得预测值与实际测得值相关性良好,可对花椒叶多酚提取率进行预测。由F值和P值可发现料液比、提取温度、提取时间均对多酚提取率有极显著影响,影响大小依次是料液比>提取时间>提取温度。
2.2.2 各因素交互作用
各因素交互作用的响应面图见图4。

图4 各因素交互作用Fig.4 Interactive effects of various parameters
曲面图可直观反映各因素对多酚提取率的影响程度,曲面图越陡峭说明影响越大,相反,越平缓说明影响越弱。由图4可以看出,料液比与提取温度、提取温度和提取时间之间的响应面较陡峭,等高线呈椭圆形,交互作用显著,与表3方差分析结果一致。
2.2.3 响应面最优条件验证
通过Design-Expert 8.0软件得出花椒叶多酚最佳提取工艺条件为料液比1∶56.08(g/mL)、提取温度80.85℃、提取时间106.96 min,预测多酚提取率为4.68%。为了验证模型的可靠性,采用优化的最佳工艺条件进行验证试验,考虑到实际操作可行性,将工艺参数调整为料液比1∶56(g/mL)、提取温度81℃、提取时间107 min。重复3次取平均值,得到花椒叶多酚提取率为4.63%,这与模型预测的理论值接近。因此,响应面法得到的花椒叶多酚提取工艺参数真实可靠,该模型具有实际应用价值。
2.3 花椒叶多酚抗氧化活性分析
2.3.1 DPPH自由基清除能力
花椒叶多酚和VC对DPPH自由基清除率的影响如图5所示。

图5 花椒叶多酚和VC对DPPH自由基的清除能力Fig.5 DPPH free radical scavenging capacity of polyphenols from Zanthoxylum bungeanum leaf and VC
由图5可知,随着多酚浓度的升高其对DPPH自由基的清除能力逐渐增强,当多酚浓度为1.0 mg/mL时DPPH自由基清除率可高达93.27%,与1.0 mg/mL VC对DPPH自由基的清除能力相当,说明花椒叶多酚对DPPH自由基有较好的清除能力。
2.3.2 羟自由基的清除能力
花椒叶多酚对羟自由基清除率的影响如图6所示。
由图6可以看出,与同浓度的VC相比,花椒叶多酚对羟自由基清除能力较弱,但其仍有一定的清除能力。花椒叶多酚对羟自由基的清除能力随着多酚浓度的升高呈现增高的趋势,在浓度为1.0 mg/mL时羟自由基清除率达到最高值(82.22%)。浓度高于0.6 mg/mL后,花椒叶多酚的羟自由基清除率随多酚浓度变化趋于平缓。

图6 花椒叶多酚和VC对羟自由基的清除能力Fig.6 Hydroxy free radical scavenging capacity of polyphenols from Zanthoxylum bungeanum leaf and VC
2.3.3 ABTS+自由基清除能力
花椒叶多酚和VC对ABTS+自由基清除率的影响如图7所示。
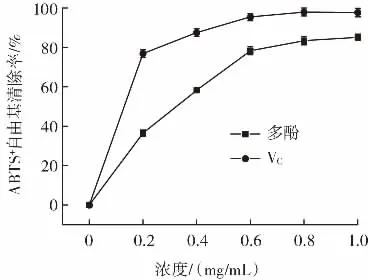
图7 花椒叶多酚和VC对ABTS+自由基的清除能力Fig.7 ABTS+free radical scavenging capacity of polyphenols from Zanthoxylum bungeanum leaf and VC
由图7可知,与同浓度的VC相比,花椒叶多酚对ABTS+自由基清除能力较弱,但其仍有一定的清除能力。随着多酚浓度升高,花椒叶多酚对ABTS+自由基清除率也相应升高,多酚浓度低于0.8 mg/mL时ABTS+自由基清除率随浓度升高呈快速增大的趋势。花椒叶多酚对ABTS+自由基的清除作用间接表明花椒叶多酚具有良好的抗氧化功效。
3 结论
本研究分别考察了料液比、提取温度、提取时间3个因素对花椒叶多酚提取率的影响,并通过响应面法进行优化最终确定花椒叶多酚提取的最佳工艺条件为提取时间 107 min、提取温度 81 ℃、料液比 1∶56(g/mL)。在最优的工艺条件下,花椒叶多酚提取率为4.63%。抗氧化研究结果显示花椒叶多酚对DPPH自由基、羟自由基和ABTS+自由基均具有良好的清除能力。
