云南省不同粒色青稞色素提取工艺优化及其体外抗氧化活性
2022-03-27阮玲丽邹青飞鲁朝凤陈壁杨士花杨明静刘东南李永强
阮玲丽,邹青飞,鲁朝凤,陈壁,杨士花,杨明静,刘东南,李永强*
(1.云南农业大学 食品科学技术学院,云南 昆明 650201;2.云南云测质量检验有限公司,云南 昆明 650201;3.云南农业大学 图书馆,云南 昆明 650201)
青稞(Hordeum vulgare L.var.nudum Hook.f.)是一种内外颖壳分离、籽粒裸露的大麦,又称无壳大麦或裸大麦,主要分布于我国西藏、青海、云南等高原地区[1-2],是唯一能够在高寒、低温及强紫外线辐射的极端条件下生长的谷物[3-4]。青稞因其独特的生长环境不但含有丰富的蛋白质、碳水化合物和不饱和脂肪酸等营养成分[5-6],而且还积累了β-葡聚糖、多酚和色素等功能成分[7]。根据青稞籽粒颜色可将其分为白青稞、黑青稞、紫青稞和蓝青稞等品种[8],其中白青稞与紫青稞的形状为椭圆形,蓝青稞与黑青稞的形状为纺锤形。
色素可分为合成色素和天然色素,合成色素由于具有潜在毒性,对人体会产生一定的毒副作用,因此近些年来被许多国家限制使用[9]。天然色素主要来源于动植物和微生物,不仅具有安全性高、毒性低、着色力强及资源丰富等特点[10],还具有一定的抗氧化[11]、抗炎[12]、保护视力[13]、抑制脂质过氧化[14]、预防糖尿病及心血管疾病[15]等作用,因此越来越受到人们的重视,具有广阔的开发前景。近年来,人们对天然色素的提取工艺、生物活性和生理功能进行了一定的研究。徐洪宇等[16]使用溶剂浸提法、超声波辅助法、微波辅助法和复合酶法对山竹壳色素进行提取,发现微波辅助提取法提取色素的效果最好。东子珺等[17]使用超声波-生物酶协同方法对紫薯色素提取工艺进一步优化,研究发现采用超声波-半纤维素生物酶协同提取紫薯色素的效果最佳。王姗姗等[18]对西藏地区268份具有不同粒色的青稞多酚与花青素含量进行了分析,结果表明,不同粒色青稞的多酚和花青素含量差异显著,其中紫青稞、褐青稞及蓝青稞中多酚和花青素含量均高于白青稞。李昌文等[19]对黑米色素的提取工艺及生物活性进行研究,发现黑米花色苷的抗氧化活性较强并具有较好的生理活性功能。以上研究表明,花色苷作为天然抗氧化剂来源具有一定的优势,但目前对不同粒色青稞色素的研究鲜有报道。因此,本研究对4种不同粒色青稞色素进行初步定性,并在单因素试验的基础上利用响应面试验设计进行提取工艺的优化,同时使用4种体外抗氧化测定体系进行抗氧化活性测定,以期为不同粒色青稞色素的开发利用提供理论依据,为青稞精深加工提供新思路。
1 材料与方法
1.1 材料与试剂
黑青稞、紫青稞、蓝青稞及白青稞:云南省迪庆藏族自治州农科所,除杂后磨粉过50目筛,避光并充氮气于-20℃储存备用。
1,1-二苯基-2-苦基肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)(HPLC≥98%)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2-azinobis(3-ethyl-benzothiazoline-6-sulfonate),ABTS](纯度98%)、2,4,6-三吡啶基三嗪[2,4,6-tris(2-pyridyl)-s-triazine,TPTZ](BR,98%):上海晶纯生化科技股份有限公司;阿魏酸(HPLC≥98%):北京北纳创联生物技术研究院;Trolox(纯度97%):美国Sigma公司。
1.2 仪器与设备
M-304不锈钢五谷杂粮磨粉机:广州雷迈机械设备有限公司;UV1800CP紫外分光光度计:上海美谱达仪器有限公司;HH-4数显恒温水浴锅:金坛市城西丽华实验仪器厂;TDL-5-A离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 青稞色素的初步定性
1.3.1.1 最佳提取溶剂的选择和最大吸收波长的确定
准确称取6份不同粒色青稞面粉各1g,置于100mL碘量瓶中,分别加入20 mL的1%盐酸甲醇、1%盐酸乙醇、1%甲酸甲醇、1%甲酸乙醇、0.1%盐酸甲醇和0.1%盐酸乙醇溶液(以上均为体积分数),在室温(20℃~26℃)避光条件下提取30min,抽滤,分别用不同的提取溶剂定容于25mL棕色容量瓶中,在190nm~1100nm波长内进行全波长扫描,根据吸光度确定不同粒色青稞色素的最佳提取溶剂及最大波长。
1.3.1.2 青稞色素在不同pH值下的颜色变化
分别吸取最佳溶剂提取的4种不同粒色青稞色素溶液,利用1 mol/L的盐酸和氢氧化钠,调节pH值(1~14),观察色素的颜色变化。
1.3.2 单因素试验
1.3.2.1 最佳提取时间的选择
准确称取4种不同粒色青稞面粉1 g置于100 mL碘量瓶中,以1%盐酸甲醇提取黑青稞、紫青稞及蓝青稞,以1%甲酸甲醇提取白青稞,料液比1∶10(g/mL),提取次数为1次,在室温(20℃~26℃)避光条件下分别提取 10、20、30、40、50 min,抽滤后分别用最佳提取溶剂定容于25 mL棕色容量瓶并适当稀释后,于最大吸收波长处测定4种色素的吸光度,并确定最佳提取时间。
1.3.2.2 最佳提取温度的选择
准确称取4种不同粒色青稞面粉1 g置于100 mL碘量瓶中,在避光条件下以1%盐酸甲醇提取黑青稞、紫青稞及蓝青稞,以1%甲酸甲醇提取白青稞,料液比为 1∶10(g/mL),提取时间为 30 min,分别在 25、30、40、50、60℃条件下避光提取,提取次数为1次,抽滤后分别用最佳提取溶剂定容于25 mL棕色容量瓶并适当稀释后,于最大吸收波长测定4种色素的吸光度,确定最佳提取温度。
1.3.2.3 最佳提取次数的选择
准确称取4种不同粒色青稞面粉1 g置于100 mL碘量瓶中,以1%盐酸甲醇提取黑青稞、紫青稞及蓝青稞,以1%甲酸甲醇提取白青稞,料液比为1∶5(g/mL),提取时间为30 min,在室温(20℃~26℃)避光条件下提取1、2、3、4次,抽滤后分别用最佳提取溶剂定容于25 mL棕色容量瓶并适当稀释后,于最大吸收波长测定4种色素的吸光度,确定最佳提取次数。
1.3.2.4 最佳提取料液比的选择
准确称取4种不同粒色青稞面粉1 g置于100 mL碘量瓶中,以1%盐酸甲醇提取黑青稞、紫青稞及蓝青稞,以1%甲酸甲醇提取白青稞,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25(g/mL),提取时间为 30 min,在室温(20℃~26℃)避光条件下提取1次,抽滤后分别用最佳提取溶剂定容于25 mL棕色容量瓶并适当稀释后,于最大吸收波长测定4种色素的吸光度,确定最佳提取料液比。
1.3.3 响应面试验设计
根据单因素试验结果,利用软件Design-Expert 8.0.6进行响应面分析,采用中心组合设计(central composite design,CCD)三因素五水平响应面试验,对4种不同粒色青稞色素的提取工艺进行优化,确定最佳提取条件。
1.3.4 体外抗氧化活性测定
色素溶液的制备:准确称取4种不同粒色青稞面粉各1 g置于100 mL碘量瓶中,按照最优条件提取色素溶液,定容至25 mL棕色容量瓶中备用。
1.3.4.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定参照文献[20-21]的方法,并稍作修改,主要步骤:吸取适量色素溶液,加入2 mL DPPH溶液充分混合,在室温(20℃~26℃)下暗反应10 min,在517 nm波长下测定其吸光度,以甲醇溶液作为空白。用阿魏酸绘制标准曲线,标准曲线方程:y=451.75x+32.31(R2=0.998 7),y为 DPPH 自由基清除率,%,x为阿魏酸浓度,μmol/L。每g样品中DPPH自由基清除能力相当于阿魏酸的μmol数(μmol FAE/g)。

式中:A0为空白溶液的吸光度;A1为样品溶液的吸光度。
1.3.4.2 铁离子还原/抗氧化能力(ferric reducing ability of plasma,FRAP)测定
铁离子还原/抗氧化能力的测定参照文献[22-23]的方法并稍作修改,主要步骤:吸取适量色素溶液,加入3 mL FRAP溶液充分混合,在室温(20℃~26℃)下反应4 min,在593 nm波长下测定吸光度,以乙酸溶液作为空白。用FeSO4标准溶液绘制标准曲线,标准曲线方程:y=6.24x+0.000 5(R2=0.998 4),y为吸光度,x为硫酸亚铁浓度,mmol/L。每g样品中铁离子还原能力相当于Fe2+的 mmol数(mmol FE/g)。1.3.4.3 总抗氧化能力测定
总抗氧化能力(trolox equivalent and antioxidant capacity,TEAC)的测定参照文献[20,24]的方法,并稍作修改,主要步骤:吸取适量色素溶液,加入3.8 mL ABTS工作液,在室温(20℃~26℃)下反应 6 min,在734 nm波长下测定吸光度,以乙醇溶液作为空白组。用Trolox绘制标准曲线,标准曲线方程:y=103.95x+1.566 3(R2=0.998 4),y为 ABTS+自由基清除率,%,x为Trolox浓度,μmol/L。每g样品中ABTS+自由基清除能力相当于Trolox的μmol数(μmol TE/g)。

式中:A0为空白吸光度;A1为样品的吸光度。
1.3.4.4 过氧化氢(H2O2)清除活性测定
过氧化氢清除活性的测定参照文献[23,25]的方法,并稍作修改,主要步骤:吸取适量色素溶液,加入0.9mL H2O2和1.5 mL的磷酸缓冲溶液,在室温(20℃~26℃)下暗反应40 min,在230 nm波长下测定吸光度,以磷酸缓冲溶液作为空白。用阿魏酸绘制标准曲线,标准曲线方程:y=47.338x+32.772(R2=0.998 4),y为 H2O2清除率,%,x为阿魏酸浓度,μmol/L。每g样品中H2O2清除能力相当于阿魏酸的μmol数(μmol FAE/g)。
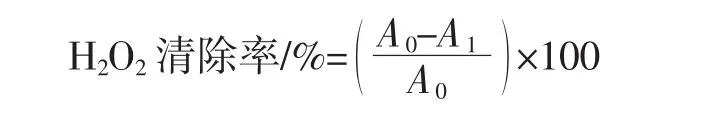
式中:A0为H2O2自身吸光度;A1为样品的吸光度。
1.4 统计分析
利用SPSS 25.0数据处理软件中的Duncan方法对抗氧化活性试验结果进行方差分析,利用Design-Expert 8.0.6软件对响应面回归模型进行方差分析,试验均进行3次重复,结果以平均值±标准偏差表示。
2 结果与分析
2.1 青稞色素初步定性
2.1.1 最佳提取溶剂的选择及最大吸收波长的确定
通过使用6种溶剂对4种不同粒色青稞色素进行提取,并在190 nm~1 100 nm波长内进行全波长扫描,其最大吸收峰结果见图1。
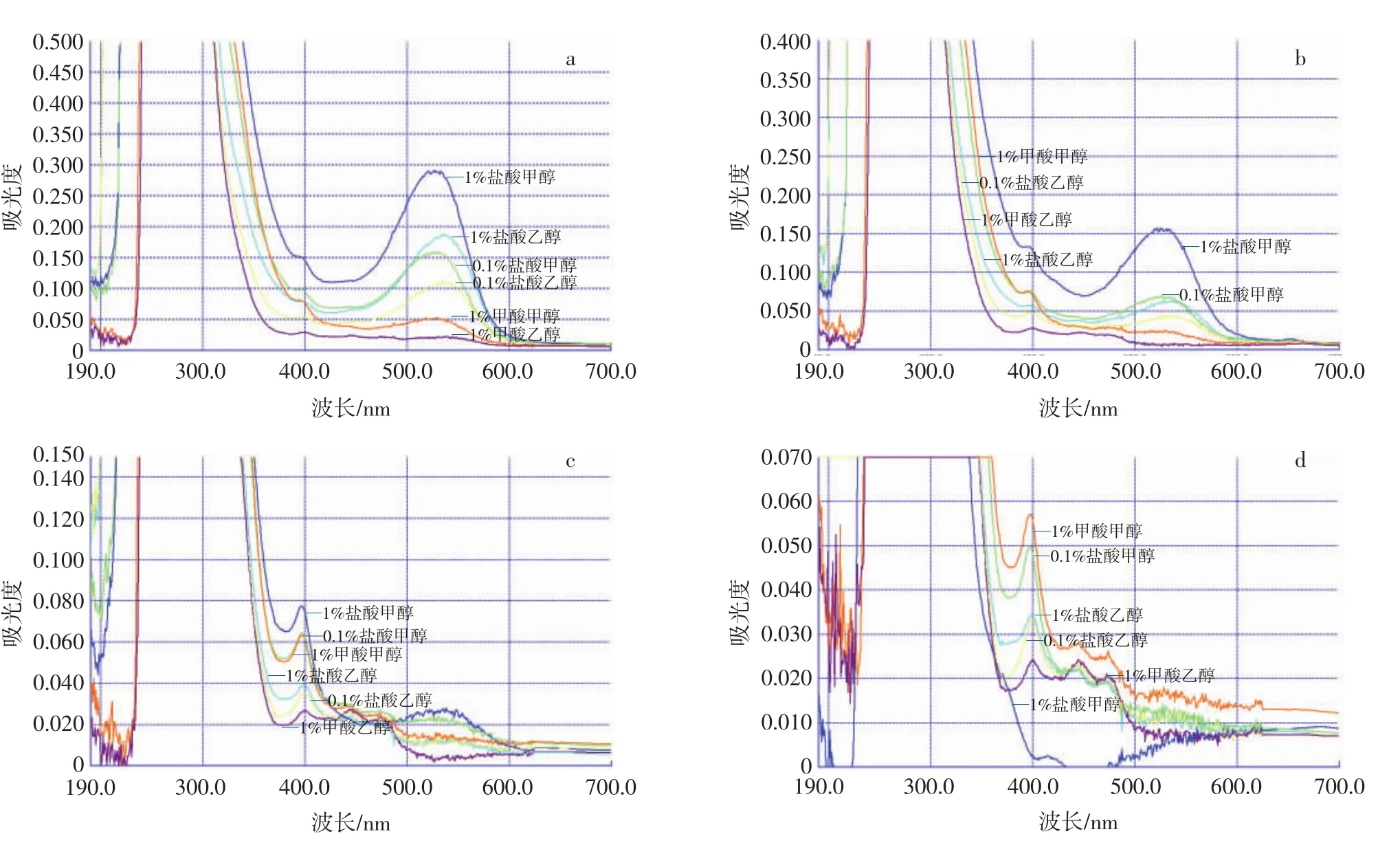
图1 4种青稞色素最大吸收峰扫描图Fig.1 Scanning chart of maximum absorption peaks of four highland barley pigments
由图1可知,黑青稞及紫青稞色素在525 nm~539 nm下均有吸收峰,黑青稞色素在527 nm波长下出现最大吸收峰,紫青稞色素在525 nm波长下出现最大吸收峰;蓝青稞及白青稞色素在396 nm~398 nm均有吸收峰,蓝青稞色素在398 nm出现最大吸收峰,白青稞色素在396 nm出现最大吸收峰。同时可以看出黑青稞、紫青稞及蓝青稞的最佳提取溶剂均为1%盐酸甲醇,白青稞的最佳提取溶剂为1%甲酸甲醇。由于花色苷的特征吸收峰分别在500 nm~540 nm和275 nm附近,且易溶于酸性醇溶液,推断黑青稞和紫青稞色素可能为花色苷[26]。根据文献[27]得知,橙酮的主要吸收峰(带Ⅰ)一般位于370 nm~430 nm,带Ⅱ为次强峰,位于220 nm~270 nm,由此可推断出白青稞和蓝青稞色素可能为橙酮化合物。
2.1.2 不同pH值下色素颜色变化
花色苷是一种水溶性色素,易溶于酸性醇溶液,其颜色会随着溶液的酸度和碱度而变化[28]。不同pH值下4种青稞色素变化见表1。
由表1可知,黑青稞与紫青稞的色素溶液在酸性条件下呈玫红色,随着pH值的升高,颜色由玫红色变为无色,后变为淡黄绿色,最后变成黄绿色,说明此两种色素受pH值大小影响,在酸性条件下色素较为稳定,在碱性条件下不稳定,符合花色苷的性质,因此可进一步将黑青稞及紫青稞色素推断为花色苷[29]。蓝青稞与白青稞的色素溶液在酸性条件下呈淡粉色,随着pH值的升高,颜色由淡粉色变为无色,后变为淡黄色,根据文献[27]可进一步将蓝青稞及白青稞色素推断为橙酮化合物。

表1 不同pH值下4种青稞色素变化Table 1 The pigment changes of four highland barley under different pH values
2.2 单因素试验
2.2.1 最佳提取时间的确定
提取时间对4种青稞色素提取效果的影响见图2。
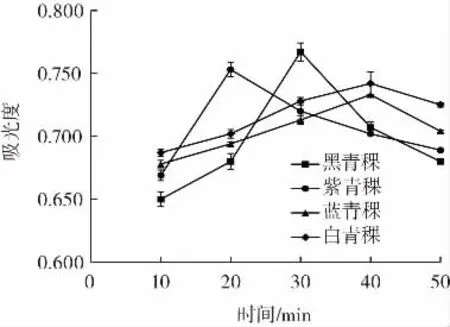
图2 提取时间对青稞色素提取效果的影响Fig.2 Influence of extraction time on the extraction effect of highland barley pigment
由图2可知,随提取时间的增加,4种青稞色素的吸光度呈先增加后缓慢下降的趋势,其中黑青稞色素吸光度在30 min时达到最大值,紫青稞色素在20 min时吸光度达到最大值,而蓝青稞与白青稞色素的吸光度在40 min时也达到最大值。由于光线和氧气都会促进色素的分解,从而导致吸光度下降,因此选择黑青稞、紫青稞、蓝青稞及白青稞色素的提取时间分别为30、20、40、40 min 为宜。
2.2.2 最佳提取温度的确定
提取温度对4种青稞色素提取效果的影响见图3。
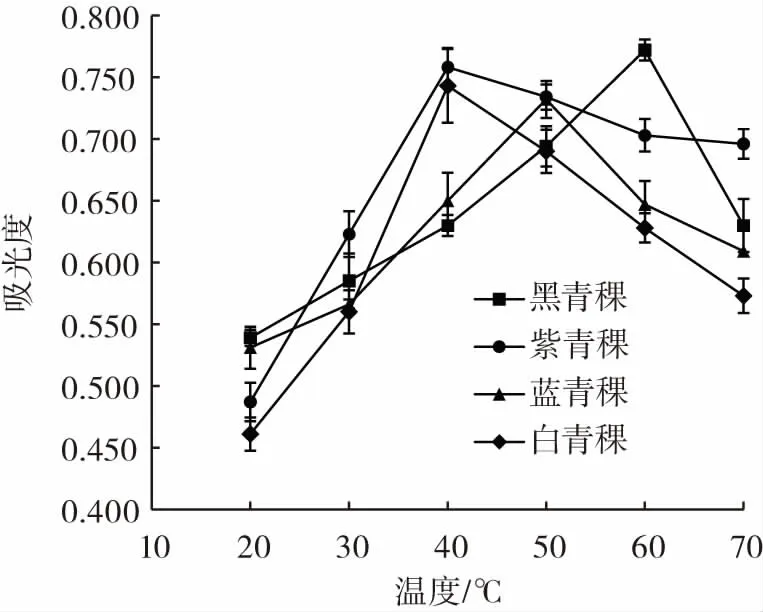
图3 提取温度对青稞色素提取效果的影响Fig.3 Influence of extraction temperature on the extraction effect of highland barley pigment
由图3可知,随提取温度的增加,4种青稞色素的吸光度呈先增加后下降或平缓的趋势,其中黑青稞色素在60℃条件下吸光度最大,紫青稞与白青稞色素在40℃时吸光度最大,蓝青稞色素在50℃条件下吸光度最大,这可能是因为高温导致色素加速降解,降低其稳定性,导致吸光度下降。温度升高有助于提高色素分子的扩散率和溶出率[23],使色素的提取效果更加显著;但由于色素在高温条件下不稳定,易促使结构发生变化,使色素失去保护导致失活[30],因此选择黑青稞、紫青稞、蓝青稞及白青稞色素的提取温度分别为60、40、50、40 ℃为宜。
2.2.3 最佳提取次数的确定
提取次数对4种青稞色素提取效果的影响见图4。
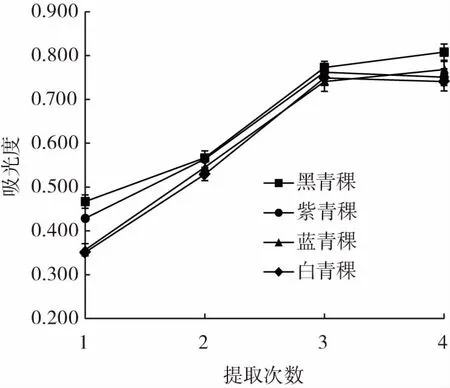
图4 提取次数对青稞色素提取效果的影响Fig.4 Influence of extraction times on the extraction effect of highland barley pigment
由图4可知,随提取次数的增加,4种青稞色素吸光度呈增加趋势,但提取次数达3次以后其吸光度增加缓慢,出现平缓或下降的趋势,说明色素经过几次提取后,颜色基本提取完毕。从经济成本角度考虑,提取色素选择3次较为适宜。
2.2.4 最佳料液比的确定
料液比对4种青稞色素提取效果的影响见图5。

图5 料液比对青稞色素提取效果的影响Fig.5 Influence of material-liquid ratio on the extraction effect of highland barley pigment
由图5可知,随提取溶剂用量的增加,4种青稞色素吸光度呈增加趋势,其中黑青稞、紫青稞与白青稞在料液比为1∶15(g/mL)之后,色素的吸光度增加不明显且逐渐趋于平缓,而蓝青稞在料液比为1∶20(g/mL)之后,色素的吸光度逐渐趋于平缓,考虑到增加料液比会导致试验试剂的浪费,因此选择料液比为1∶15(g/mL)较为适宜。
2.3 响应面优化青稞色素提取工艺
2.3.1 响应面试验设计及结果
在单因素试验基础上,选择色素的提取时间、提取温度和料液比3个因素,采用响应面分析方法进行三因素五水平试验设计,4种青稞色素响应面试验设计与结果见表2~表5。

表2 黑青稞响应面试验设计及结果Table 2 Response surface test design and results of black highland barley

表3 紫青稞响应面试验设计及结果Table 3 Response surface test design and results of purple highland barley
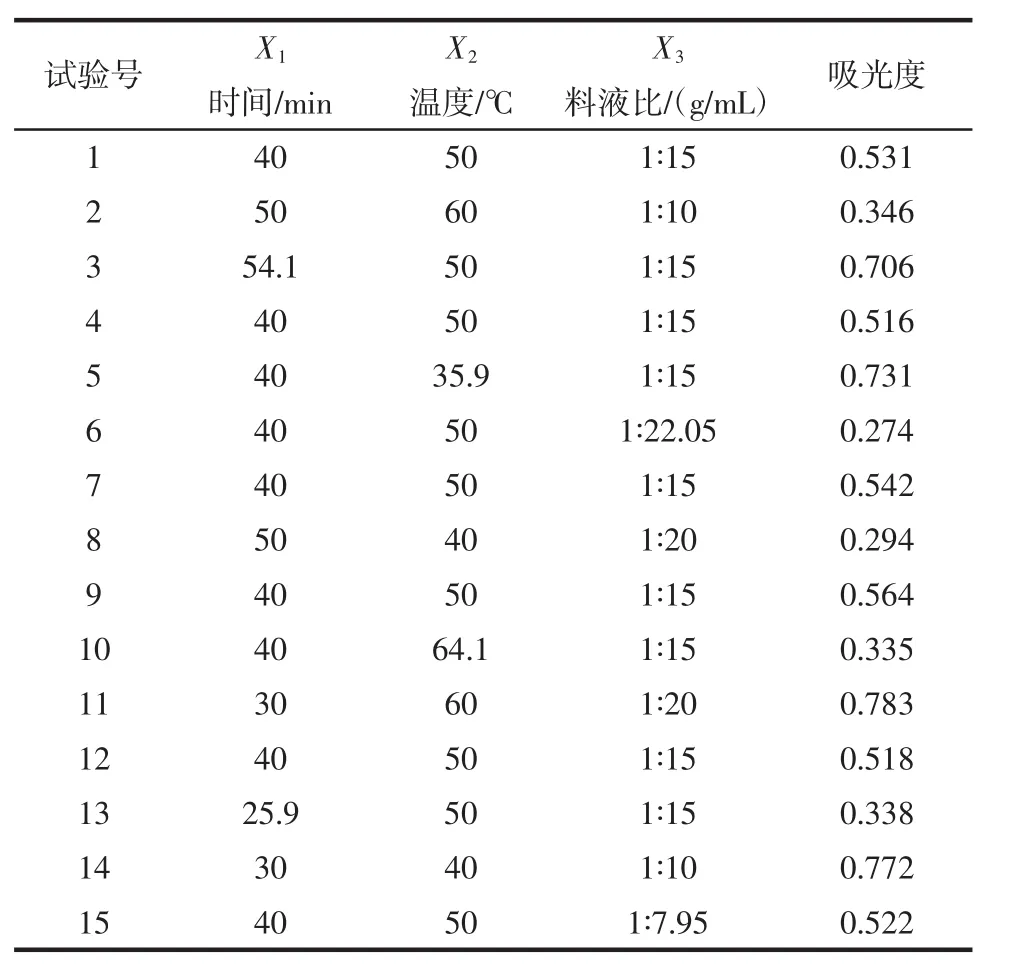
表4 蓝青稞响应面试验设计及结果Table 4 Response surface test design and results of blue highland barley

表5 白青稞响应面试验设计及结果Table 5 Response surface test design and results of white highland barley

续表5 白青稞响应面试验设计及结果Continue table 5 Response surface test design and results of white highland barley
2.3.2 响应面试验结果分析
采用Design-expert 8.0.6软件对表2~表5所得的试验数据进行多元回归拟合分析,以吸光度值为响应值得拟合二次回归方程如下:黑青稞色素Y=0.552 93+0.017324X1-0.023335X2-0.010960X3+0.00228984X1X2+0.036 915X1X3+0.021 074X2X3-0.118 87X12-0.113 62X22-0.115 37X32;紫青稞色素Y=0.319 67-0.012 021X1-0.045 255X2+0.131 17X3-0.080 082X1X2-0.052 005X1X3-0.039 271X2X3;蓝青稞色素Y=0.738 52-0.036 770X1-0.065054X2+0.00777817X3+0.00677817X1X2-0.092 054X1X3-0.073 77X2X3-0.22 391X12-0.150 41X22-0.088 907X32;白青稞色素Y=0.725 04+0.166 52X1+0.169 35X2+0.188 8X3+0.091 298X1X2+0.216 35X1X3+0.133 02X2X3-0.203 56X12-0.182 06X22-0.205 81X32。
4种青稞方差分析结果见表7~表10。由表7~表10可知,4种青稞色素的回归模型中拟合检验P<0.01,均达到极显著水平,失拟项检验P>0.05,失拟项均不显著,说明以上方程与实际情况拟合良好,在一定程度上能够反映色素提取效果与提取温度、提取时间和料液比的关系。
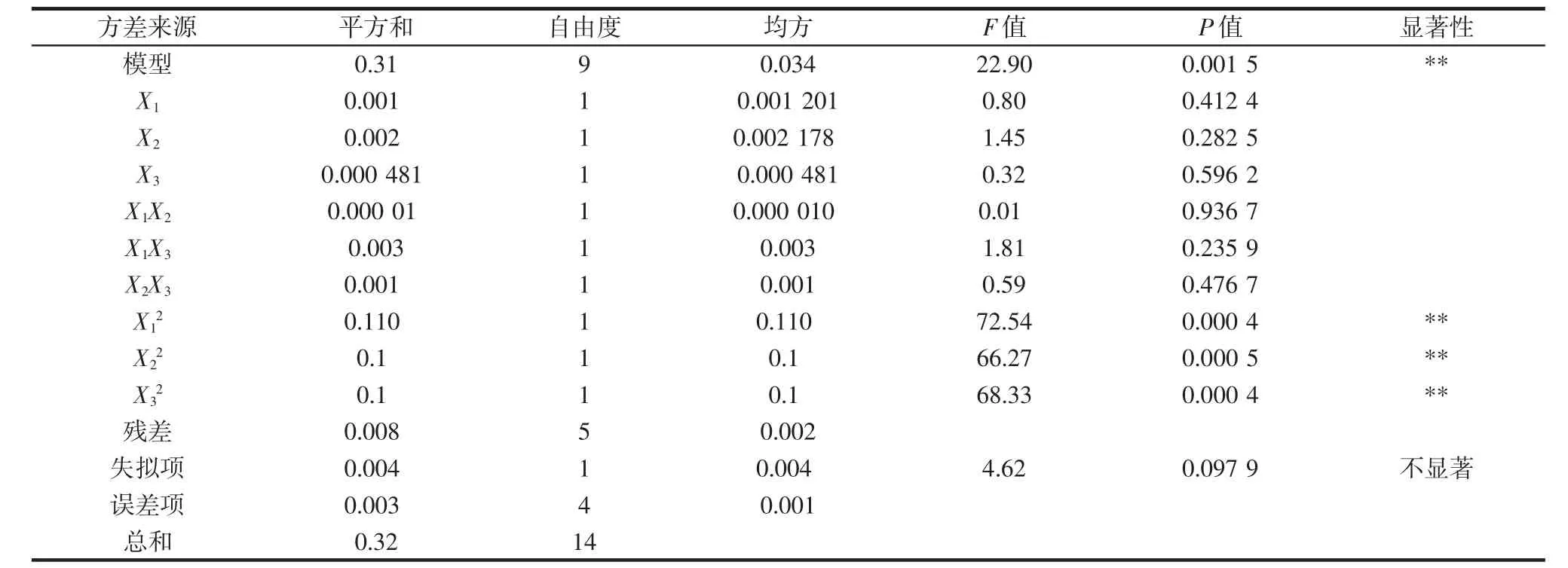
表6 黑青稞回归模型方差分析Table 6 The variance analysis of black highland barley regression model

表7 紫青稞回归模型方差分析Table 7 The variance analysis of purple highland barley regression model

表8 蓝青稞回归模型方差分析Table 8 The variance analysis of blue barley regression model
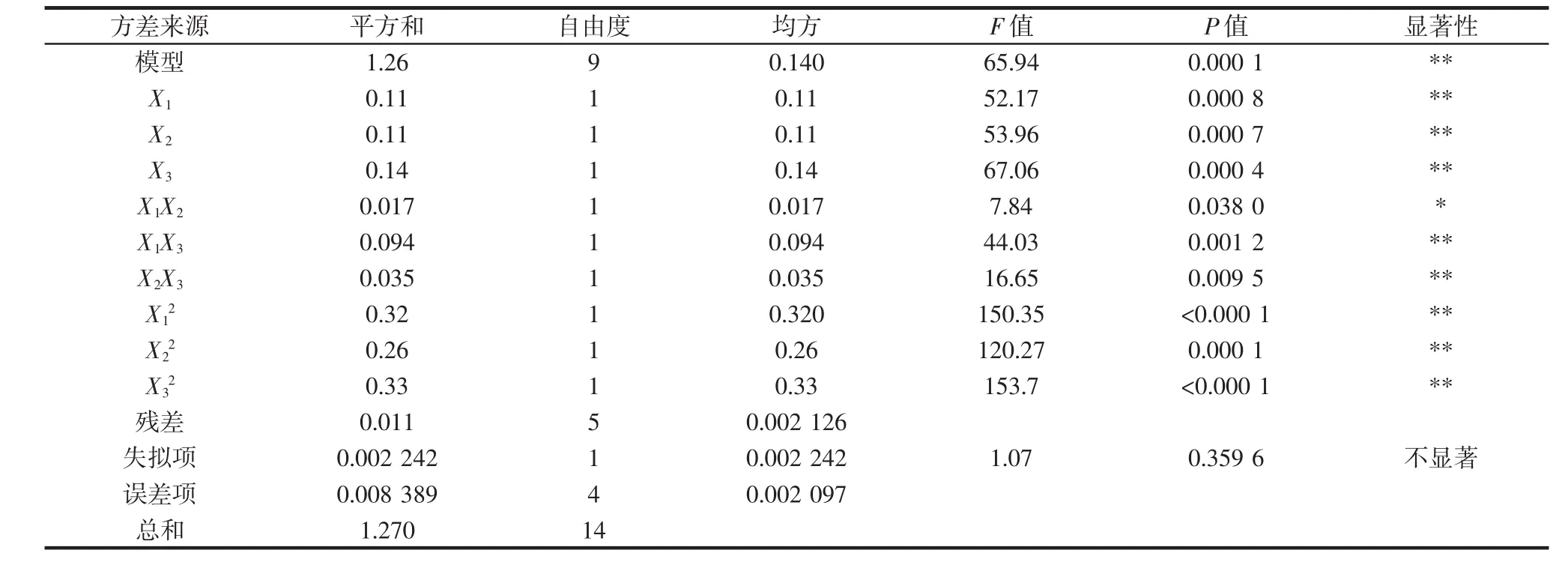
表9 白青稞回归模型方差分析Table 9 The variance analysis of white highland barley regression model
2.3.3 验证试验
由Design-Expert 8.0.6软件得到黑青稞色素的最佳提取工艺条件:提取温度59℃、提取时间30 min、料液比1∶20(g/mL),紫青稞色素的最佳提取工艺:提取温度 30℃,提取时间 30min,料液比 1∶15(g/mL),蓝青稞色素的最佳提取工艺:提取温度47℃,提取时间38 min,料液比1∶17(g/mL),白青稞色素的最佳提取工艺:提取温度 41 ℃,提取时间 41 min,料液比 1∶16(g/mL)。在最佳提取条件下提取的黑青稞色素、紫青稞色素、蓝青稞色素及白青稞色素的预测吸光度分别为0.554、0.346、0.531和0.753,在该条件下进行验证试验,它们的实际吸光度分别为 0.552、0.341、0.527和 0.751,与理论值相近,说明使用响应面法提取4种青稞色素的优化方案是可靠的。
2.4 抗氧化活性的测定
4种青稞色素体外抗氧化活性见表10。

表10 4种不同粒色青稞色素的抗氧化活性测定Table 10 The antioxidant capacity of four kinds of barley pigments with different grain colors
利用DPPH自由基清除能力、铁离子还原/抗氧化能力(FRAP)、总抗氧化能力(TEAC)及过氧化氢(H2O2)清除能力4种方法测定黑青稞、紫青稞、蓝青稞及白青稞色素的体外抗氧化活性。由表11可知,4种青稞色素具有较好的抗氧化活性,其中黑青稞色素清除DPPH自由基及FRAP能力最强,分别为(7.54±0.0087)μmol/g及(29.28±1.64)mmol/g;紫青稞色素清除H2O2能力最强,为(21.05±2.47)μmol/g;白青稞色素清除ABTS自由基的能力最强,为(92.99±4.62)μmol/g。
3 结论
本文制取了云南产黑青稞、紫青稞、蓝青稞及白青稞色素的粗提物,经全波长扫描确定了4种不同粒色青稞色素的最大吸收波长和最佳提取溶剂,其中黑青稞色素与紫青稞色素分别在527 nm及525 nm波长下具有特征吸收峰,蓝青稞色素和白青稞色素分别在398 nm和396 nm波长下具有特征吸收峰,根据特征吸收峰将黑青稞与紫青稞色素初步定性为花色苷,蓝青稞及白青稞色素初步定性为橙酮化合物,同时确定了黑青稞、紫青稞与蓝青稞色素的最佳提取溶剂是1%盐酸甲醇,白青稞色素的最佳提取溶剂是1%甲酸甲醇。经响应面方法优化了4种色素的提取工艺,其中黑青稞色素的最佳提取工艺为提取温度59℃,提取时间 30 min,料液比 1∶20(g/mL);紫青稞色素的最佳提取工艺为提取温度30℃,提取时间30 min,料液比1∶15(g/mL);蓝青稞色素的最佳提取工艺为提取温度47 ℃,提取时间 38 min,料液比 1∶17(g/mL);白青稞色素的最佳提取工艺为提取温度41℃,提取时间41 min,料液比 1∶16(g/mL),4 种青稞色素提取物在不同的抗氧化评价体系中均具有较好的抗氧化活性。本研究为青稞色素开发利用提供科学依据,同时也为青稞的精深加工提供了新思路,后续可进一步对色素在加工和储存过程中的稳定性进行更深入的研究,从而拓宽其应用范围,实现色素在加工产业链中的综合开发和高值化利用。
