长链非编码RNA在阿尔茨海默病中的研究进展
2022-03-26熊婉迪徐开宇陆林李家立2
熊婉迪,徐开宇,陆林,3,李家立2,
综 述
长链非编码RNA在阿尔茨海默病中的研究进展
熊婉迪1,徐开宇4,陆林1,3,李家立2,4
1. 北京大学前沿交叉学科研究院生命联合中心,北京 100091 2. 北京大学中国药物依赖性研究所,北京 100191 3. 北京大学第六医院,北京 100191 4. 中国科学院昆明动物研究所, 中国科学院&云南省动物模型与人类疾病机理重点实验室,昆明 650223
阿尔茨海默病(Alzheimer's disease, AD)是常见的神经退行性疾病,也是最为常见的一类老年痴呆类型。AD主要的病理变化包括淀粉样蛋白(amyloid-β, Aβ)沉积、tau蛋白过度磷酸化、胆碱能神经元的缺失、神经炎症以及代谢障碍等。然而,有关AD具体的发病机制和分子谱尚不清楚,这给AD的诊断和治疗带来很大的挑战。越来越多的研究发现,长链非编码RNA (long non-coding RNAs, lncRNAs)在AD发病机制中发挥着重要作用。本文就lncRNAs在AD的研究进展,从lncRNAs通过影响Aβ聚积、突触功能、炎症反应和线粒体功能等方面参与AD的发病来展开综述介绍,为AD早期诊断的生物标志物和药物治疗靶点提供新思路。
长链非编码RNA;阿尔茨海默病;β淀粉样蛋白;突触功能
阿尔茨海默病(Alzheimer’s disease, AD)是常见的中枢神经系统退行性疾病,也是最为常见的一种痴呆类型。临床上,AD患者主要表现为记忆障碍、语言障碍和执行功能障碍等,一旦发病就很难逆转。随着全球人口老龄化的日益加重,AD患者数量也逐渐增多,这给全球各国的医疗卫生系统带来巨大的负担,因此探究AD的发病机制和研发更加有效的治疗手段具有十分重要的意义。长链非编码RNA (long non-coding RNAs, lncRNAs)是一类长度大于200个核苷酸的非编码RNA,作为一类基因表达的调控因子,可以通过表观遗传、转录和转录后调控参与多种疾病的发生。近年来,lncRNAs在神经退行性疾病的相关研究取得了很大的进展,且发现lncRNAs的表达失调与AD的发生发展有着密切的关系。本文针对lncRNAs在AD中的研究现状进行总结,重点介绍lncRNAs在AD发生发展过程中的具体功能及相关的作用机制,为AD的早期诊断和治疗提供新的思路。
1 AD研究概况
AD的发病机制较为复杂,包含多种假说,如淀粉样蛋白(amyloid-β, Aβ)级联假说、tau蛋白过度磷酸化假说、胆碱能假说、神经炎症以及代谢障碍等[1,2]。淀粉样蛋白级联假说被认为在AD众多发病假说中占据着主要地位,Aβ是AD的发生发展中的核心环节和制动环节,β-淀粉样蛋白前体(amyloid-β precursor protein, APP)、早老素-1 (PSEN1)和早老素-2 (PSEN2)基因突变将引起AD患者脑中Aβ生产和清除机制的稳态失衡,进而形成Aβ的异样沉积和老年斑。AD的另一个病理特征为tau蛋白过度磷酸化形成的神经原纤维缠结,表明tau蛋白的磷酸化失衡在AD发病过程中有着密切的影响作用[3]。大脑皮层中胆碱能神经元的结构变化和功能失调都将对认知功能特别是学习记忆功能造成重大的影响,而胆碱能神经元的丢失,也是AD最为显著的病理特征之一[4]。葡萄糖作为大脑的主要供能物质,其在大脑内的运输和利用出现紊乱,将导致脑能量代谢障碍。AD中的糖代谢障碍常表现为葡萄糖摄取不足,胰岛素抵抗和糖基化。当葡萄糖的摄取不足时,会影响到PIK3-AKT信号通路介导的胰岛素信号传导。当大脑发生胰岛素抵抗时,将激活下游的mTOR信号通路,进而诱发和加重AD[5,6]。除此之外,线粒体作为细胞的能量工厂,在能量代谢、衰老和神经退行病变等方面的影响被研究者广泛关注。2018年,由Swerdlow等[7,8]提出的“线粒体级联假说”,作为“淀粉样级联假说”的补充,逐渐引起研究者的重视。最新的研究显示,研究人员通过机器学习算法筛选出靶向线粒体自噬的诱导剂,可以显著改善神经元的功能,选择性清除大脑中的“垃圾”,在细胞、秀丽隐杆线虫()和小鼠()中,均能显著改善AD相关病理症状[9]。中枢神经系统的细胞组成和功能极为复杂,包含多种亚型的神经元,胶质细胞和血管细胞,在AD脑组织中,神经元和胶质细胞的不同占比水平会导致基因出现异质性表达差异。随着单细胞转录组测序技术的发展,研究者们也逐渐从蛋白水平拓展到从转录组水平对AD的机制展开深入探索,对AD中细胞的基因表达图谱进行绘制,促进基因到机制的转化[10]。得益于测序技术的迅速发展,越来越多的研究发现,一些常见的AD风险基因位点多位于功能不详的基因非编码区,这为AD的机制解析提供了更多的新思路。
2 lncRNAs的分类及功能
非编码RNA(non-coding RNAs, ncRNAs)曾被认为是转录噪声并没有生物学功能,随着测序技术的高速发展,越来越多的ncRNAs被发现在很多生理或病理过程中发挥着重要的作用[11,12]。在细胞内,ncRNAs的种类根据其大小和功能可分为:核糖体RNA (ribosomal RNA, rRNA)、转运RNA (transfer RNA, tRNA)、核内小RNA (small nuclear RNA, snRNA)、核仁小RNA (small nucleolar RNA, snoRNA)、小非编码RNA (microRNA, miRNA)和长链非编码RNA (long non-coding RNA, lncRNA)等。其中转录本超过200个核苷酸的非编码RNA,被称为长链非编码RNA,其在序列、结构和功能上存在高度的进化保守性和异质性[13]。根据lncRNAs在基因编码的位置,主要分为:反义型(antisense lncRNAs)、内含子型(intronic lncRNAs)、双向型(bidiractional lncRNAs)、基因间型(intergenic lncRNAs)、启动子型(promoter- associateed lncRNAs)和启动子上游型(promoter upstream lncRNAs)等(图1)。
为了更加深入地了解lncRNAs的功能,研究者们通过RNA pull-down、染色质免疫共沉淀和RNA免疫共沉淀等分子技术来探索lncRNAs与转录因子、蛋白、mRNA和DNA等生物分子相互结合所形成的基因调控网络,进而分析lncRNAs的生物学功能和作用机制。根据lncRNAs的靶基因作用位置,可以分为顺式调控和反式调控。根据其分子机制,lncRNAs的作用模式可以分为“信号分子”、“诱饵分子”、“引导分子”和“骨架分子”等(图2),通过顺式或者反式作用对染色质进行修饰和直接对转录进行调控,进而参与到基因调控的过程中,发挥其生物学功能[14,15]。
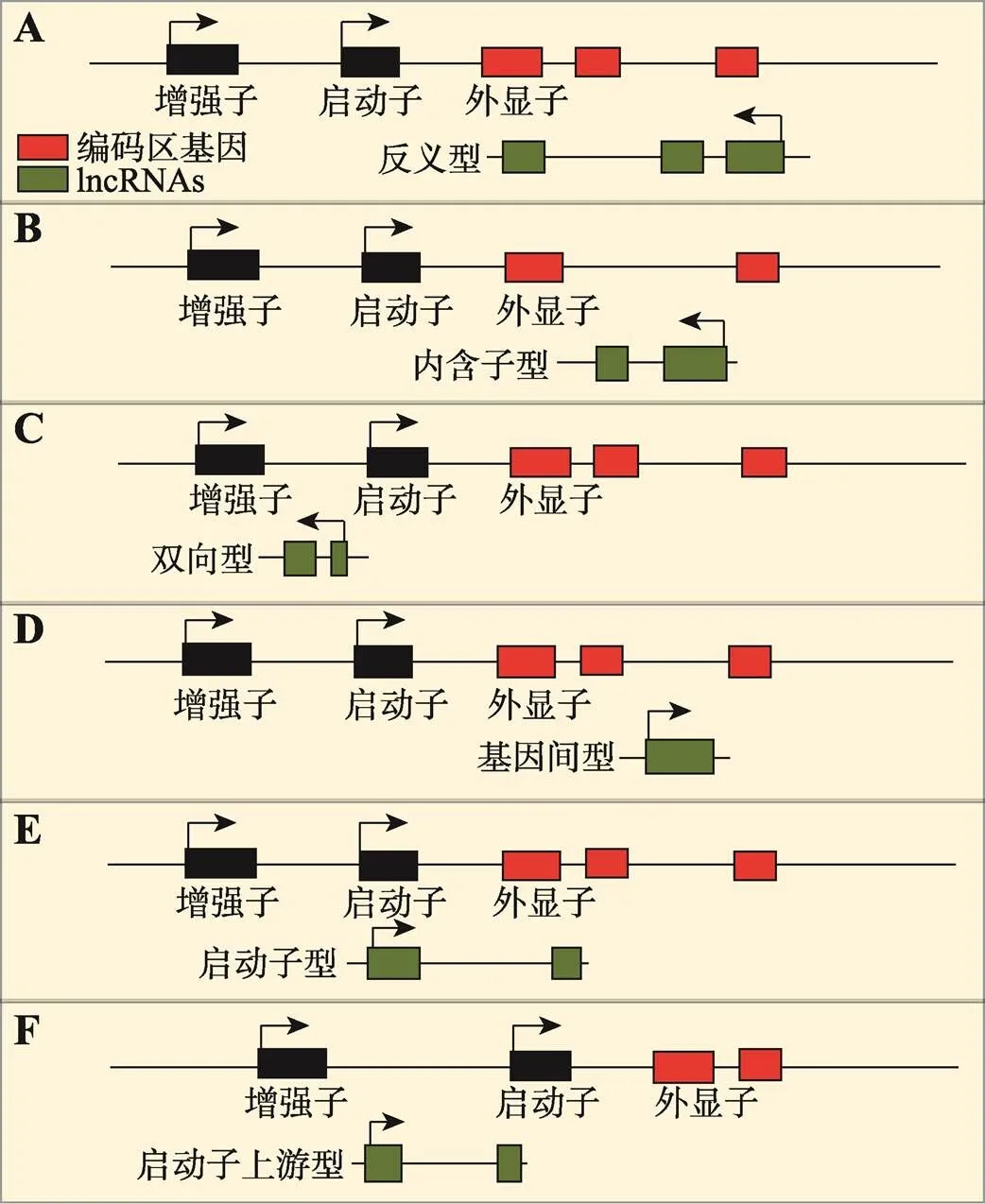
图1 lncRNAs的产生模式
A:反义型lncRNAs,转录于蛋白质编码基因的反义链,可与蛋白质编码基因的内含子、外显子或者全序列互补配对;B:内含子型lncRNAs,转录于蛋白质编码基因的内含子序列;C:双向型lncRNAs,转录于蛋白质编码基因的两条反向互补链;D:基因间型lncRNAs,转录于蛋白质编码基因的间隔序列区域;E:启动子型lncRNAs,转录于启动子区域;F:启动子上游型lncRNAs,转录于启动子上游区域。
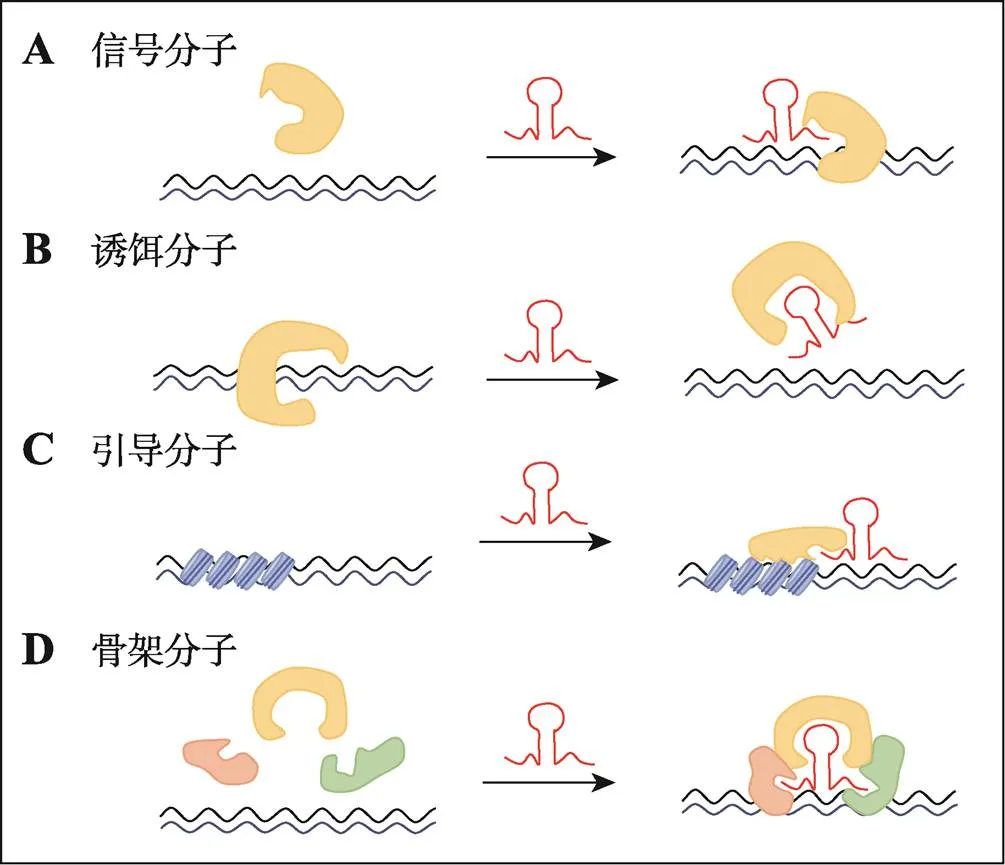
图2 lncRNAs的作用模式
A:“信号分子”模式,指lncRNAs可以招募转录因子蛋白到靶基因的启动子区域,调控下游基因的表达;B:“诱饵分子”模式,指lncRNAs可以与某特定蛋白结合,如一些转录因子和DNA结合蛋白,而使蛋白不与目标基因结合,进而阻止转录因子与DNA的结合;C:“引导分子”模式,指lncRNAs可以与染色质组蛋白修饰酶互作形成复合物,并引导该复合物到特定的染色质区域进行表观遗传调控;D:“骨架分子”模式,也称为“脚手架”模式,指lncRNAs可以作为支架与多种蛋白质结合形成复合物,进而发挥生物调控功能。
lncRNAs在生理和病理的状态下有着多样的生物功能。随着高通量测序技术的迅速发展和对lncRNAs研究的不断深入,人们逐渐认识到lncRNAs在神经退行性疾病中的作用。研究者们通过芯片技术、深度测序和实时定量PCR等方法,发现一些lncRNAs,如和等,在AD患者脑脊液和血液中存在表达失调的现象。结合小鼠模型和细胞系的研究结果,越来越多与AD发病相关的lncRNAs的作用机制也被阐明,这提示着lncRNAs在AD的发生和发展过程中发挥着重要的作用。
3 lncRNAs与AD
近年来,由于lncRNAs的功能和作用机制逐渐明晰,越来越多的研究发现,在AD患者,小鼠模型的一些脑区中,lncRNAs存在表达失调的现象。下面对与AD发病机制相关的lncRNAs进行总结(表1)。

表1 lncRNAs在AD中的研究
↑表示基因表达上调;↓表示基因表达下调。
3.1 lncRNAs与衰老
衰老是许多神经退行性疾病的主要危险因素,随着对lncRNAs的功能研究逐渐明晰,许多lncRNAs被发现在衰老和相关脑疾病中有着重要的影响作用。lncRNAs可以通过调控细胞周期进程进而参与到细胞衰老途径中。在细胞衰老的周期进程中,p53/p21是关键的调节途径,p53是一种转录因子,通过调控细胞周期、细胞凋亡和细胞应激反应来保护基因组的完整性。在应激反应时,会激活触发p53的多效性事件,p21作为事件下游的靶标分子会对其产生响应,并作为增殖抑制因子,介导细胞周期停滞于G1/S阶段。lincRNA,属于基因间长链非编码RNA,是p53基因下游的转录本。lincRNA可以作为反式作用因子激活的表达,同时作为p53基因的下游靶标分子,也会反向作用于p53相关的基因,在p53通路中发挥着转录因子的功能,抑制转录复合物,在细胞凋亡中起着重要的作用[16,17]。
端粒损伤主要表现为端粒结构序列逐渐缩短和端粒酶丢失,是细胞衰老的一个重要表型。长链非编码端粒重复RNA (telomeric repeat containing RNA,)通过与TR模板碱基互补配对从而抑制端粒的延长,也可以通过与人异质性胞核核糖核蛋白A1 (human heterogeneous nuclear ribonucleoprotein A1, hnRNP A1)的相互作用来阻碍端粒的延长。hnRNP A1作为hnRNP家族的重要成员,其功能与RNA转录、pre-RNA的成熟与降解,mRNA翻译和细胞的增生等密切相关,而过量hnRNP A1又会与端粒末端引物区结合的方式抑制端粒酶的活性,因此和hnRNP A1的平衡对于端粒酶维持正常的功能有密切的关系[18,19]。
3.2 lncRNAs影响Aβ沉积
Aβ的异常沉积是AD最重要的病理学特征之一。Aβ是胞外老年斑的主要组成成分,是由淀粉样蛋白前体(amyloid-β precursor protein, APP)经β-分泌酶和γ-分泌酶途径剪接加工后形成的。淀粉样前体蛋白裂解酶1反向转录物(β-site-APP cleavageenzyme-1 antisence,)是目前在AD中研究较为透彻的lncRNA。Faghihi等[20]发现在AD患者脑组织中呈现表达上升的现象,同时在HEK-SW细胞中,发现经过活性氧、缺氧和Aβ42的应激后,细胞中的也会表达上调。的功能发挥并非与的编码基因形成二聚体来抑制其mRNA的转录,与之相反的是,是通过掩盖mRNA上miR-485-5p的结合位点,去除miR-485-5p对mRNA的抑制作用,促进BACE1蛋白的表达,进而通过转录后前馈机制产生更多的Aβ42。过多的Aβ42会造成Aβ42和Aβ40的平衡紊乱,导致Aβ的异常沉积形成老年斑,加重AD病情。除此之外,在体外细胞实验中,作为竞争性的内源RNA,还能与靶向结合BACE1的miR-29、miR-107、miR-124、miR-485和miR-761等竞争结合位点,增加BACE1的表达,促进Aβ聚积[21]。
分拣蛋白相关受体L1 (sortilin related receptor 1, SORL1)是与AD患病风险相关的新发危险因素之一,其在神经系统内表达,作为分选蛋白受体穿梭于细胞膜、细胞质、内体和高尔基体之间,在神经元中发挥转运的作用[22]。SORL1将APP转运至高尔基体中,减少APP运输到含Aβ分泌酶的内体隔室,从而抑制APP进一步剪切生成Aβ。长链非编码RNA是的反义转录本,可以反义链的形式结合到基因的内含子1区。可以选择性剪接mRNA的表达,破坏SORL1对APP的转运阻隔作用,并进一步增加Aβ的形成与聚积。研究报道,在AD患者的大脑皮质区表达上调,而在AD患者的血浆中,也发现了的水平显著增加,且的水平含量与认知评分呈负相关性[23]。
3.3 lncRNAs调控突触功能
突触功能失调以及突触数目减少是AD的病理特征之一。脑细胞质RNA1 (brain cytoplasmic RNA 1,或者)在突触可塑性中发挥着重要作用。能靶向定位于突触,调控突触后膜局部蛋白质的合成,这对维持长时程突触可塑性有着重要作用。在AD的发病过程中,随着病程的发展,突触可塑性出现损伤性变化。Mus等[24]发现,在生理条件的衰老过程中,在正常老年人的大脑前额皮层区,随着年龄的增加的表达水平会下调。相反的是,在AD患者的脑中水平较同龄对照组表达上升,并且其水平与AD病情的严重程度呈现正性相关。正常生理条件下,定位于轴突末梢,参与神经元突触局部定位蛋白的合成,而在AD的早期和晚期阶段,的分布会发生变化,其表达位点由原来的突触末梢转移到胞体位置,并成簇状定位于核周,丧失了对突触后膜相关蛋白的调控作用。的错误定位和异位表达,导致原本正常的微管依赖的运输功能受到影响,造成轴突和树突的营养物质运输受到阻断,进而加速AD的病理改变[25,26]。
神经营养因子主要由海马和大脑皮层的神经元产生,对神经元的生存、分化和修复,以及神经元的功能有着重要的影响,进而对学习记忆和突触可塑性进行调控。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是有大脑合成的具有保护神经元功能的蛋白质。脑源性神经营养因子反义长链非编码RNA ()是的互补反义链,可以作为诱导分子,募集染色质组蛋白修饰物,如PRC2到靶基因启动子区域,进而具有调控BDNF表达水平的作用。BDNF的表达水平在神经退行性疾病和神经发育紊乱的情况下会受到显著的表达抑制,在AD患者的脑中会出现表达下调的现象,而则呈现负性相关的增长[27]。研究结果表明,在脑室注射Aβ42构建的AD模型小鼠中,通过给海马脑区立体微注射递送的siRNA,可以抑制的水平并特异性的增加mRNA的水平,促进BDNF的合成,为AD的治疗乃至神经退行性疾病的治疗都提供了潜在的药物靶点[28~30]。
3.4 lncRNAs与神经炎症相关
神经母细胞瘤分化标志物29 (neuroblastoma differentiation marker 29,)是由RNA聚合酶III转录所得的lncRNA,位于11号染色体11p15.3上,可以诱导神经母细胞瘤细胞的分化。Massone等[31]发现,在SKNBE2人源神经母细胞瘤细胞系中,上调的水平会促进APP的合成进而导致Aβ42/Aβ40的比例升高。当脑部经一些炎症刺激后,的表达会上调和Aβ的聚积会增加,而经抗炎药物处理后,其表达水平则下降,也一定程度降低了Aβ的积聚。RNA聚合酶III转录的的表达量水平依赖于炎症刺激,这提示着在中枢系统的脑疾病中,特别是AD中,继发性的脑炎症反应,将增大的损伤作用,进而又反向加重AD的病理变化[32]。
lncRNA是G蛋白偶联受体51基因(G protein-coupled receptor 51,)的选择性表达产物,位于的3号内含子区,能与γ-氨基丁酸B型(γ-aminobutyric B type, GABAB)基因内含子区域进行互补,通过选择性剪接来影响GABAB受体亚型的水平。GABAB受体在神经炎症和调控胶质细胞功能等方面有着重要的作用,通过激活特异性钾离子通道来影响GABAB受体的生物学功能,调控Aβ的分泌。GABAB2受体含A和B两种变异体,Massone等[33]研究发现,在SH-SY5Y细胞中过表达可以抑制GABAB2受体A变异体的表达,而增加B变异体的水平,并促进Aβ42的聚积。降低的表达水平后,GABAB2受体B变异体增加,Aβ42减少。在AD患者的脑中,炎症反应能刺激的表达,增加Aβ42的分泌,进而加重AD疾病进程。lncRNA在AD组织中的表达上调也提示着它可能直接或者间接的方式参与到AD的发生发展过程。
3.5 lncRNAs调控线粒体功能
核富集转录体1 (nuclear enriched abundant transcript 1,)是由RNA聚合酶II转录的多腺苷酸化非编码RNA,位于染色体11q13中多种内分泌肿瘤1型(multiple endocrine neoplasia type 1,)基因位点。NEAT1在哺乳动物细胞的发育和维持中发挥着重要作用,其表达水平与癌细胞的增殖、迁移和侵袭能力密切相关。此外,还发现与CNS疾病密切相关。Huang等[36]研究发现,当APP/PS1小鼠月龄大于六个月时,小鼠脑的表达呈现上调的现象。一些探索机制的实验结果显示,主要通过调控细胞自噬和线粒体功能参与到AD的发生发展过程中。可与NEDD4L进行互作,促进PTEN诱导激酶(PTEN induced putative kinase1, PINK1)的泛素化和降解,进而损伤PINK1依赖的线粒体自噬功能。而当被敲除后,会降低其对PINK1依赖的线粒体自噬功能的损伤,进而挽救AD相关的病理变化。
线粒体作为半自性的细胞器,有着自己的遗传物质基因组,能够独立完成复制、转录和翻译部分线粒体相关的蛋白。线粒体基因组由重链和轻链组成,其中重链包含2个核糖体RNA基因,14个转运RNA基因和13个蛋白编码基因,轻链只有1个ND6蛋白编码基因和8个转运RNA基因,此外,线粒体基因组还负责编码部分的lncRNAs (图3)[40]。与核基因组相比,线粒体基因组分子量小,缺乏组蛋白的保护,容易受到活性氧等的损伤,故线粒体基因组的突变率高于核基因组。线粒体基因组的高突变率会对线粒体的结构和功能造成重大损伤,一方面会影响线粒体编码基因的蛋白功能,这也将影响到由线粒体编码的lncRNAs,如和等对线粒体基因表达的调控作用,进而诱发线粒体相关的功能障碍[41]。Liu等[42]研究报道,基于猕猴脑组织测序的结果,发现在猕猴大脑的发育、成熟和衰老过程,一些lncRNAs会呈现出时空特异性的表达变化,其中一条线粒体基因组编码的lncRNA在皮层和海马的脑区中会随着年龄的增加呈现出表达下调的动态变化,这提示着线粒体基因组编码的lncRNAs在与脑衰老相关的神经退行性疾病包括AD、PD、HD和ALS中有着重要的调控作用,可以通过调节线粒体功能,如线粒体动力学、生物能合成和代谢、线粒体自噬等,来影响神经元的结构和功能,直接或间接参与到神经退行性疾病的发病过程(图3)。
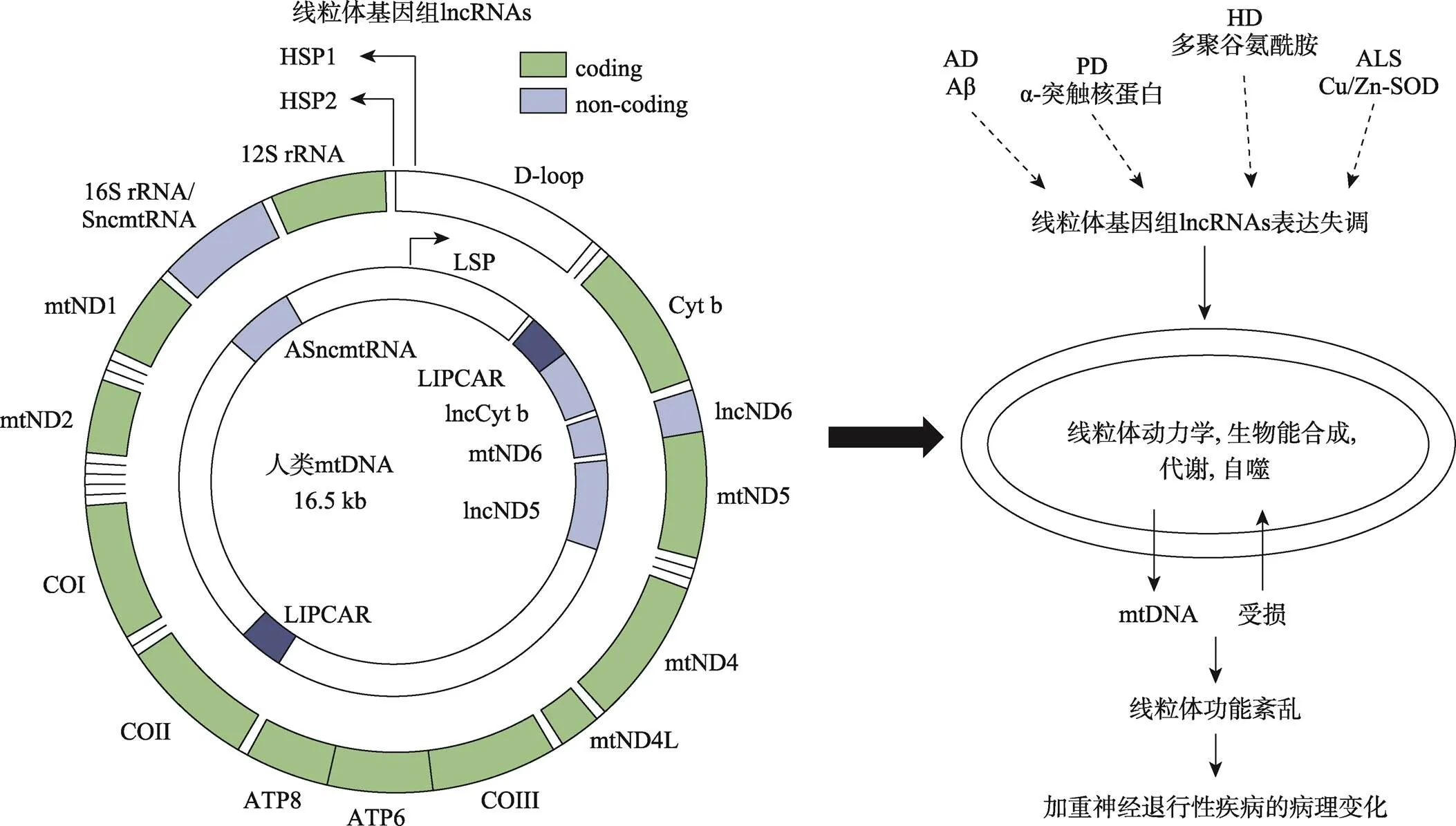
图3 线粒体基因组示意图及lncRNAs潜在的调控机制
线粒体基因组是由重链和轻链组成的环形DNA,其中重链包含2个核糖体RNA基因,14个转运RNA基因和13个蛋白编码基因,轻链只有1个ND6蛋白编码基因和8个转运RNA基因。此外线粒体基因组还编码SncmtRNA、ASncmtRNA-1、ASncmtRNA-2和LIPCAR等lncRNAs。HSP1:重链启动子1;HSP2:重链启动子2;LSP:轻链启动子。
4 结语与展望
随着基因组学研究的不断深入,lncRNAs在AD领域的研究备受关注。虽然与AD有关的lncRNAs的数目在日益增长,但人们对lncRNAs在AD中的生物学功能知之甚少,大多数的研究仍局限在实验室的探索阶段,距离临床的应用转化,道长且阻。现有的基于lncRNAs设计的药物包括:设计特殊位点的siRNAs来抑制相应lncRNAs的功能;通过反义寡核苷酸,补缺siRNAs因lncRNAs的二级结构带来的应用局限性;人工合成RNAs分子模拟物;应用天然反义转录物(natural antisense transcripts, NATs)拮抗剂,来沉默NATs的基因表达,进而提高被NATs所抑制的编码基因蛋白表达。虽然已有一部分的非编码RNA药物已经被FDA批准用于一些疾病的治疗,但将lncRNAs推向临床相关的诊断和药物研发还有许多问题需要解决,其中包括:(1)在AD病理条件下,需要解读更多的lncRNAs,找到与AD密切相关的关键lncRNAs分子;(2) AD的治疗环境是中枢神经系统,需要解决lncRNAs治疗的特异性和靶向性问题;(3) lncRNAs作为核酸分子,易被核酸酶降解,需要设计更为安全的递送系统,将lncRNAs高效地递送到治疗靶点;(4) lncRNAs分子具有免疫原性,需要确保lncRNAs用于基因治疗的安全性,降低其不良反应。
此外,目前的报道主要都是核基因组编码的lncRNAs在AD中的研究,而线粒体基因组编码的lncRNAs作为细胞lncRNAs的重要组成部分,也发挥着不可或缺的作用,但是目前有关线粒体基因组来源的lncRNAs的生物学功能尚不清楚,其自身基因组信息的变化如何参与到调控线粒体的功能进而影响AD的发病还有待研究,所以线粒体基因组来源的lncRNAs在AD的功能和作用机制也值得研究者们更多地去关注和探索。
[1] Brody H. Alzheimer's disease., 2011, 475(7355): S1.
[2] Hodson R. Alzheimer's disease., 2018, 559(7715): S1.
[3] Busche MA, Wegmann S, Dujardin S, Commins C, Schiantarelli J, Klickstein N, Kamath TV, Carlson GA, Nelken I, Hyman BT. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models., 2019, 22(1): 57–64.
[4] Quirion R, Wilson A, Rowe W, Aubert I, Richard J, Doods H, Parent A, White N, Meaney MJ. Facilitation of acetylcholine release and cognitive performance by an M(2)- muscarinic receptor antagonist in aged memory-impaired., 1995, 15(2): 1455–1462.
[5] Butterfield DA, Halliwell B. Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease., 2019, 20(3): 148–160.
[6] Kuehn BM. In Alzheimer research, glucose metabolism moves to center stage., 2020, 323(4): 297–299.
[7] Swerdlow RH. Mitochondria and mitochondrial cascades in Alzheimer's disease., 2018, 62(3): 1403–1416.
[8] Swerdlow RH, Burns JM, Khan SM. The Alzheimer's disease mitochondrial cascade hypothesis., 2010, 20 Suppl 2(Suppl 2): S265–S279.
[9] Xie CL, Zhuang XX, Niu ZM, Ai RX, Lautrup S, Zheng SJ, Jiang YH, Han RY, Gupta TS, Cao SQ, Lagartos- Donate MJ, Cai CZ, Xie LM, Caponio D, Wang WW, Schmauck-Medina T, Zhang JY, Wang HL, Lou GF, Xiao XL, Zheng WH, Palikaras K, Yang G, Caldwell KA, Caldwell GA, Shen HM, Nilsen H, Lu JH, Fang EF. Amelioration of Alzheimer's disease pathology by mitophagy inducers identified via machine learning and a cross-species workflow., 2022, 6(1): 76–93.
[10] Fyfe I. Single-cell atlas maps cell-specific gene changes in Alzheimer disease., 2020, 16(1): 1.
[11] Palazzo AF, Koonin EV. Functional long non-coding RNAs evolve from junk transcripts., 2020, 183(5): 1151–1161.
[12] Yang F, Yi F, Cao HQ, Liang ZC, Du Q. The emerging landscape of long non-coding RNAs., 2014, 36(5): 456–468.
杨峰, 易凡, 曹慧青, 梁子才, 杜权. 长链非编码RNA研究进展. 遗传, 2014, 36(5): 456–468.
[13] Sharma H, Carninci P. The secret life of lncRNAs: conserved, yet not conserved., 2020, 181(3): 512– 514.
[14] Engreitz JM, Haines JE, Perez EM, Munson G, Chen J, Kane M, McDonel PE, Guttman M, Lander ES. Local regulation of gene expression by lncRNA promoters, transcription and splicing., 2016, 539(7629): 452– 455.
[15] Statello L, Guo CJ, Chen LL, Huarte M. Gene regulation by long non-coding RNAs and its biological functions., 2021, 22(2): 96–118.
[16] Tang SS, Zheng BY, Xiong XD. LincRNA-p21: implications in human diseases., 2015, 16(8): 18732–18740.
[17] Yoon JH, Abdelmohsen K, Srikantan S, Yang XL, Martindale JL, De S, Huarte M, Zhan M, Becker KG, Gorospe M. LincRNA-p21 suppresses target mRNA translation., 2012, 47(4): 648–655.
[18] de Silanes IL, Stagno d'Alcontres M, Blasco MA. TERRA transcripts are bound by a complex array of RNA-binding proteins., 2010, 1: 33.
[19] Aguado J, di Fagagna FD, Wolvetang E. Telomere transcription in ageing., 2020, 62: 101115.
[20] Faghihi MA, Modarresi F, Khalil AM, Wood DE, Sahagan BG, Morgan TE, Finch CE, Laurent GS, Kenny PJ, Wahlestedt C. Expression of a noncoding RNA is elevated in Alzheimer's disease and drives rapid feed-forward regulation of beta-secretase., 2008, 14(7): 723– 730.
[21] Zeng T, Ni HT, Yu Y, Zhang MK, Wu MJ, Wang QL, Wang LJ, Xu S, Xu ZY, Xu C, Xiong J, Jiang JF, Luo Y, Wang Y, Liu HQ. BACE1-AS prevents BACE1 mRNA degradation through the sequestration of BACE1-targeting miRNAs., 2019, 98: 87–96.
[22] Rogaeva E, Meng Y, Lee JH, Gu YJ, Kawarai T, Zou FG, Katayama T, Baldwin CT, Cheng R, Hasegawa H, Chen FS, Shibata N, Lunetta KL, Pardossi-Piquard R, Bohm C, Wakutani Y, Cupples LA, Cuenco KT, Green RC, Pinessi L, Rainero I, Sorbi S, Bruni A, Duara R, Friedland RP, Inzelberg R, Hampe W, Bujo H, Song YQ, Andersen OM, Willnow TE, Graff-Radford N, Petersen RC, Dickson D, Der SD, Fraser PE, Schmitt-Ulms G, Younkin S, Mayeux R, Farrer LA, St George-Hyslop P. The neuronal sortilin- related receptor SORL1 is genetically associated with Alzheimer disease., 2007, 39(2): 168–177.
[23] Ciarlo E, Massone S, Penna I, Nizzari M, Gigoni A, Dieci G, Russo C, Florio T, Cancedda R, Pagano A. An intronic ncRNA-dependent regulation of SORL1 expression affecting Aβ formation is upregulated in post-mortem Alzheimer's disease brain samples., 2013, 6(2): 424–433.
[24] Mus E, Hof PR, Tiedge H. Dendritic BC200 RNA in aging and in Alzheimer's disease., 2007, 104(25): 10679–10684.
[25] Yang SM, Lim KH, Kim SH, Joo JY. Molecular landscape of long noncoding RNAs in brain disorders., 2021, 26(4): 1060–1074.
[26] Li HY, Zheng L, Jiang AH, Mo Y, Gong Q. Identification of the biological affection of long noncoding RNA BC200 in Alzheimer's disease., 2018, 29(13): 1061– 1067.
[27] Mori Y, Tsuji M, Oguchi T, Kasuga K, Kimura A, Futamura A, Sugimoto A, Kasai H, Kuroda T, Yano S, Hieda S, Kiuchi Y, Ikeuchi T, Ono K. Serum BDNF as a potential biomarker of Alzheimer's disease: verification through assessment of serum, cerebrospinal fluid, and medial temporal lobe atrophy., 2021, 12: 653267.
[28] Policarpo R, Sierksma A, De Strooper B, d'Ydewalle C. From junk to function: lncRNAs in CNS health and disease., 2021, 14: 714768.
[29] Modarresi F, Faghihi MA, Lopez-Toledano MA, Fatemi RP, Magistri M, Brothers SP, van der Brug MP, Wahlestedt C. Inhibition of natural antisense transcriptsresults in gene-specific transcriptional upregulation., 2012, 30(5): 453–459.
[30] Ding YT, Luan WK, Shen XL, Wang Z, Cao YJ. LncRNA BDNF-AS as ceRNA regulates the miR-9-5p/BACE1 pathway affecting neurotoxicity in Alzheimer's disease., 2022, 99: 104614.
[31] Massone S, Ciarlo E, Vella S, Nizzari M, Florio T, Russo C, Cancedda R, Pagano A. NDM29, a RNA polymerase III-dependent non coding RNA, promotes amyloidogenic processing of APP and amyloid β secretion., 2012, 1823(7): 1170–1177.
[32] Ahmadi S, Zobeiri M, Bradburn S. Molecular mechanisms underlying actions of certain long noncoding RNAs in Alzheimer's disease., 2020, 35(5): 681– 693.
[33] Massone S, Vassallo I, Fiorino G, Castelnuovo M, Barbieri F, Borghi R, Tabaton M, Robello M, Gatta E, Russo C, Florio T, Dieci G, Cancedda R, Pagano A. 17A, a novel non-coding RNA, regulates GABA B alternative splicing and signaling in response to inflammatory stimuli and in Alzheimer disease., 2011, 41(2): 308–317.
[34] Yin RH, Yu JT, Tan L. The role of SORL1 in Alzheimer's disease., 2015, 51(3): 909–918.
[35] Chen FH, Danladi J, Ardalan M, Elfving B, Müller HK, Wegener G, Sanchez C, Nyengaard JR. A critical role of mitochondria in BDNF-associated synaptic plasticity after one-week vortioxetine treatment., 2018, 21(6): 603–615.
[36] Huang ZH, Zhao J, Wang W, Zhou J, Zhang J. Depletion of lncRNA NEAT1 rescues mitochondrial dysfunction through NEDD4L-dependent PINK1 degradation in animal models of Alzheimer's disease., 2020, 14: 28.
[37] Gu C, Chen C, Wu RP, Dong T, Hu XJ, Yao YP, Zhang Y. Long noncoding RNA EBF3-AS promotes neuron apoptosis in Alzheimer's disease., 2018, 37(3): 220–226.
[38] Zhang L, Fang Y, Cheng X, Lian YJ, Xu HL. Silencing of long noncoding RNA SOX21-AS1 relieves neuronal oxidative stress injury in mice with Alzheimer's disease by upregulating FZD3/5 via the Wnt signaling pathway., 2019, 56(5): 3522–3537.
[39] Wang JD, Zhou TT, Wang T, Wang BL. Suppression of lncRNA-ATB prevents amyloid-β-induced neurotoxicity in PC12 cells via regulating miR-200/ZNF217 axis., 2018, 108: 707–715.
[40] Mercer TR, Neph S, Dinger ME, Crawford J, Smith MA, Shearwood AM, Haugen E, Bracken CP, Rackham O, Stamatoyannopoulos JA, Filipovska A, Mattick JS. The human mitochondrial transcriptome., 2011, 146(4): 645–658.
[41] Rackham O, Shearwood AMJ, Mercer TR, Davies SMK, Mattick JS, Filipovska A. Long noncoding RNAs are generated from the mitochondrial genome and regulated by nuclear-encoded proteins., 2011, 17(12): 2085– 2093.
[42] Liu SL, Wang ZB, Chen D, Zhang BW, Tian RR, Wu J, Zhang Y, Xu KY, Yang LM, Cheng C, Ma J, Lv LB, Zheng YT, Hu XT, Zhang Y, Wang XT, Li JL. Annotation and cluster analysis of spatiotemporal- and sex-related lncRNA expression in rhesus macaque brain., 2017, 27(9): 1608–1620.
Research progress on lncRNAs in Alzheimer’s disease
Wandi Xiong1, Kaiyu Xu4, Lin Lu1,3, Jiali Li2,4
Alzheimer’s disease (AD) is the common neurodegenerative disease in the center never system and the typical dementia in old people. The major pathological changes of AD are the accumulation of amyloid-β (Aβ) plaques, neurofibrillary tangles, loss of cholinergic neurons, inflammation and metabolism dysfunction. However, the molecular mechanism leading to AD pathogenesis is not clear. More and more studies reported that long non-coding RNAs (lncRNAs) play important roles in AD. In this review, we briefly introduce the recent research progress on lncRNAs in AD, including their regulation of clearance of the Aβ plaques, synaptic function, inflammation reaction and mitochondrial function, and thus providing the references for that lncRNAs can serve as a potential diagnostic biomarker and therapeutic target in AD.
lncRNA; Alzheimer’s disease; amyloid-β; synaptic function
2021-12-20;
2022-01-21;
2022-02-16
国家自然科学基金项目(编号:81761128036)资助[Supported by the National Natural Science Foundation of China (No. 81761128036)]
熊婉迪,在读博士研究生,研究方向:神经生物学。E-mail: wandibear@pku.edu.cn
李家立,博士,研究员,研究方向:神经生物学。E-mail: lijiali@mail.kiz.ac.cn
10.16288/j.yczz.21-427
(责任编委: 单革)
