以手性1-氮杂螺[4.4]壬烷骨架为中间体合成(-)-Cephalotaxine的研究进展
2022-03-25刘建银范玉雪
刘建银, 范玉雪, 张 建,2*
(1. 甘肃中医药大学 药学院,甘肃 兰州 730000;2. 甘肃省高校中(藏)药化学与质量研究省级重点实验室,甘肃 兰州 730000)
三尖杉碱(Cephalotaxine, I)是Paudler等[1]首次从日本粗榧和三尖杉的枝叶中分离得到一种结晶性生物碱。1969年,Arbraham小组[2]通过三尖杉碱碘甲烷盐的X-射线单晶衍射照片确定其结构,发现虽然三尖杉碱碘甲烷盐为非光学活性的,但天然的三尖杉碱具有光学活性,因此可能是三尖杉碱在与碘甲烷成盐的过程中发生了消旋。1974年,Powell小组[3]确定了三尖杉碱的绝对立体构型为3S,4S,5R(Chart 1)。
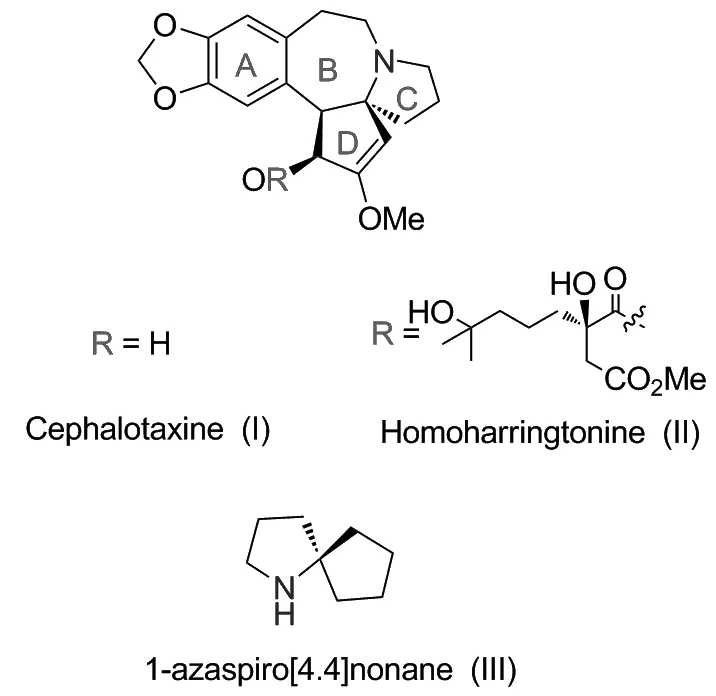
Chart 1
Scheme 1
三尖杉碱是多种抗肿瘤活性三尖杉酯碱的母核结构。在各种三尖杉酯碱中,高三尖杉酯碱(Homoharringtonine, II)因具有较好的抗癌活性而受到重视。1978年,中国正式将其纳入临床,主要用于治疗癌症及白血病等疾病。2012年,美国食品药品监督管理局(FDA)批准高三尖杉酯碱用于治疗慢性粒细胞白血病(CML)适应症[4]。
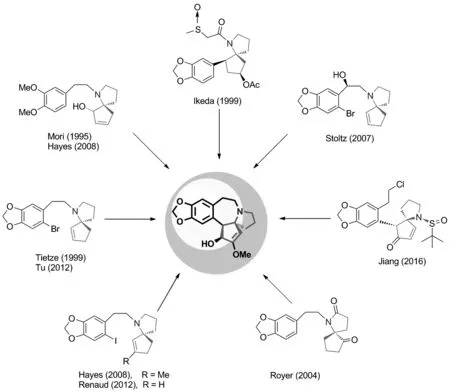
三尖杉碱分子的结构中含有一个手性1-氮杂螺[4.4]壬烷的结构单元(Scheme 1, III)。同时,1-氮杂螺[4.4]壬烷在很多的天然活性生物碱的结构中也都有存在。1972年,Weinreb小组[5]完成了三尖杉碱的首次全合成,迄今为止已有几十条合成路线被报道[6-7]。但直到1995年才有研究小组首次报道了天然三尖杉碱的不对称全合成。本论文综述了以手性1-氮杂螺[4.4]壬烷骨架为中间体,合成天然三尖杉碱的研究进展。
Scheme 2

Scheme 3
纵观各个小组的研究工作,采取的合成策略各有特色。许多研究小组的不对称合成工作,是先构建CD环系也就是手性氮杂螺[4.4]壬烷结构,再构建B环,进而完成三尖杉碱的不对称合成(Scheme 1)。
1.1 Mori小组的合成策略
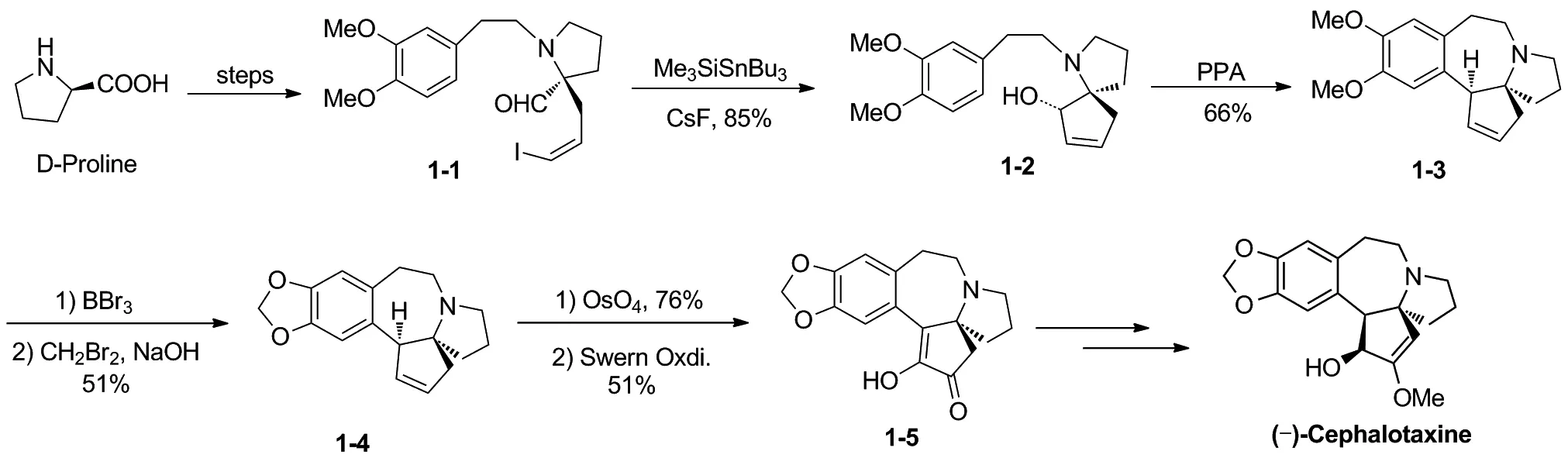
1995年,Mori等[8]首次报道了三尖杉碱的不对称全合成(Scheme 2)。他们以D-(+)-脯氨酸为手性起始原料,经多步转化得到手性醛1-1。1-1在Me3SiSnBu3条件下环化,得到手性螺环化合物1-2。1-2在多聚磷酸作用下, 发生分子内傅-克烷基化反应, 构建B环,得到1-3。化合物1-3在BBr3/CH2Br2条件下,将二甲氧基转化为亚甲二氧基得到化合物1-4。1-4经双羟化、Swern氧化得到1-5,1-5经若干步转化得到(-)-Cephalotaxine,合成路线共19步,总收率1.8%。
1.2 Ikeda小组的合成策略
1999年,Ikeda等[9]以光学纯的D-(+)-Proline为起始原料,经多步合成得到手性化合物1-6。1-6在NaH的作用下发生Aldol缩合,合成到手性螺环化合物1-7,1-7再经多步转化,得到1-8。1-8在TFAA存在下发生Pummerer环化,然后经Raney-Ni脱硫,构建B环,得到化合物1-9。化合物1-9再经多步转化合成(-)-Cephalotaxine,合成路线共19步,总收率约7%(Scheme 3)。
1.3 Tietze小组的合成策略
1999年, Tietze小组[10]采用两个钯催化反应为关键反应,高效完成了三尖杉碱的不对称合成(Scheme 4)。他们以1, 3-环戊二酮为起始原料,经多步转化合成1-10,1-10经不对称还原得到光学纯环戊醇衍生物1-11,后经多步反应合成得到1-12。1-12与2-溴代胡椒基乙胺反应得到化合物1-13。1-13在催化剂Pd(PPh3)4作用下,发生Tsuji-Trost反应得到手性氮杂螺环化合物1-14,1-14在Herrmann’s催化剂作用下发生分子内Heck环化反应构建B环,得到手性化合物1-4(Mori路线的关键中间体),最终完成了天然三尖杉碱的形式合成,合成路线共13步,总收率约5%。

Scheme 4
Scheme 5
1.4 Royer小组的合成策略
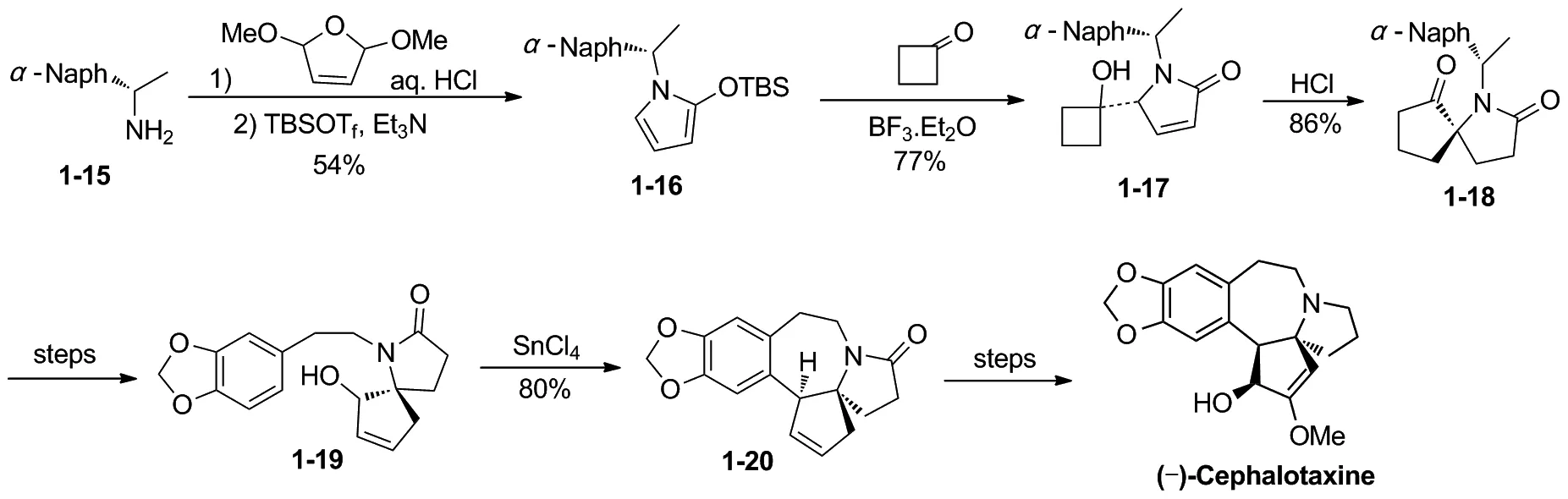
2004年,Royer小组[11]采用立体选择性的semi-pinacol重排反应,合成了手性螺环化合物,最终合成了天然三尖杉碱(Scheme 5)。他们以手性胺1-15为起始原料,经多步转化得到semi-pinacol重排前体化合物1-17。1-17在HCl条件下,发生semi-pinacol重排,得到手性螺环化合物1-18,1-18经几步反应合成得到1-19。1-19在四氯化锡条件下发生傅克烷基化构建B环,得到化合物1-20。1-20经步官能团转换完成了天然三尖杉碱的合成,合成路线共16步,总产率约9%。
1.5 Stoltz小组的合成策略
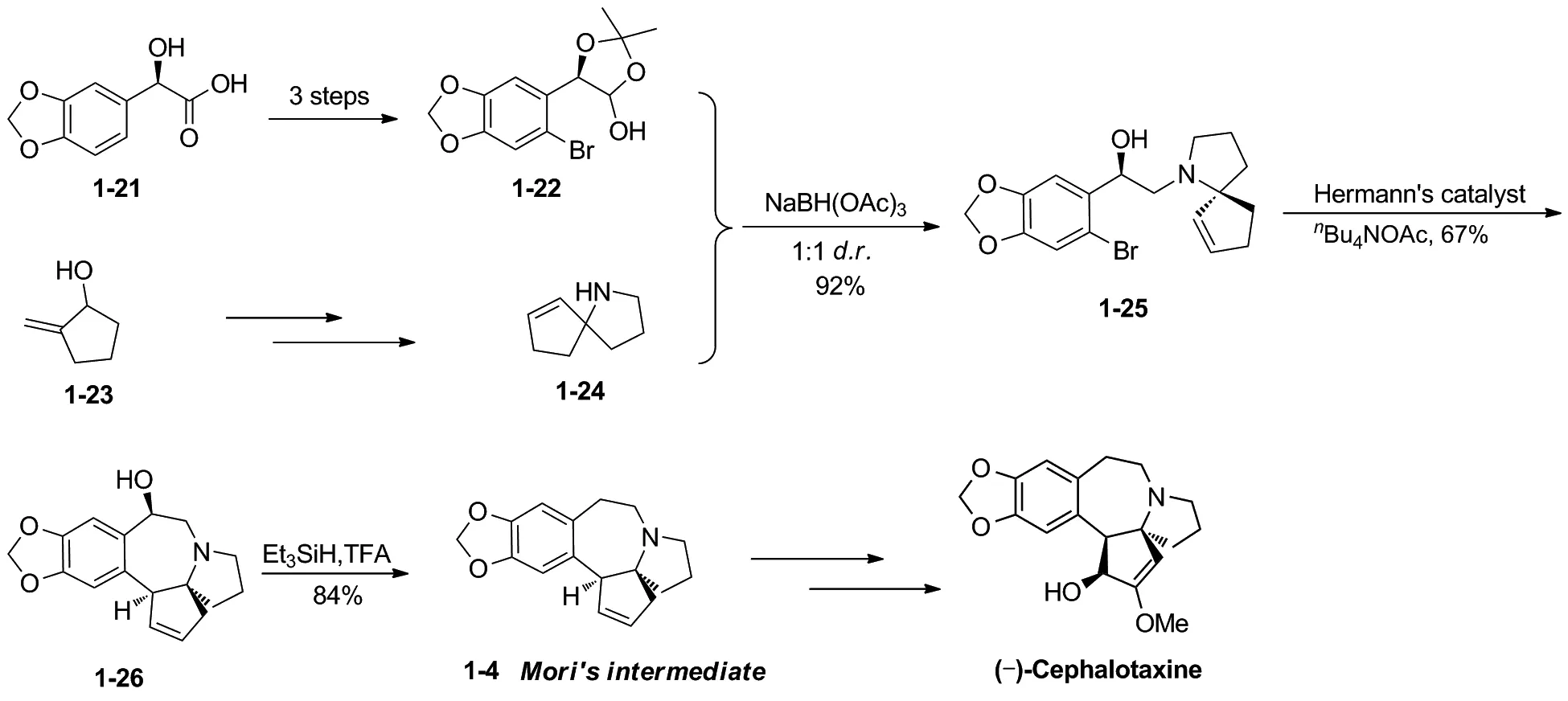
2007年,Stoltz小组[12]分别合成手性卤代芳环化合物和消旋的氮杂螺环化合物,利用二者发生还原胺化得到的手性取代氮杂螺环为关键中间体,完成了三尖杉碱的不对称合成 (Scheme 6)。以化合物1-21作为手性起始原料,经三步转化得到手性缩酮1-22,在NaBH(OAc)3作用下,与非光学活性的氮杂螺环1-24经还原胺化得到偶联化合物1-25。1-25在Herrmann’s催化剂作用下经过分子内Heck环化反应,构建B环得到三尖杉碱骨架化合物1-26。然后在三乙基硅烷与三氟醋酸作用下脱除羟基得到Mori路线中间体1-4,经11步反应,完成了天然三尖杉碱的形式合成,总收率约6%。
Scheme 6

Scheme 7
1.6 Hayes小组的合成策略
2008年,Hayes小组[13-14]报道了两条天然三尖杉碱的形式全合成路线。
第一条合成路线:以Boc保护的D-(+)-脯氨酸甲酯作为手性源,经多步转化得到化合物1-27。1-27在KHMDS作用下,通过立体选择性的卡宾插入反应,合成得到手性氮杂螺环化合物1-28。化合物1-28再经碘代,Pd(OAc)2催化的Heck偶联反应,构建B环,得到化合物1-30。1-30再经多步反应转化得到1-4,最终完成了天然三尖杉碱的合成,共16步反应,总收率约为1.3%(Scheme 7)。
第二条合成路线:以手性醛为原料, 经多步转化得到化合物1-31。再利用立体选择性的卡宾插入反应,合成得到手性氮杂螺环化合物1-32,然后经几步转化得到1-33。1-33在DIPEA作用下, 与对硝基苯磺酸3,4-亚甲二氧基苯乙酯反应,得到1-34。1-34在四氯化锡条件下发生傅-克烷基化,构建B环得到1-4,然后经文献转化得到天然三尖杉碱,共13步反应,总收率约为5%。值得一提的是, Mori小组也曾得到化合物1-34,但他们尝试了PPA条件下的傅-克烷基化反应,未能成功构建B环。Hayes小组尝试使用四氯化锡条件,成功通过傅-克烷基化反应构建了B环。这是Mori小组研究工作基础上的突破(Scheme 8)。
1.7 Renaud小组的合成策略
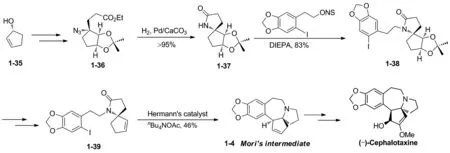
2012年,Renaud小组[15]以(S)-2-羟基环戊烯1-35作为起始原料,经过几步转化得到手性叠氮化合物1-36。1-36加氢还原氨化,得到手性氮杂螺环化合物1-37。1-37再与碘代胡椒乙醇磺酸酯经N-烷基化反应得到1-38。然后通过几步反应转化得到1-39。1-39通过分子内Heck偶联,构建B环,得到了Mori路线的中间体1-4,再通过文献转化得到天然三尖杉碱,共18步反应,总收率约为2%(Scheme 9)。

Scheme 8
Scheme 9
Scheme 10
1.8 涂永强小组的合成策略
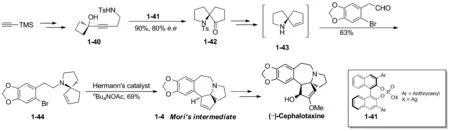
2012年, 涂永强小组[16]以串联的分子内氢胺化以及半pinacol重排,构建手性氮杂螺环作为关键反应,实现了天然三尖杉碱不对称形式全合成。 以TMS乙炔作为起始原料, 经两步转化得到炔化合物1-40。1-40在手性磷酸盐催化剂1-41的催化作用下,发生串联的分子内氢胺化/semi-pinacol重排反应,合成得到手性氮杂五元螺环化合物1-42。1-42经几步转化得到1-44。1-44在Herrmann’s催化剂作用下经过分子内Heck环化反应,构建B环,得到了Mori路线的中间体1-4,1-4再经Mori小组的路线得到天然三尖杉碱,合成路线共12步,总收率约5%(Scheme 10)。
Scheme 11
1.9 姜标小组的合成策略
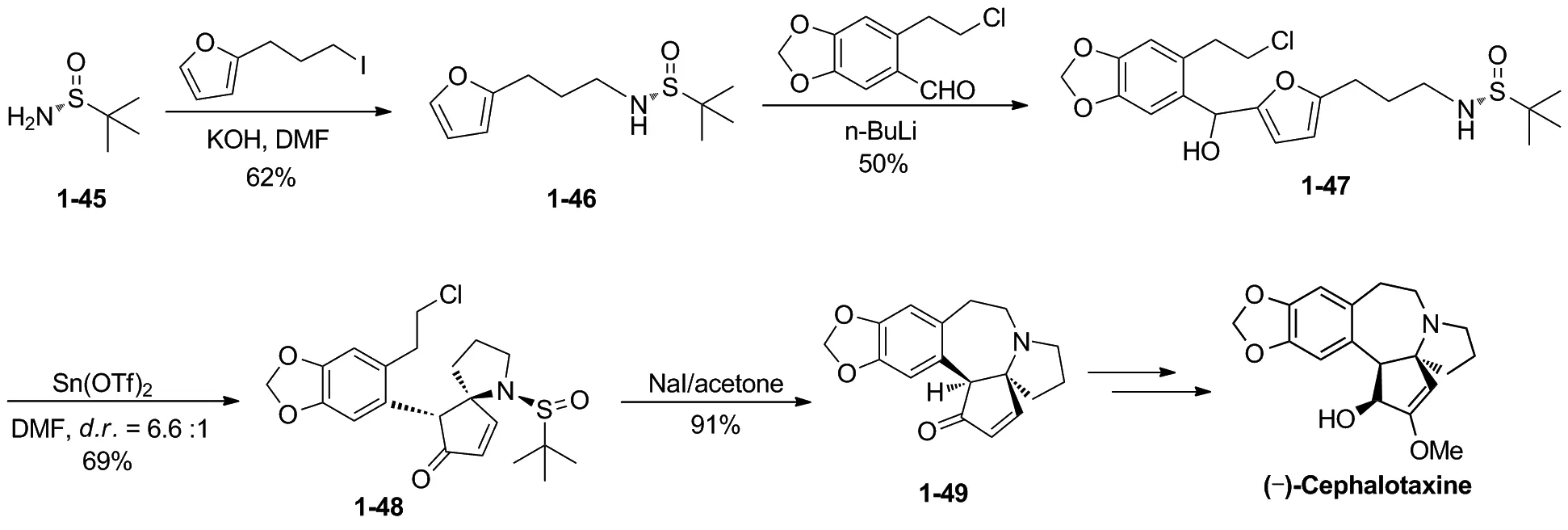
2016年, 姜标小组[17]以光学活性的亚磺酰胺1-45为起始原料,与2-(3-碘代丙基)呋喃发生氮烷基化反应,得到手性化合物1-46。1-46在丁基锂作用下,与2-(2-氯乙基)胡椒醛发生亲核加成反应得到化合物1-47。1-47再在三氟甲磺酸亚锡作用下发生氮杂Piancatellic 重排反应,得到关键的光学活性的氮杂螺环化合物1-48,1-48在碘化钠作用下构建B环, 得到三尖杉碱骨架化合物1-49。6步反应,总收率为11.7%(Scheme 11)。
对以手性1-氮杂螺[4.4]壬烷骨架为中间体,合成(-)-Cephalotaxine的不对称合成路线做了系统的综述。不难看出,Mori教授的工作对于后面的合成路线起到了重要的启示作用。许多研究小组都是通过合成Mori中间体,最终完成了三尖杉碱的手性合成。目前一些研究小组报道的合成高三尖杉酯碱的方法,多为从天然三尖杉碱出发,对手性羟基进行酯化[18-19]。因此,系统的研究和总结手性1-氮杂螺[4.4]壬烷骨架的构建和三尖杉碱的不对称合成方法,对含有此类氮杂螺环结构的生物碱以及三尖杉碱的不对称合成工作均具有很好的参考和指导意义。
