镁修饰多壁碳纳米管吸附回收污水中磷酸盐
2022-03-25江守沛,乔森,周集体
江 守 沛, 乔 森, 周 集 体
(大连理工大学 环境学院 工业生态与环境工程教育部重点实验室,辽宁 大连 116024 )
0 引 言
磷是构成生物体不可或缺的重要元素,限制着生态系统最基础的生产活动[1].然而磷元素在自然界中的流动是线性的,进入自然界的磷会通过地表径流等途径最终进入海洋形成沉积物,很难重新进入物质循环过程中,这使得地球上储量本来就不算丰富的可用磷资源更加捉襟见肘.据美国地质调查局的调查结果,地球上已探明的磷储量还能够维持人类消耗90 a[2].一方面是磷资源将面临短缺的困境,另一方面却是大量的磷随废水被排入环境中,导致了水体富营养化问题.如果将污水中的磷回收利用,不仅可以缓解磷资源短缺问题,也可以避免因为磷过量排放而引发的环境污染.
吸附法回收磷具有耗能少、污染小、作用快、可循环等优点,在磷回收方面受到了极大的关注.研究表明,二价和三价金属离子如Mg2+、Al3+、Fe3+等对磷酸盐有很强的亲和力,能够与磷酸盐发生配位交换作用形成内球型络合物,实现对磷酸盐的吸附[3].镁的来源十分广泛,是生物必需的微量元素,同时对磷酸盐有很高的吸附容量,因此在磷酸盐吸附回收中有着很大的应用潜力.Zhang等利用镁修饰的生物炭吸附污水中的磷酸盐,吸附量(均以P为基准计)为272 mg/g[4];Xie等用氯化镁和硅藻土一起混合煅烧制得的镁修饰硅藻土来吸附富营养化水体中的磷酸盐,磷酸盐去除率在90%以上,吸附量为14.50~16.99 mg/g[5].研究表明,吸附剂中镁含量显著影响着磷酸盐的吸附量[6],因此寻找一种能够负载更多镁的吸附剂基体对于制备一种高磷酸盐吸附量的吸附剂十分关键.
多壁碳纳米管(MWCNTs)有着极大的比表面积、优良的导电性和稳定性等特性,是一种优良的吸附剂基体[7].MWCNTs的高比表面积可以为镁提供更多的附着位点,提高镁在吸附剂中的含量,同时MWCNTs稳定的结构使得其制备的吸附剂能够适应较差的吸附环境.然而针对MWCNTs与Mg结合制备吸附剂用于吸附磷酸盐的研究还很少,因此本文利用镁对MWCNTs修饰制备吸附剂并对吸附剂做表征,研究制备的吸附剂在磷酸盐吸附过程中的等温线、动力学和机理,在实验室条件下考察制得的吸附剂对磷酸盐的吸附回收性能.
1 实验材料与方法
1.1 实验材料
MWCNTs购自深圳纳米港有限公司,纯度大于97%.MWCNTs的直径为60~100 nm,比表面积为40~70 m2/g.将磷酸二氢钾(KH2PO4,天津大茂化学试剂有限公司)溶解到去离子水(DI,18.1 MΩ·cm)中模拟污水中的磷酸盐.本文使用的磷酸二氢钾、六水氯化镁(MgCl2·6H2O)等试剂均为分析纯,所有溶液均用去离子水配制.溶液中的磷酸盐浓度通过钼锑抗分光光度法测定[8].
1.2 吸附剂的制备与表征
将1 g MWCNTs加入到100 mL MgCl2·6H2O溶液(20 mmol/L)中,经过12 h的磁力搅拌(120 r/min,298.15 K)后,放置于348.15 K的水浴锅中.在不断搅拌下缓慢加入6 mL的NaOH(1 mol/L),继续搅拌至混合物凝固后转移至冷冻干燥机中干燥12 h.干燥之后的混合物在高温管式炉于873.15 K下以N2作为保护气煅烧2 h.煅烧后的吸附剂用去离子水洗涤3次后放置于空气干燥箱(338.15 K)中干燥24 h除去水分,用研钵充分研磨后用聚乙烯管密封保存.此用镁修饰MWCNTs制备的吸附剂命名为Mg-CNT.
采用场发射扫描电子显微镜配备X射线能谱(FESEM-EDS)、X射线衍射(XRD)、X射线光电子能谱(XPS)对Mg-CNT吸附磷酸盐前后的形貌和组成元素变化进行探究,同时采用傅里叶红外光谱(FT-IR)对Mg-CNT吸附磷酸盐前后表面官能团进行表征.
1.3 等温吸附和吸附动力学实验
在等温吸附实验中,0.2 g Mg-CNT与500 mL不同浓度的磷酸盐溶液(25~150 mg/L)充分混合后在恒定的温度下磁力搅拌(120 r/min,298.15 K)24 h后测定溶液中剩余磷酸盐的浓度,根据下式计算Mg-CNT对磷酸盐的平衡吸附量:
(1)
式中:C0和Ce分别是磷酸盐的初始和平衡浓度,mg/L;V为溶液的总体积,L;m为吸附剂用量,g.
采用Langmuir和Freundlich等温吸附模型拟合Mg-CNT吸附磷酸盐过程.这两种等温吸附模型可以表明磷酸盐的吸附类型[9].
Langmuir等温吸附模型:
(2)
Freundlich等温吸附模型:
(3)
式中:qL,m为Langmuir等温吸附模型计算的理论最大吸附量,mg/g;KL和KF分别是Langmuir和Freundlich等温吸附模型的常数;n是Freundlich等温吸附模型吸附常数.
此外通过拟合准一级和准二级动力学模型可以进一步反映Mg-CNT吸附磷酸盐的吸附类型[10].
准一级动力学模型:
ln(qe-qt)=lnqe-k1t
(4)
准二级动力学模型:
(5)
式中:k1和k2分别为准一级动力学模型和准二级动力学模型的吸附速率常数;qt是溶液中的磷酸盐在时间为t时的浓度,mg/g.
1.4 pH影响实验
溶液的pH对磷酸盐的存在形式和吸附剂表面所携带的电荷性质有显著影响[11].在pH影响吸附实验中,配制了浓度为5 mol/L的NaOH与1 mol/L的HCl溶液来调节磷酸盐溶液的初始pH.0.2 g Mg-CNT分别与初始pH为5~10的KH2PO4溶液(100 mg/L,500 mL)充分混合后以恒定的温度磁力搅拌(120 r/min,298.15 K)48 h,定时测定溶液中的磷酸盐浓度.
1.5 竞争离子影响实验
将0.2 g Mg-CNT加入到500 mL含有不同竞争离子(10 mmol/L NaNO3、NaCl、Na2SO4)的KH2PO4溶液(100 mg/L)中,来模拟实际废水中共存离子对磷酸盐吸附的影响,并将单一的磷酸盐溶液设为空白对照组.在恒定室温(298.15 K)和120 r/min转速的磁力搅拌下,吸附24 h后测定溶液中的磷酸盐浓度.
1.6 脱附实验
吸附剂吸附的磷酸盐的可脱附性与吸附剂的再生性能是评价吸附剂经济性的重要指标.将 0.4 g Mg-CNT加入到KH2PO4溶液(100 mg/L,1 L)中恒温搅拌24 h(298.15 K,120 r/min)后过滤,然后将吸附剂转移至NaOH溶液(0.25 mol/L,2 L)中脱附12 h.过滤后的吸附剂用去离子水洗涤4次.最后,将再生的Mg-CNT吸附剂在338.15 K的空气干燥箱中干燥24 h后进行下一次吸附实验.吸附-脱附循环进行3次.
2 结果与讨论
2.1 Mg-CNT的XRD与FT-IR表征
图1(a)为Mg-CNT的XRD图.根据XRD的衍射峰分布,位于37.0°、43.0°、62.3°、74.6°、78.5°的衍射峰属于MgO的晶格面[12],表明修饰后镁在吸附剂上以MgO的形式存在.而在26.1°处的衍射峰属于MWCNTs.吸附剂表面的官能团如羟基、羧基等能够影响吸附剂表面携带的电荷性质进而影响磷酸盐的吸附[13],因此研究吸附剂表面的官能团对探究磷酸盐吸附机理十分有必要.图1(b)为Mg-CNT吸附磷酸盐前后的FT-IR谱.
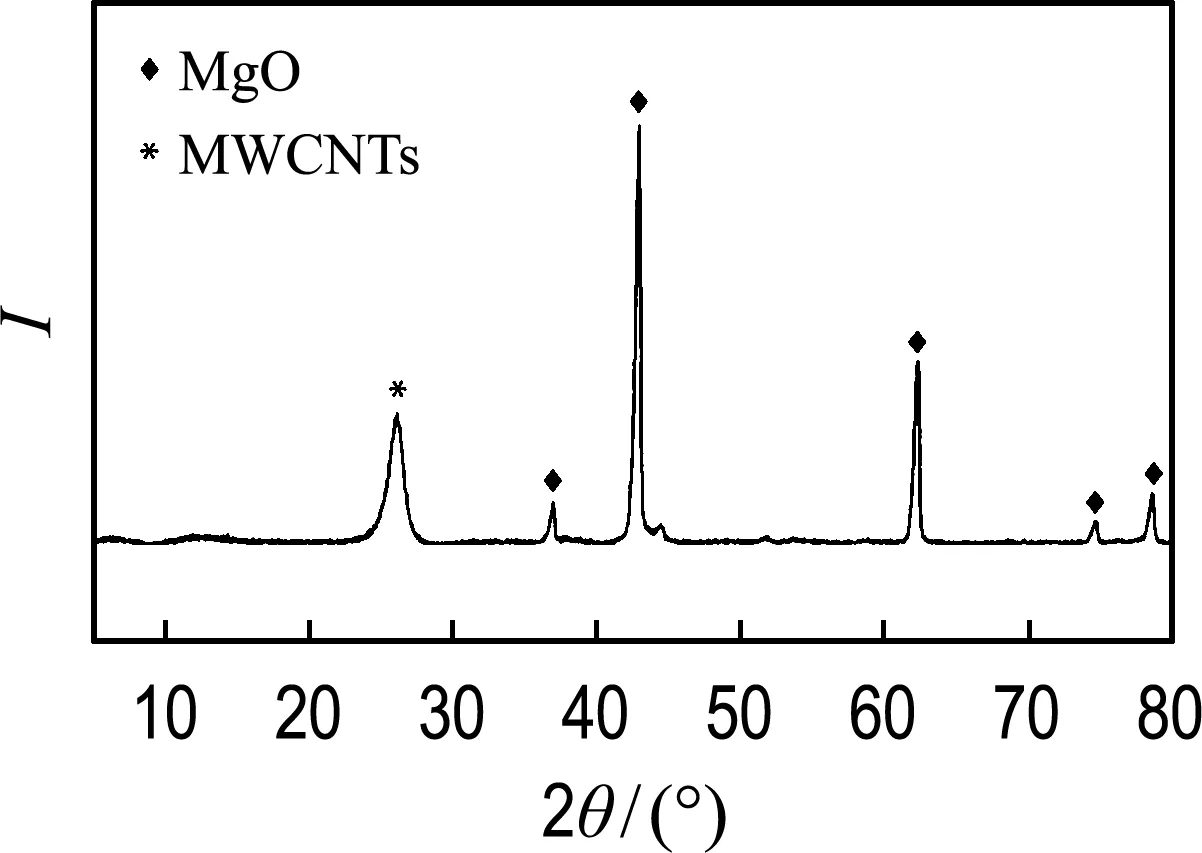
(a)XRD表征
从图中可以看出,Mg-CNT未吸附磷酸盐前表面的官能团种类较为单一,在453 cm-1与 3 698 cm-1处的吸收峰分别为Mg—O键与Mg—OH键的伸缩振动[14].MgO出现是因为MgCl2在高温下发生了分解反应[15]:
MgCl2·H2O→HCl+MgOHCl
(6)
MgOHCl→HCl+MgO
(7)
而Mg(OH)2的出现是由于在吸附剂清洗的过程中MgO与水发生了反应:
MgO+H2O→Mg(OH)2
(8)

2.2 FESEM-EDS与XPS表征
从图2(a)中可以看出,未经镁修饰的MWCNTs 为杂乱分布的修长管状结构.经镁修饰之后,可以观察到表面被一层纳米片状结构覆盖(图2(b)),MWCNTs吸附磷酸盐后,依然保持着纳米片状结构(图2(c)),表明Mg-CNT吸附磷酸盐是原位反应[14].表1为Mg-CNT吸附磷酸盐前后的元素组成.从表中可以看出,Mg-CNT表面碳纳米片的组成元素主要为Mg与O,与MgO的组成元素一致.吸附磷酸盐后,Mg元素所占质量比下降,P元素所占质量比上升,表明磷酸盐被Mg-CNT吸附.

表1 Mg-CNT吸附磷酸盐前后元素组成Tab.1 Elemental composition of Mg-CNT before and after adsorption of phosphate
图3为Mg-CNT与在相同条件下制备的MgO对磷酸盐吸附速率的对比.从图中可以看到,相同条件下制备的MgO与磷酸盐反应缓慢,直到与磷酸盐接触24 h后才表现出对磷酸盐的吸附.当MWCNTs作为吸附剂的基体后,Mg-CNT 对磷酸盐表现出了更高的吸附速率.这是因为单一的MgO在水中容易产生集聚作用,阻碍了MgO与磷酸盐充分接触,导致对磷酸盐吸附的速率下降.当MgO分散在基体上时,可以克服这种集聚作用[17].吸附剂基体可以为MgO提供附着位点,并且限制MgO的粒径上限.同时MWCNTs使得MgO形成多层纳米片结构(图2(b)),使得MgO有着更高的有效比表面积,促进了磷酸盐的吸附[18].这一结论可以从Zhang等和Zhou等的实验结果对比中得到验证.Zhang等[4]制备的纳米片状MgO修饰生物炭比表面积为70.0 m2/g,而Zhou等[10]制备的MgO微球比表面积为72.1 m2/g.尽管比表面积较小,但MgO纳米片修饰的生物炭对磷酸盐的吸附性能显著高于单一的MgO微球(272.5 mg/g对24.5 mg/g).这表明纳米片状结构提高了MgO的有效表面积,使得吸附剂对磷酸盐的吸附量更高.

(a)MWCNTs

图3 Mg-CNT与MgO吸附磷酸盐速率对比Fig.3 The contrast of phosphate adsorption rate between Mg-CNT and MgO
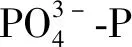

(a)Mg1s
2.3 吸附动力学与等温吸附实验
动力学模型的拟合结果如图5(a)、(b)所示.根据拟合参数(表2),准二级动力学模型拟合的相关系数R2=0.988 1,大于准一级动力学模型的R2=0.955 8.因此Mg-CNT对磷酸盐的吸附行为更加符合准二级动力学模型,证明Mg-CNT吸附磷酸盐是化学吸附过程.这一结果与Mg修饰生物炭与硅藻土制备的吸附剂吸附磷酸盐研究得出的结论一致[20,12].

(a)准一级动力学模型
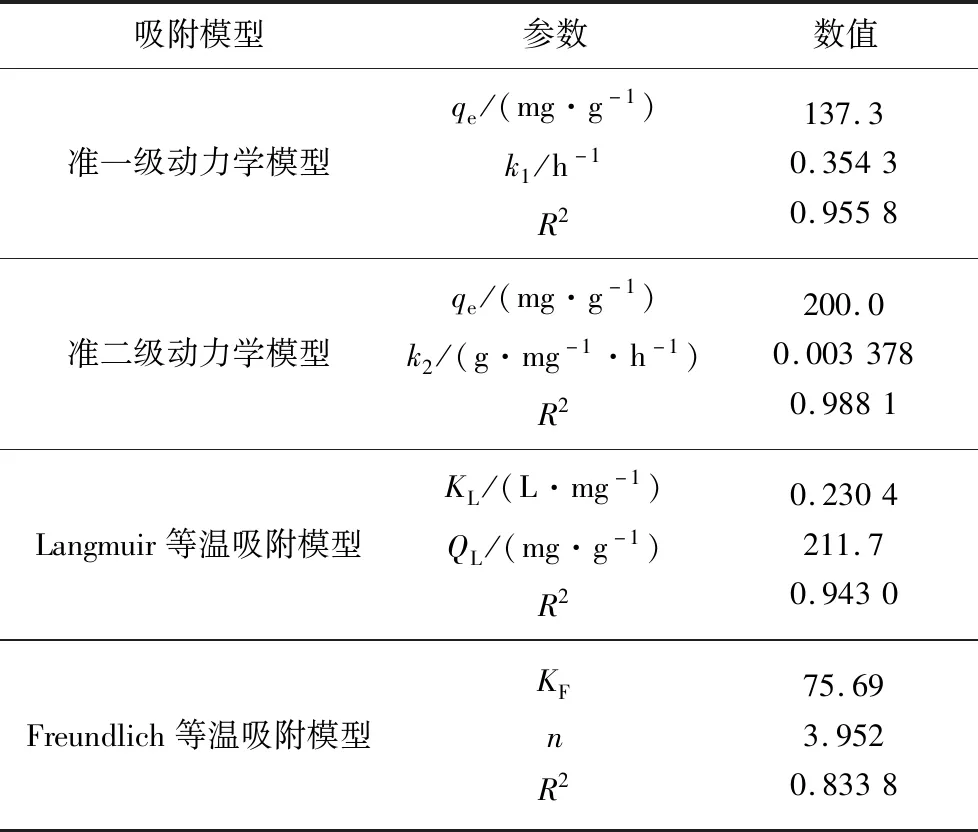
表2 吸附动力学与等温吸附模型拟合参数Tab.2 Adsorption kinetics and isotherm adsorption model fitted parameters
Langmuir等温吸附模型与Freundlich等温吸附模型拟合结果如图5(c)所示.根据等温吸附模型的拟合参数(表2),Langmuir等温吸附模型拟合的相关系数R2=0.943 0,大于Freundlich等温吸附模型的R2=0.833 8,这表明Mg-CNT吸附磷酸盐是单分子层吸附.根据Langmuir等温吸附模型的拟合结果,Mg-CNT对磷酸盐的最大理论吸附量达到了211.7 mg/g.
2.4 pH对磷酸盐吸附影响实验
溶液的pH影响吸附剂表面携带的电荷性质及磷酸盐在溶液中的存在形态.从图6中可以看出,随着溶液初始pH升高,Mg-CNT对磷酸盐的吸附受到越来越严重的抑制.当溶液的初始pH从5升高到7时,由OH-浓度升高对Mg-CNT吸附磷酸盐产生的抑制作用不明显,吸附进行到4 h时对磷酸盐的平均吸附速率分别为40.9、37.1 mg·g-1·h-1.然而当磷酸盐溶液的初始pH升高到10时,在4 h的吸附时间内Mg-CNT对磷酸盐的吸附速率为21.9 mg·g-1·h-1,吸附速率仅为pH=5实验组的53.5%.
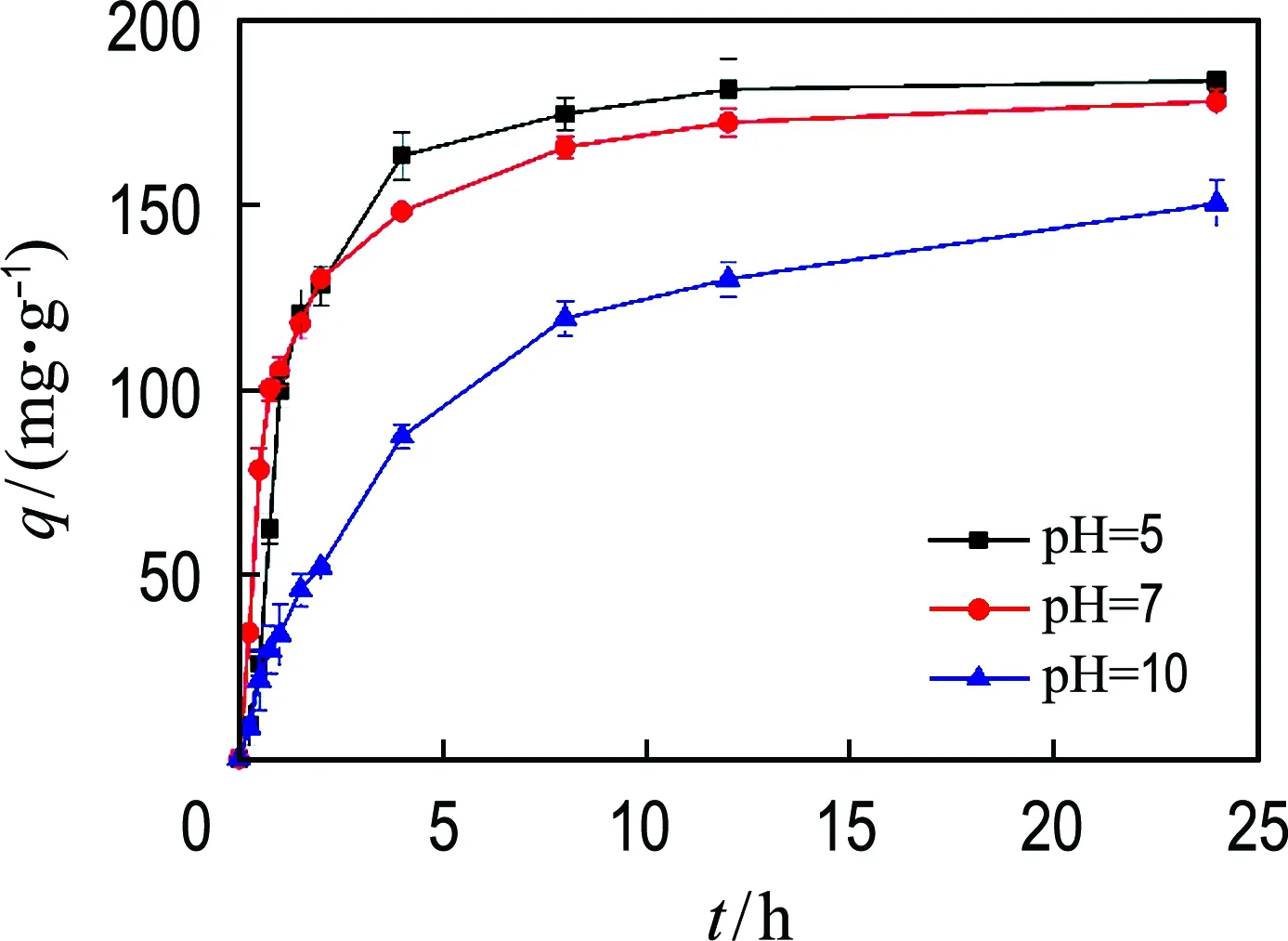
图6 pH对磷酸盐吸附的影响Fig.6 pH influence on adsorption of phosphate
这是因为负载到Mg-CNT表面的MgO的零电荷点pH为12,当pH低于12时,MgO在水中发生了质子化[21]:
MgO+H2O→MgOH++OH-
(9)
因为MgO的质子化,Mg-CNT表面携带正电荷,溶液中的磷酸盐通过静电作用被吸引到吸附剂表面,与质子化后的MgOH+发生配位交换生成Mg3(PO4)2[20]:
(10)
(11)
当溶液pH升高时,浓度升高的OH-抑制了MgO的质子化反应.另一方面浓度升高的OH-与溶液中的磷酸盐竞争Mg-CNT表面的吸附位点,也导致Mg-CNT对磷酸盐的吸附效率下降.
2.5 竞争离子对吸附影响实验


图7 竞争离子对磷酸盐吸附影响Fig.7 Influence of competing ions on adsorption of phosphate
2.6 吸附-脱附实验
Mg-CNT的再生实验如图8所示.如前所述,磷酸盐与质子化的MgOH+发生配体交换被吸附到吸附剂表面,因此高浓度的OH-在溶液中可以将Mg3(PO4)2中的磷酸盐释放出来[3].经过3次吸附-脱附循环后,Mg-CNT仍保持了初始时73%的磷酸盐吸附量(图8).损失的吸附量可能是由于磷酸盐与Mg结合紧密导致难以脱附所致[24].同时负载到Mg-CNT表面的Mg在解吸时损失也会导致吸附量降低[25].3次吸附-脱附循环平均每次磷酸盐脱附率为94%,表明Mg-CNT吸附剂能有效回收磷酸盐.经过3次循环,Mg-CNT仍然保持了较高的磷吸附量与能力,说明Mg-CNT是一种可多次利用的磷回收吸附剂.
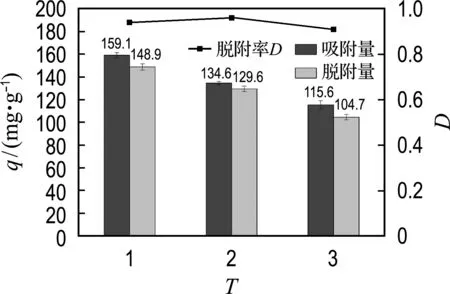
图8 Mg-CNT再生及磷酸盐脱附率Fig.8 Regeneration of Mg-CNT and phosphate desorbability
3 结 语
镁修饰MWCNTs制备的Mg-CNT对磷酸盐的最大吸附能力为211.7 mg/g,沉积在Mg-CNT表面的MgO纳米片对磷酸盐的吸附起主要作用.Mg-CNT对磷酸盐的吸附类型为单分子层化学吸附,吸附量随初始pH在5~10内增加而减小.溶液中的竞争离子对磷酸盐吸附量影响较小.经过3次吸附和脱附循环后,Mg-CNT仍保持了初始吸附量73%的吸附量和较高的磷酸盐脱附能力,表明Mg-CNT能够有效吸附回收污水中的磷,具有很大的磷回收潜力.
