一种检测中药成分毒性的心脏芯片构建
2022-03-25王帅,高志刚,李晓瑞,曲玥阳,丛烨,张索楠,罗勇
王 帅, 高 志 刚, 李 晓 瑞, 曲 玥 阳, 丛 烨, 张 索 楠, 罗 勇
(大连理工大学 化工学院,辽宁 大连 116024 )
0 引 言
心脏毒性是指药物经过血液循环进入心脏后,作用于心脏各种细胞导致细胞发生损伤乃至死亡的生物过程,而心肌细胞的受损是诸多心脏疾病例如心律失常、心力衰竭的重要原因[1].人体内心肌细胞、骨骼肌细胞和神经细胞是没有再生能力的,所以心脏一旦出现疾病,即便痊愈后心脏功能也无法恢复到之前的水平,从这个角度来看,对于新药可能存在的心脏毒性,必须慎重筛查[2].研究药物的方法有动物实验和体外实验.动物实验有实验周期过长、耗资巨大、存在着伦理争议等问题;而体外实验中传统的孔板细胞模型囿于其空间结构,难以模拟出体内器官组织的微环境,同时很难探究多种细胞之间的相互作用.微流控器官芯片可以继承孔板的已有优点,同时规避上述缺点.微流控是在微米尺度上精确控制流体的技术,对流体的精准操控可以将传统的生化实验进一步小型化、空间立体化[3].器官芯片是微流控在生物领域的具体应用,芯片通过外接泵阀实现内部通道的流体流动,及芯片内多种细胞的液体环境连接,从而构建出可以模拟体液流动、多种细胞相互作用的体外模型[4].
传统中医药是宝贵的历史财富,如何从古籍中提取出符合现代医学标准的内容是中药现代化的重要工作.尽管拥有长久的中药用药经验,对于各种药材的毒性有了定性的认识,但因为缺少现代药理学的量效毒关系,近年来在中药使用中也发现了一些不良反应.传统古籍上对于中药毒性的大毒、有毒、小毒等定性表述显然无法满足中药研究现代化的要求,中药材中各种天然药物成分对于各种靶器官的定量毒性评价显然是民族医药实现健康发展的重要一步[5].
本实验拟构建一款模拟心脏心肌搏动和毛细血管屏障功能的心脏芯片.在药物毒性评价方面,本芯片通过观察加药前后心肌细胞搏动活力的变化,结合培养液中的损伤标志物肌钙蛋白(cTnI)和乳酸脱氢酶(LDH)的表达水平检测,定量检测3种中药化学成分心脏毒性,为中药临床前毒性评价提供相关数据.
1 实验部分
1.1 原代心肌细胞的提取与培养
将出生24 h以内的SD幼鼠心脏浸泡在预冷的D-Hank′s溶液中,将心室组织剪碎成1 mm3小块,加入8 mL 的0.06%胰酶于离心管中,4 ℃消化12 h.加等体积α-MEM培养液(含10%FBS和1%青霉素链霉素双抗)终止胰酶消化,加入0.1%(m/V)的Ⅱ型胶原酶5 mL,密封好离心管,37 ℃水浴3 min,可以观察到离心管内胶原酶溶液浑浊.加等体积培养液终止消化,使用100 μm细胞过滤筛过滤细胞悬液,1 000 r/min离心5 min 去除胶原酶,加入5 mL的α-MEM培养液重悬细胞.细胞悬液接种到60 mm培养皿中,细胞培养箱静置90 min,通过差速贴壁法去除培养皿内的成纤维细胞,将培养皿中的心肌细胞悬液细胞计数,以5×105mL-1的密度接种到24孔板和多孔膜上培养[6].为了方便与孔板对照,将多孔膜面积设定为24孔板中1个孔的面积.
1.2 原代血管内皮细胞的提取与培养
将100 g的SD大鼠腹腔注射20%乌拉坦麻醉(1 mL/100 g),提取胸腔内心脏放入预冷的D-Hank′s 溶液中,保留心室部分,小心去除心内膜和心外膜,将心室组织剪碎成1 mm3的小块,吸去培养皿中液体后加入1.5 mL FBS,将组织块均匀接种在60 mm培养皿内,组织块间距控制在3 mm之内,置于37 ℃、5% CO2的培养箱内5 h使其贴壁,补加含20%FBS的α-MEM培养液,继续培养72 h后去除组织块,培养皿内贴壁细胞即为原代血管内皮细胞.用0.125%的胰酶消化重悬后,以1×105mL-1的密度将血管内皮细胞接种到24孔板和多孔膜上,接种血管内皮细胞使用的多孔膜与接种心肌细胞的多孔膜为同一尺寸.
1.3 芯片的设计与制造
微流控芯片的制造过程可以概括为掩膜打印、模板光刻、聚二甲基硅氧烷(polydimethyl-siloxane,PDMS)浇筑、芯片组装4个步骤,其中掩膜使用Adobe Illustrator CS6软件绘制,如图1所示,委托打印社打印.

图1 芯片掩膜设计图Fig.1 Design diagram of chip mask
将硅片放置匀胶机于1 000 r/min旋转1 min,边旋转边滴加3 mL光刻胶,得到100 μm厚的光刻胶涂层,将硅片置于90 ℃热板静置3 h后放入光刻机内,盖上掩膜进行光固化,使用乳酸乙酯洗脱未固化的光刻胶,就得到了芯片内单层结构的模板.将适量的PDMS缓慢倒入模板上,真空箱内静置30 min去除内部气泡,放入干燥箱内80 ℃加热1 h 固化,小心剥离PDMS,对芯片通道部分和培养腔室部分进行打孔,得到了芯片的单层结构[7].在等离子体清洗仪内进行芯片夹层封接,芯片PDMS部分组装完毕后使用两块PMMA 夹板将芯片压紧防止漏液.芯片的示意图如图2所示,其为上下对齐的两腔室结构.上层结构为血管屏障模块,将原代血管内皮细胞种植多孔膜A上;下层为心脏模块,将心肌细胞种植在下层腔室最上层的多孔膜B上,两层多孔膜背靠背在芯片内紧贴.

图2 芯片设计图Fig.2 Design diagram of chip
芯片结构分为两层,每层有独立的液体流动通道,可以实现每种细胞所需培养液的独立供给,原代血管内皮细胞与原代心肌细胞通过多孔膜实现物质交流,在真实心脏中心肌细胞通过遍布心脏内部的血管来进行物质代谢,心肌细胞并没有直接暴露在血液中,所以在器官芯片中于心肌细胞上层加一层血管模块从仿生性角度具有现实根据[1].
1.4 芯片的组装与运行
心肌细胞与血管内皮细胞在多孔膜上培养48 h后,将两张多孔膜背靠背装入芯片,芯片按照图2所示安装完毕,两个出液口与装有细胞培养液的5 mL注射器相连,使用注射泵实现注射器稳定向芯片内灌注培养液,芯片内液体流向如图3所示.其中,血管内皮细胞层的α-MEM培养液流速为2 μL/min;由于心肌细胞在体内不直接接触血液,心肌细胞层的α-MEM培养液流速设置为注射泵最低流速1 μL/min,用5 mL离心管收集芯片流出的培养液.

图3 芯片内液体流向Fig.3 Liquid flow direction in chip
1.5 芯片功能的表征
为了表征心肌细胞的搏动功能,使用显微镜自带软件记录了心肌细胞的搏动视频,并采用针对性的软件分析细胞的搏动状态[8],通过跟踪视频像素点的变化计算出心肌细胞搏动的速度v和频率f.
为了表征血管层的紧密连接功能,对血管内皮细胞的VE-钙黏蛋白(VE-Cadherin)和黏附分子CD146进行免疫荧光染色.VE-Cadherin是细胞间黏连蛋白,在控制血管的通透性方面有至关重要的作用[9].CD146是一种血管内皮细胞特异性表达的黏附因子,最早是一种用于诊断黑色素瘤的生物标志物[10],但随着研究的深入,CD146被发现参与到机体的各种正常生理活动中,最新的研究还表明CD146不仅有激发血管内皮细胞功能的作用,还可以充当内皮细胞与机体内邻近其他细胞之间的信使,促进血管内皮细胞发育,从而使得血管成熟[11].
1.6 天然药物化学成分的心脏毒性检测
本实验共检测雷公藤甲素、氯化两面针碱、莨菪碱3种药物化学成分的心脏毒性,以阿霉素作为阳性对照,根据已有文献设置药物作用浓度:(1)阿霉素,1、5、10、50 μmol/L;(2)雷公藤甲素,10、50、100、200 nmol/L;(3)莨菪碱,10、50、100、200 μmol/L;(4)氯化两面针碱,5、10、15、20 μmol/L[12-15].将灌注培养液替换成含有药物的培养液,每个浓度平行组数量为3,作用24 h后收集心肌细胞层流出的培养液,使用索莱宝LDH试剂盒和Dogesce cTnI Elisa试剂盒检测细胞上清液中LDH、cTnI的表达水平.LDH是一种广泛存在于机体内各种细胞胞质内的糖酵解酶,肾脏、心脏中LDH含量最高.当细胞膜受到损伤破裂后,LDH就会释放到血液中,因此LDH是心脏疾病临床检测的一个重要指标,心肌受到损伤,病人血清中的LDH含量会显著升高[16].心肌肌钙蛋白(cTn)只存在于心肌细胞的胞浆中,是一种很重要的心肌标志物.在临床检测中,如果检测到患者血液中cTn含量有不正常升高,可以提示医生患者的心肌受到损伤[17],本实验检测的是cTn的3种亚型之一的cTnI.
为了直观表征药物对心肌细胞的损伤,本实验对芯片内的心肌细胞进行了活死染色分析.将种有心肌细胞的多孔膜从芯片中取出,于35 mm圆皿中使用凯基生物活死染料试剂盒进行细胞活死染色实验.
为了比较芯片与孔板的区别,对24孔板中的心肌细胞作用相同浓度的药物,其中每个孔加入800 μL,作用24 h后收集细胞培养上清液.为了跟芯片流出液比较,用α-MEM培养基将上清液稀释至芯片流出液相同体积,使用同样方法检测上清液中LDH和cTnI的表达水平.
使用Olympus显微镜软件记录下芯片中和孔板内加药前后心肌细胞搏动的视频,使用软件分析出心肌细胞的搏动状态.
1.7 统计学分析
所有数据均用Microsoft Excel 2016软件进行分析,组内采用单因素方差分析,组间比较采用t检验.各组数据采用x±S表示,统计学显著性差异表示为*p<0.05,**p<0.01.
2 实验结果
2.1 心肌细胞图像分析
如图4所示,心肌细胞搏动状态可以分为两方面:一方面是细胞搏动的最大速率vmax,其代表着心脏搏动一次的力度;另一方面是细胞搏动的频率,代表着心脏搏动的快慢.从这两个维度上来看,心肌细胞在芯片中都可以保证稳定的生理活动,心肌细胞的搏动状态与很多因素有关,如培养液成分、环境温度和细胞密度.通过多次实验确定在本实验环境下心肌细胞搏动的正常状态为峰值速度vmax=(60±7.56)μm/s,搏动频率f=(15±0.53)min-1.

图4 芯片内心肌细胞搏动的速率-时间图Fig.4 Velocity-time diagram of beating state of cardiomyocyte on chip
2.2 血管内皮细胞的紧密连接表征
如图5和6所示,在芯片内DAPI、VE-Cadherin 和CD146有非常旺盛的表达,这说明了在芯片内血管内皮细胞形成紧密连接,并且正处于不断发育生成血管的阶段.

(a)DAPI(b)VE-Cadherin(c)融合图图5 芯片内血管内皮细胞细胞核、VE-Cadherin免疫荧光图及融合图Fig.5 Immunofluorescence diagram of nucles,VE-Cadherin and merged of VEC on chip

(a)DAPI(b)CD146(c)融合图图6 芯片内血管内皮细胞细胞核、CD146免疫荧光图及融合图Fig.6 Immunofluorescence diagram of nucles,CD146 and merged of VEC on chip
2.3 天然药物化学成分的心脏毒性分析
药物在芯片中作用24 h心肌细胞活死情况如图7所示,可以看到随着药物浓度的升高,芯片内心肌细胞的死亡比例也随之增加.

(a)阿霉素
如图8和9所示,4种药物作用后培养液内的LDH、cTnI浓度变化都呈现出剂量依赖性.在低浓度下,芯片中的LDH、cTnI检测值均低于孔板实验,说明芯片中的心肌细胞对药物有更好的耐受性.在较高浓度下,因为血管内皮细胞大量死亡导致其屏障功能被破坏,芯片和孔板的心肌细胞受损情况更为接近.

(a)阿霉素
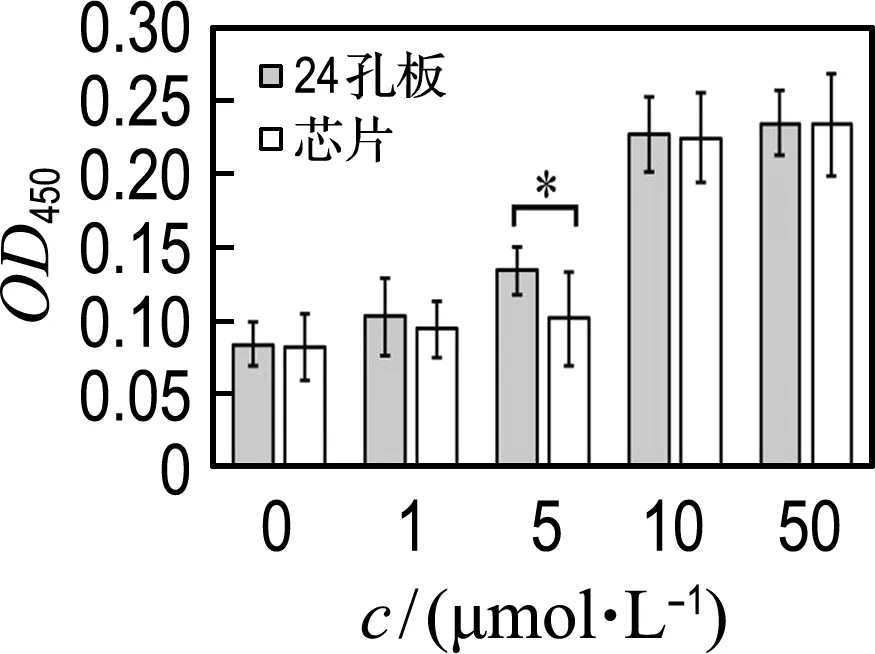
(a)阿霉素
心肌细胞搏动图像见图10和11,4种药物作用24 h后均会减弱心肌细胞搏动的活力,在芯片和孔板中,心肌搏动的峰值速率、搏动频率都出现了减弱和规律性降低的现象,在高浓度组可以观察到心肌细胞停止搏动的情况出现,并且在芯片中的细胞搏动活力要强于孔板内.

(a)阿霉素

(a)阿霉素
3 结 语
器官芯片可以视为传统孔板细胞模型的升级优化,其在细胞生长微环境以及不同细胞间相互作用体外仿真程度方面有了进一步的提升.本实验的心脏芯片模拟了心肌细胞和毛细血管之间的相互作用,与孔板模型相比,药物经过血管内皮细胞层后运输至心肌细胞这一结构可以显著提高心肌细胞药物毒性的耐受性.
在验证了芯片的仿生性优势后,对3种天然药物化学成分雷公藤甲素、氯化两面针碱、莨菪碱的芯片内实验证明了在一定浓度下,三者会对心肌细胞造成损伤.本芯片有潜力成为未来检测药物心脏毒性的体外模型.
