隔物灸调控缺氧诱导因子-1α表达抑制慢性萎缩性胃炎大鼠糖酵解的机制研究
2022-03-25李琪吴梦蝶刘世敏萧有智王文佳马喆黄艳李灵杰李璟刘慧荣
李琪 吴梦蝶 刘世敏 萧有智 王文佳 马喆 黄艳 李灵杰 李璟 刘慧荣

摘要 目的:觀察慢性萎缩性胃炎(CAG)大鼠胃黏膜组织缺氧诱导因子-1α(HIF-1α)及糖酵解关键酶表达变化,探究隔物灸对CAG的作用及可能机制。方法:将雄性Wistar大鼠随机分为正常组和造模组,自由饮用170 mg/L浓度MNNG联合法进行CAG大鼠造模。鉴定模型成功后,造模组大鼠随机分为模型组、隔药饼灸组、隔姜灸组和西药组,每组6只。隔药饼灸组、隔姜灸组均取中脘、气海穴进行隔物灸干预,西药组给予叶酸悬浊液灌胃。采用HE染色法观察胃窦组织病理学变化,实时荧光定量PCR(RT-qPCR)法检测胃黏膜组织信号转导及转录激活因子3(STAT3)、丙酮酸激酶M2(PKM2)和HIF-1α的mRNA表达水平,免疫组织化学法检测胃黏膜组织STAT3、HIF-1α蛋白表达,比色法和ELISA法测定胃黏膜组织LDH、PKM2活性。结果:与正常组比较,模型组大鼠胃黏膜组织固有腺体结构紊乱,腺体减少,出现萎缩、肠化、假幽门腺化生和(或)异型增生。模型组大鼠胃黏膜组织HIF-1α、STAT3、PKM2 mRNA表达上调(P<0.05),STAT3、HIF-1α蛋白表达增加(P<0.05),LDH、PKM2酶活性增加(P<0.05)。与模型组比较,隔药饼灸组、隔姜灸组、西药组固有腺体排列较规整,固有腺体萎缩、肠上皮化生、异型增生程度减轻;隔药饼灸和隔姜灸均能下调大鼠胃黏膜组织中HIF-1α、STAT3 mRNA与蛋白表达(P<0.05),降低LDH、PKM2酶活性(P<0.05)。结论:隔物灸中脘、气海穴可改善CAG大鼠胃窦组织形态学病变,修复胃黏膜损伤。抑制HIF-1α介导的异常糖酵解代谢水平可能是隔物灸法治疗CAG的效应机制之一。
关键词 艾灸疗法;隔药饼灸;隔姜灸;慢性萎缩性胃炎;缺氧诱导因子-1α;糖酵解
Mechanism of Indirect Moxibustion in Inhibition of Glycolysis in Rats with Chronic Atrophic Gastritis by Regulating HIF-1α Expression
LI Qi1,WU Mengdie1,LIU Shimin2,XIAO Youzhi3,WANG Wenjia1,MA Zhe2,HUANG Yan2,LI Lingjie1,2,LI Jing1,LIU Huirong1,2
(1 Yueyang Hospital of Integrated Traditional Chinese and Western Medicine,Shanghai University of Traditional Chinese Medicine,Shanghai 200437,China; 2 Shanghai Research Institute of Acupuncture and Meridian,Shanghai 200030,China; 3 Shanghai Xinqidian Rehabilitation Hospital,Shanghai 201107,China)
Abstract Objective:To observe the expression changes of HIF-1α and glycolysis enzymes in gastric mucosa of rats with chronic atrophic gastritis (CAG) and explore the mechanism of indirect moxibustion on CAG.Methods:Male Wistar rats were randomly divided into a normal group and an experimental group.The CAG model was induced in the experimental group by administration of MNNG (170 mg/L).The model rats were then randomly divided into a model group,a herb-partitioned moxibustion (HM) group,a ginger-partitioned moxibustion (GM) group,and a western medicine (WM) group,with six rats in each group.“Zhongwan” (CV 12) and “Qihai” (CV 6) were selected for indirect moxibustion in the HM group and the GM group.The folic acid suspension was administered to the rats in the WM group by gavage.The histopathological changes of gastric antrum were observed by HE staining.The mRNA expression of STAT3,PKM2 and HIF-1α in the gastric mucosa was detected by RT-qPCR,and the protein expression of STAT3 and HIF-1α was detected by immunohistochemistry.The activities of LDH and PKM2 were determined by colorimetry and ELISA.Results:Compared with the normal group,the model group showed the structural disorder of inherent glands,reduced glands,atrophy,intestinal metaplasia,pseudopyloric metaplasia,and/or dysplasia in the gastric mucosa.Furthermore,the mRNA expression of HIF-1α,STAT3,and PKM2 in the gastric mucosa was up-regulated (P<0.05),the protein expression of STAT3 and HIF-1α was elevated (P<0.05),and the enzyme activities of LDH and PKM2 were potentiated in the model group (P<0.05).Compared with the model group,the HM group,the GM group,and the WM group showed the regular arrangement of inherent glands,and relieved inherent gland atrophy,intestinal metaplasia,and dysplasia.Compared with the model group,the HM group and the GM group displayed down-regulated mRNA and protein expression levels of HIF-1α and STAT3 in the gastric mucosa (P<0.05),and weakened enzyme activities of LDH and PKM2 (P<0.05).Conclusion:Indirect moxibustion at “Zhongwan” (CV 12) and “Qihai” (CV 6) can improve the histological changes of the gastric antrum and repair gastric mucosa damage in rats with CAG,and the mechanism of indirect moxibustion in the treatment of CAG may be related to the inhibition of abnormal glycolysis mediated by HIF-1α.
Keywords Moxibustion; Herb-partitioned moxibustion; Ginger-partitioned moxibustion; Chronic atrophic gastritis; Hypoxia-inducible factor-1α; Glycolysis
中图分类号:R245.82文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.03.006
慢性萎缩性胃炎(Chronic Atrophic Gastritis,CAG)以胃胀满不适、食欲不振、恶心泛酸、呕吐、乏力、嗳气等临床表现为特征,随病情发展可影响患者心理健康并导致抑郁和焦虑。胃黏膜病理活检是CAG的主要诊断方法,镜下病理改变可见胃黏膜上皮腺体萎缩,固有腺体减少或消失,胃黏膜变薄,或伴肠上皮化生及异型增生等[1]。CAG与胃癌的发生发展密切相关,许多患者的最终结局即为胃癌,因此世界卫生组织专家于1978年将其列为胃癌的癌前疾病[2]。是故早期诊断并尽早地介入治疗以阻断CAG进一步恶化发展,对于预防胃癌发生具有重要的临床价值。
CAG的发病机制十分复杂,与炎症及相关组织异常代谢关系密切。炎症是一种保护性反应,可抵御感染或损伤,修复机体组织[3],但在某些情况下,免疫细胞无法从炎症状态转变为抗炎状态,且炎症会随时间流逝而持续存在,并转变为慢性炎症。近年来研究表明,细胞异常代谢对炎症促进或抑制状态的调控至关重要,细胞异常代谢及能量供应成为研究难点之一[4]。其中糖酵解代谢异常参与胃癌的发生与发展,无论在正常氧分压还是缺氧状态下,胃癌细胞均能优先进行有氧糖酵解方式进行糖代谢,这一现象也称为瓦尔堡效应[5]。CAG伴随的胃黏膜腺体萎缩作为胃癌前病变的起始阶段,经肠上皮化生和异型增生等持续进展的病理改变,最终形成胃癌。在由CAG向胃癌进展的过程中同时伴随有糖酵解水平异常变化[6],在此过程中糖酵解通量的增加需要编码葡萄糖转运蛋白和糖酵解酶的基因的转录激活,这些相关酶的基因主要由缺氧诱导因子-1α(Hypoxia-inducible Factor-1α,HIF-1α)介导,它是糖酵解上游的关键调控分子[7],参与有氧糖酵解中关键酶的调节。
目前临床上主要采用对症药物治疗CAG等癌前病变,但仍没有特效的治疗方案,整体疗效有待提高。艾灸疗法历经千年历史,在治疗胃病方面具有独特优势,可改善CAG患者临床症状[8-9],但其潜在作用机制还有待深入探索。本研究拟从隔药灸调控HIF-1α及糖酵解代谢角度探究艾灸治疗CAG的作用机制,为临床艾灸治疗CAG提供科学依据。
1 材料与方法
1.1 材料
1.1.1 动物 44只6周龄清洁级Wistar大鼠(雄性),体质量为(150±30)g,实验动物由上海斯莱克实验动物有限公司提供。动物合格证编号为2015000538649;许可证号为SCXK(沪)2012-0002。饲养环境设置为室温18~22 ℃,室内湿度40%~70%,保持12 h昼夜节律。实验过程严格按照上海中医药大学实验动物管理委员会制定的实验动物使用及保护条例操作,并通过动物福利伦理委员会批准(伦理审批号:17743)。
1.1.2 药物 N-甲基-N′-硝基-N-亚硝基胍(N-methyl-N′-nitro-N-nitrosoguanidine,MNNG)(東京化成工业株式会社,日本,批号:TCI-M0527);叶酸片(常州制药厂有限公司,国药准字H32023302)。
1.1.3 试剂与仪器 多聚甲醛(上海国药集团,批号:80096618);苏木精-伊红染液(南京建成,批号:D006-1-1);BCA蛋白浓度测定试剂盒(司鼎生物,批号:SD0012);大鼠乳酸脱氢酶检测试剂盒、肿瘤型M2-PK(M2-PK)ELISA试剂盒(司鼎生物,批号:SDR0067、SDR0068);RT reagent Kit(TAKARA,日本,批号:RR047A);TB Green qPCR试剂盒(TAKARA,日本,批号:RR420A);Trizol(Invitrogen,美国,批号:15596018);Anti-STAT3抗体(Abcam,英国,批号:ab76315);Anti-HIF-1 alpha抗体(Abcam,英国,批号:ab216842)。脱水机(Leica,德国,型号:ASP200)、包埋机(Leica,德国,型号:EG1160)、切片机(Leica,德国,型号:RM2235)、展片机(Leica,德国,型号:HI1210);分光光度计(Thermo公司,美国,型号:NanoDrop 2000);PCR仪(Applied Biosystems,美国,型号:Veriti 96-Well Thermal Cycler);qPCR仪(Roche,美国,型号:LightCycler 480Ⅱ);光学显微镜(Olympus公司,日本,型号:BX53)。
1.2 方法
1.2.1 分组与模型制备 实验大鼠44只,预适应1周后,随机分为正常组(n=8)和造模组(n=36)。正常组大鼠予以常规饮食。造模组大鼠采用170 mg/L MNNG结合夹尾与饥饱失常综合刺激法制备CAG大鼠模型[10]。每日新鲜配制MNNG溶液自由饮用;饱食2 d,禁食1 d,循环实施;使用夹尾钳夹鼠尾夹紧10 min/次,1次/周,使之保持激怒和互相攻击的状态;造模34周后随机抓取正常组2只、造模组大鼠4只进行模型鉴定,取胃窦组织胃黏膜做HE染色病理观察。镜下见胃黏膜出现腺体萎缩、和(或)肠上皮化生、异型增生等病理变化,确定模型制作成功。造模期间造模组大鼠共计死亡8只,模型鉴定后将24只造模组大鼠按体质量分级分为4组:模型组、隔药饼灸组、隔姜灸组和西药组,每组6只。
1.2.2 干预方法 正常组与模型组大鼠不进行干预,只做与3组干预组相同的抓握和固定操作;隔药饼灸组、隔姜灸组CAG大鼠干预均取中脘穴、气海穴进行隔物灸[11],使用鼠衣及塑料大鼠固定架约束大鼠,将规格为直径1 cm、厚度0.5 cm的药饼(主要成分为制附子、肉桂等,用黄酒调制而成)或生姜切片置于大鼠的穴区上,上置艾炷90 mg,每穴灸2壮,1次/d,6次/周,共4周;西药组按照1 mL/100 g给予叶酸悬浊液灌胃,1次/d,6次/周,共4周。
1.2.3 检测指标与方法
1.2.3.1 大鼠胃窦的组织病理学观察 大鼠禁食不禁水24 h后称重取材:采用2%戊巴比妥钠腹腔注射进行麻醉,麻醉后将大鼠腹部朝上固定,剖开腹腔,快速将全胃取出,于冰上将全胃沿胃大弯剪开,洗净胃内容物后切取病变黏膜组织;取1/2胃窦部组织剪碎后存于冻存管内,后迅速投入液氮冷冻1 h,及时转移至-80 ℃冰箱冻存备用;其余胃窦部组织固定于4%多聚甲醛48 h,脱水后石蜡包埋、切片(厚4 μm),进行苏木精-伊红染色,于200倍光镜下观察拍片。
1.2.3.2 采用实时荧光定量PCR(RT-qPCR)法检测胃黏膜HIF-1α、信号转导及转录激活因子3(Signal Transduction and Activator of Transcription3,STAT3)、丙酮酸激酶M(PKM)的mRNA表達 取样各组大鼠胃黏膜组织100 mg进行预处理→加入氯仿→12 000 r/min离心15 min(离心半径9.5 cm)后取上清液→加入异丙醇混匀后沉淀→离心得到微量白色沉淀→4 ℃环境下反复离心→提取总RNA→反转录→配制反应液(冰上)→实施Real Time检测→数据分析。引物序列见表1。
1.2.3.3 采用免疫组织化学法检测STAT3、HIF-1α蛋白在胃黏膜中的定位和表达 石蜡切片(厚4 μm)→二甲苯脱蜡至水→柠檬酸盐水抗原修复→过氧化物酶阻断→BSA封闭→分别滴加一抗、二抗→PBS洗涤→加入DBS显色→苏木精复染3 min→脱水封片,拍照观察,统计每张图像的积分光密度(IOD)和阳性表达面积(Area),计算平均光密度值(AOD)。
1.2.3.4 胃黏膜组织丙酮酸激酶M2(PKM2)和乳酸脱氢酶(LDH)活性测定 采用ELISA法检测PKM2活性。完成样本收集与溶液配置后开始检测:加样→洗板→加入酶标抗体工作液→重复操作→加入底物工作液→在37 ℃烘箱中反应15 min(避光)→加入终止液并充分混匀并测量450 nm吸光度→计算浓度。LDH活性采用比色法在酶标板上反应,样品及标准品中的LDH与底物工作液显色,测量490 nm处OD值,并通过绘制标准曲线求出相应的LDH浓度。
1.3 统计学方法 采用SPSS 21.0统计软件进行数据分析。符合正态的测量数据采用均数±标准差(±s)表示,非正态的数据采用M(P25,P75)表示。符合正态的数据采用单因素方差分析。若方差齐性,则使用最小显著差异法LSD进行两两比较;方差不齐性则采用Dunnett′s T3检验。如果数据不符合正态性则使用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠胃黏膜组织病理学观察
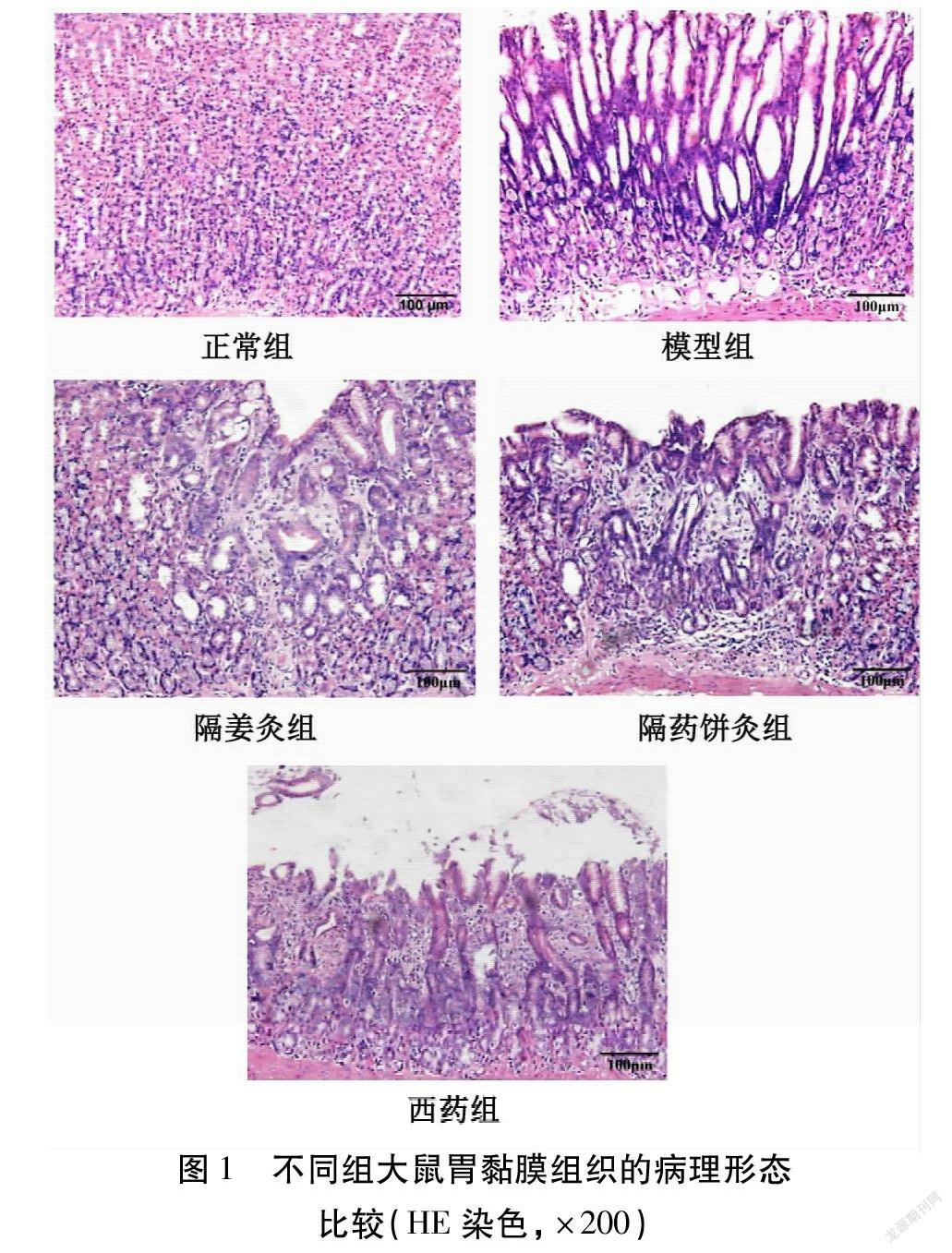
由图1可见,正常组大鼠胃黏膜固有腺体结构正常、排列规整,未见腺体萎缩及胃主细胞、壁细胞减少,可见少量中性粒细胞、淋巴细胞;模型组大鼠固有腺体结构紊乱,腺体减少,成纤维细胞增殖,可见诸如腺体萎缩、肠上皮化生、假幽门腺化生和(或)异型增生等病理改变。经干预后,隔药饼灸组、隔姜灸组、西药组大鼠黏膜层及下层炎症细胞相较模型组少,胃黏膜腺体萎缩、肠化生、异型增生等病理变化程度减轻。
2.2 隔物灸对CAG大鼠胃黏膜组织STAT3、HIF-1α、PKM2 mRNA表达的影响
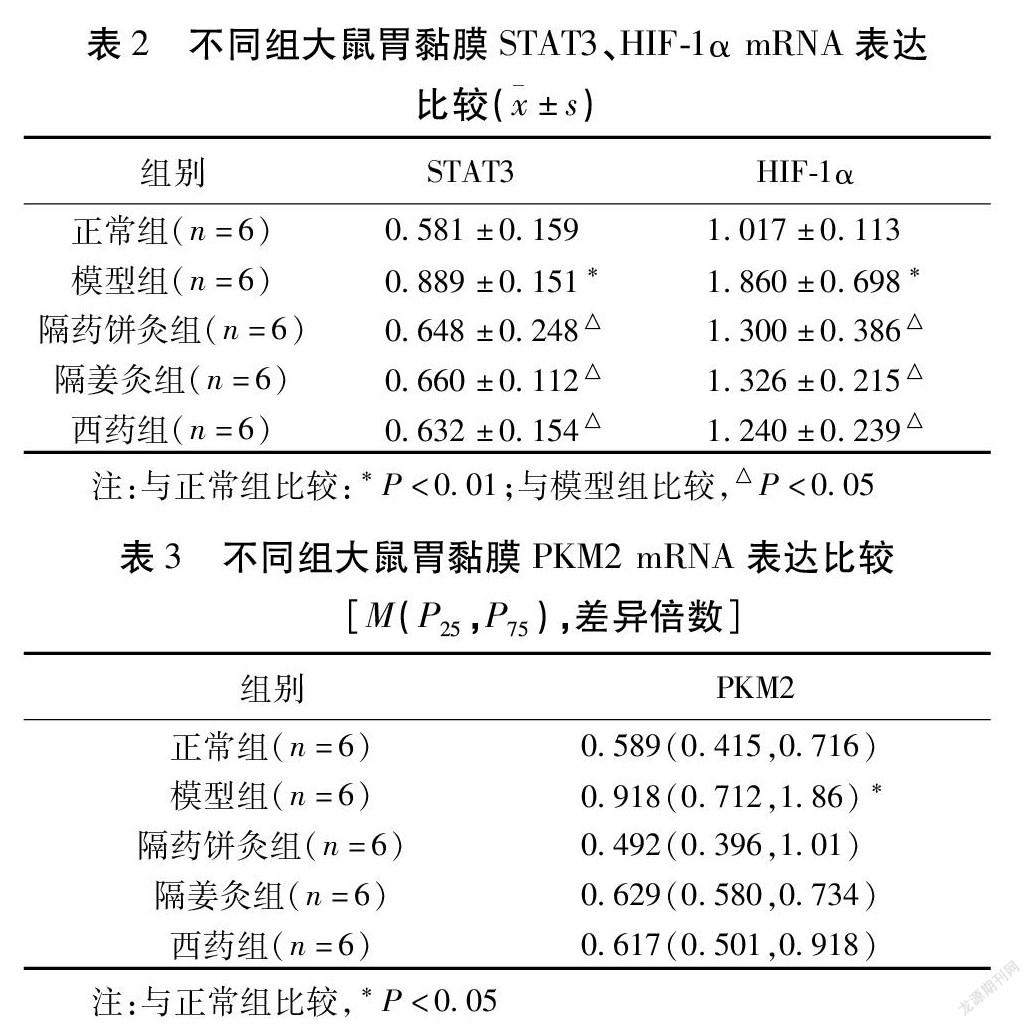
与正常组比较,模型组CAG大鼠胃黏膜组织中STAT3、HIF-1α、PKM2 mRNA表达水平上调,差异均有统计学意义(均P<0.05)。与模型组比较,隔药饼灸组、隔姜灸组、西药组大鼠胃黏膜组织中STAT3、HIF-1α mRNA表达下调,差异有统计学意义(均P<0.05)。与模型组比较,3组干预组大鼠PKM2 mRNA表达差异无统计学意义(P>0.05)。见表2~3。
2.3 隔物灸对CAG大鼠胃黏膜组织STAT3、HIF-1α蛋白定位及表达的影响
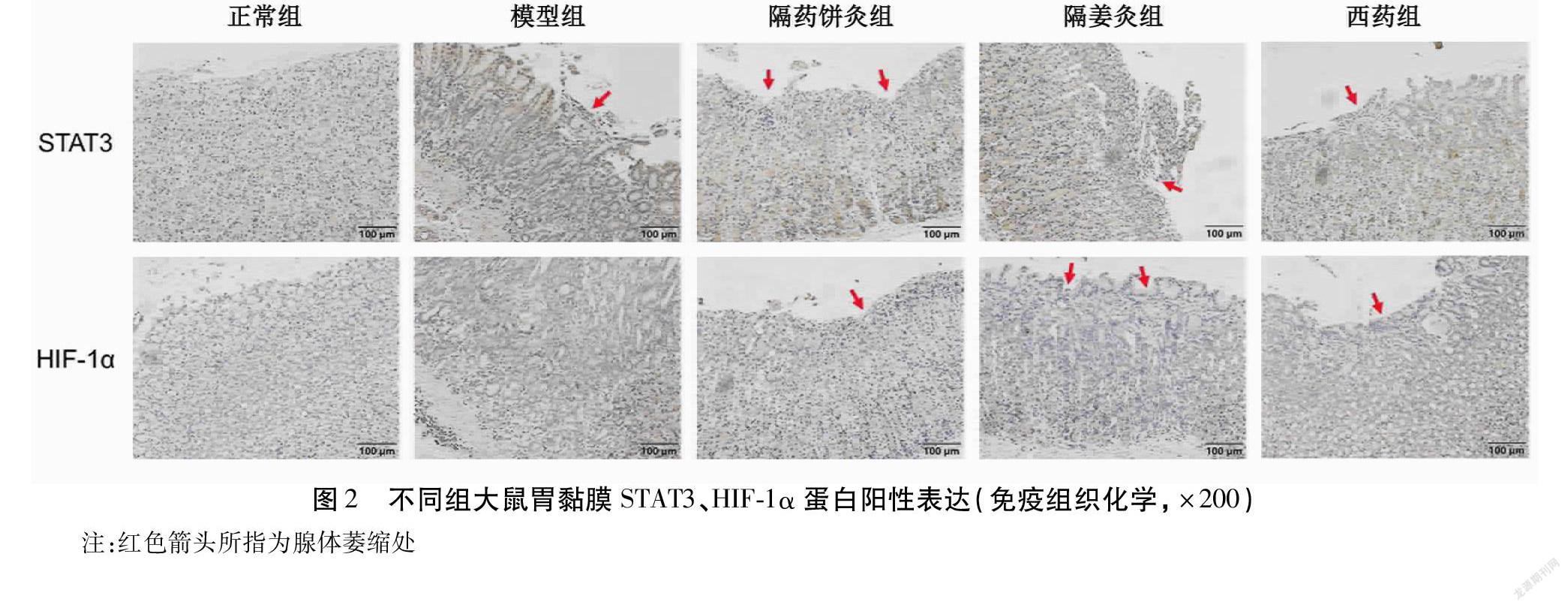
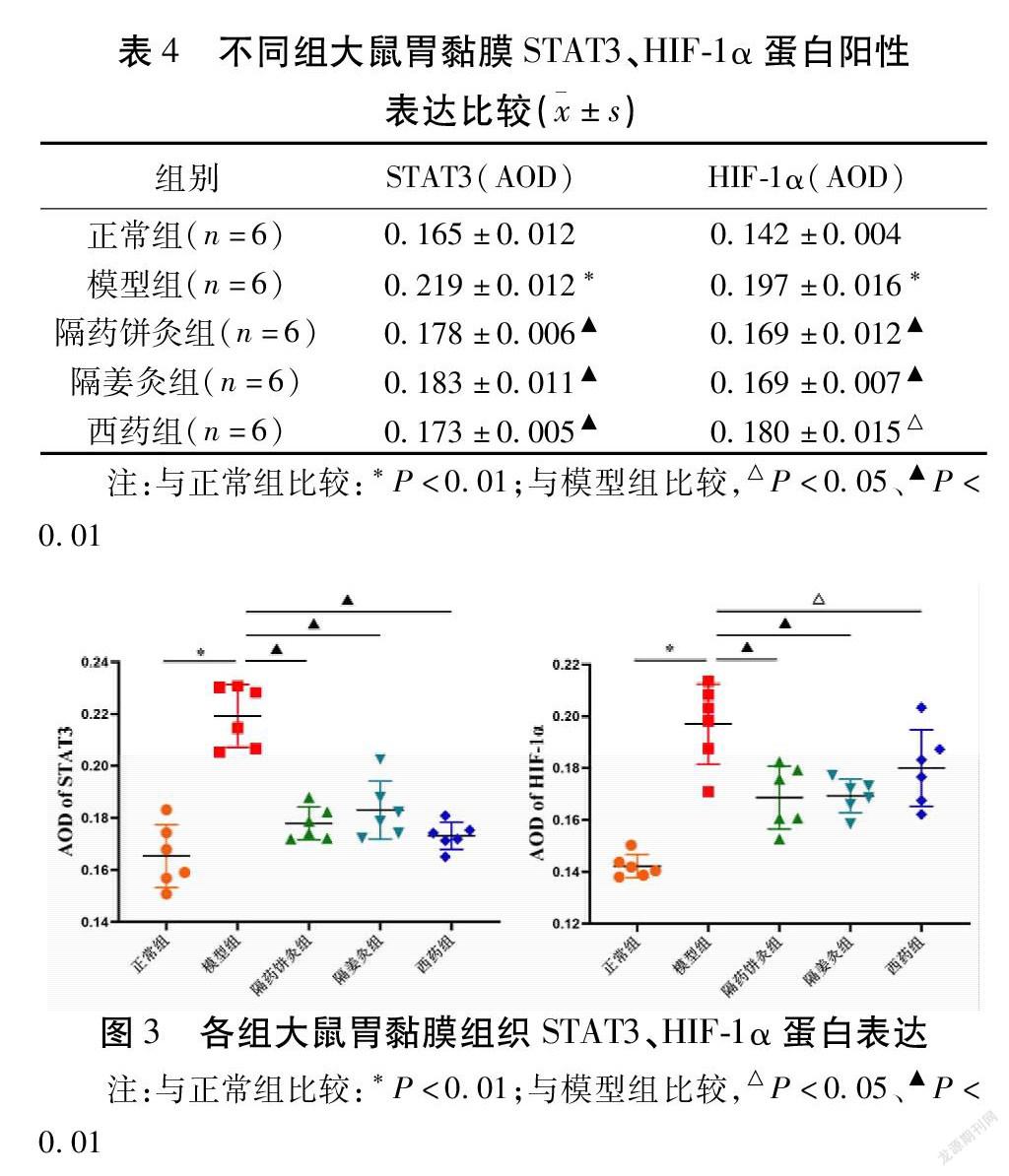
正常组大鼠胃黏膜组织STAT3、HIF-1α蛋白有少量表达,主要表达在胞浆,着色较浅;模型组胃黏膜组织STAT3、HIF-1α蛋白阳性表达增多,胃黏膜固有腺体呈大面积胞浆黄染,分布密集,着色较深;与模型组比较,2组隔物灸组及西药组大鼠胃黏膜组织STAT3、HIF-1α阳性表达减少,胞浆染色变浅。与正常组比较,模型组大鼠胃黏膜STAT3、HIF-1α平均光密度显著升高(均P<0.01);与模型组比较,2组隔物灸组、西药组大鼠胃黏膜组织STAT3、HIF-1α平均光密度降低,差异均有统计学意义(均P<0.05)。见表4、图2~3。
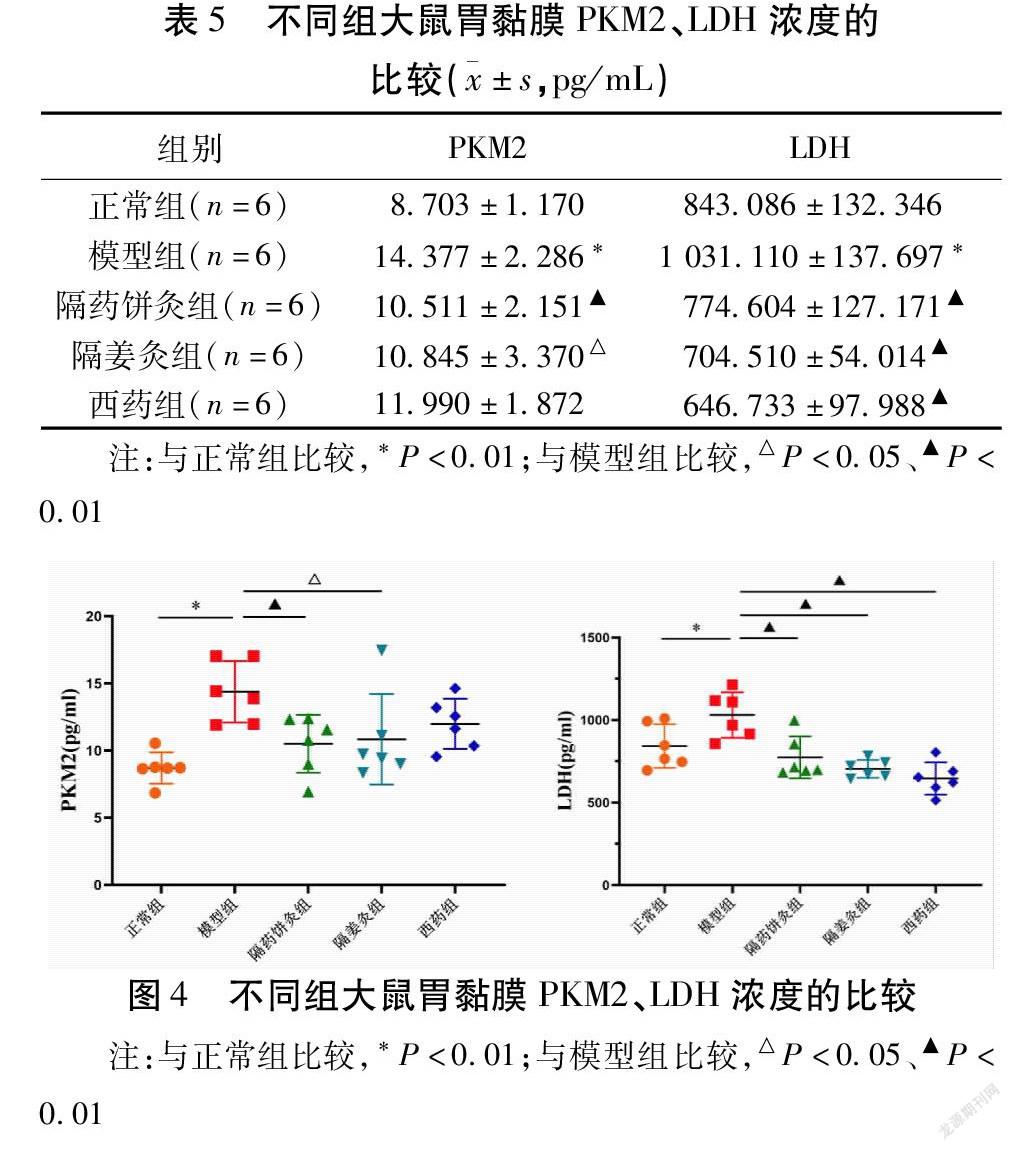
2.4 隔物灸对CAG大鼠胃黏膜组织LDH、PKM2浓度的影响
模型组大鼠与正常组大鼠比较,LDH和PKM2浓度显著升高(均P<0.01);与模型组比较,两隔物灸组大鼠胃黏膜中PKM2浓度下降,差异均有统计学意义(均P<0.05),两隔物灸组与西药组大鼠胃黏膜LDH浓度显著下降(均P<0.01)。见表5、图4。
3 讨论
据统计,CAG患病率在不同国家和地区具有较大差异,主要致病原因与幽门螺杆菌感染、环境、遗传、早期诊断等因素有关。我国属于CAG高发地区,据中华医学会2011年间开展的一项横断面调查结果显示[12],纳入的8 892例慢性胃炎患者中有1 573位被诊断为CAG,其中肠上皮化生和异型增生分别占23.6%和7.3%,在慢性胃炎患者病理检查中较为常见。此外,无论是男性或女性,CAG发病率及检出率均随年龄增长而显著上升,其患病率与胃癌发病率正相关。
CAG主要属中医胃痞、胃脘痛、呃逆等范畴,主证为胃脘部胀满、痞闷不舒。病因则不外乎饮食不节、外感六淫、情志不畅、脾胃虚弱等方面。本研究隔物灸所选取中脘、气海两穴为临床胃病治疗之要穴。中脘穴别名太仓、胃脘,为胃之募穴,又为腑会,与胃腑之气相通;气海穴为肓之原穴,亦为足三阴交与任脉之交会穴,主一身上下气机。两穴均属任脉,临床主要用于胃痛、腹胀、食不化等症状。隔物灸属传统灸法间接灸范围,可根据所隔介质之不同有针对性地加强疗效。本研究所选隔药饼灸与隔姜灸2者在临床胃病治疗中均广为运用,所用药饼主要成分为附子、肉桂,具有温阳助火之效,隔姜灸则取生姜辛温之性,灸之可温补中土、散寒止呕。本团队前期通过临床及动物实验两方面明确了艾灸对CAG的有效性,可有效缓解CAG患者消化不良等症状,促进胃黏膜上皮的修复[13],逆转肠化,从而预防癌变的发生[14]。
CAG发病机制十分复杂,糖酵解代谢异常参与胃癌的发生与发展[6],其在癌前病变中的重要性也逐渐得到重视。Liu等[15]研究证实,在胃癌前病变中既已存在糖酵解水平的异常。胃黏膜组织的局部缺氧可导致CAG大鼠胃黏膜血管内皮细胞损伤,HIF-1α在缺氧刺激下活性增加,刺激局部微血管新生,并在炎症反应、肿瘤浸润生长及各种基因的转录等方面起重要作用[16-17]。同時,HIF-1α是糖酵解的关键上游调节因子,HIF-1α的过表达可通过上调糖酵解酶的表达来促进糖酵解活性,改变细胞糖酵解水平[18-20]。STAT3可调节HIF-1α的稳定性和活性,激活的STAT3可通过阻断HIF-1α的降解,加速其从头合成,从而增加HIF-1α稳定性,上调HIF-1α蛋白水平[21]。PKM2和LDH是糖酵解代谢中的重要调节酶。前者是催化磷酸烯醇式丙酮酸转化为丙酮酸的限速酶,为糖酵解途径的最后环节[22]。此外,PKM2可通过磷酸化STAT3来激活HIF-1α的转录[23],当它易位到细胞核时,与HIF-1α发生相互作用从而调节诸多糖酵解酶的表达。同时研究还发现,过表达PKM2在癌细胞中伴有着更高的葡萄糖消耗与乳酸水平[24]。LDH则可使丙酮酸生产乳酸,当乳酸过度堆积时使微环境酸化,有利于肿瘤的发生发展[25]。
本实验结果显示,CAG大鼠胃黏膜组织中STAT3、HIF-1α mRNA表达上调,STAT3、HIF-1α蛋白表达显著升高,提示慢性萎缩性胃炎大鼠胃黏膜存在缺氧情况。研究结果还发现,模型组大鼠胃黏膜组织中PKM2 mRNA表达上调,PKM2、LDH活性显著升高,提示CAG大鼠糖酵解水平异常升高。经隔物灸干预后,2组隔物灸组CAG大鼠STAT3、HIF-1α mRNA及蛋白表达均下调,糖酵解调节酶PKM2、LDH活性下降,而隔物灸对PKM2 mRNA的表达影响仅有下调趋势。以上结果提示,隔物灸可通过下调糖酵解上游调节因子HIF-1α及其调控因子STAT3的表达,降低糖酵解调节酶PKM2、LDH活性,抑制CAG大鼠胃黏膜组织的有氧糖酵解,起到改善胃黏膜组织异常糖代谢的作用,以阻断萎缩性胃炎恶化,进一步趋向癌症的发展。
本研究从隔物灸对CAG大鼠HIF-1α表达及相关糖酵解调节酶的影响进行阐述和分析,从新的角度阐释艾灸对CAG的效应机制,研究发现抑制HIF-1α介导的异常糖酵解代谢水平可能是隔物灸法治疗CAG的效应机制之一。然而本实验仅检测了2个糖酵解调节关键酶,且2种隔物灸灸法之间的差异未进行深入挖掘,后续研究中将进一步开展相关检测,拟更全面阐述艾灸对糖酵解代谢的影响。其次,关于CAG大鼠胃黏膜组织有氧糖酵解的启动机制仍不明确,对艾灸调控HIF-1α的机制与相关通路并未做深入探索,未来将结合基因敲除动物进行深入的研究。
参考文献
[1]Zhang L,Liu Y,You P,et al.Occurrence of gastric cancer in patients with atrophic gastritis during long-term follow-up[J].Scand J Gastroenterol,2018,53(7):843-848.
[2]NAGAYO T.Histological diagnosis of biopsied gastric mucosae with special reference to that of borderline lesions[J].Gann Monogr,1971,11:245-256.
[3]Medzhitov R.Origin and physiological roles of inflammation[J].Nature,2008,454(7203):428-435.
[4]Yu Q,Guo M,Zeng W,et al.Interactions between NLRP3 inflammasome and glycolysis in macrophages:New insights into chronic inflammation pathogenesis[J/OL].Immun Inflamm Dis,2021.[2021-12-13].https://onlinelibrary.wiley.com/doi/10.1002/iid3.581.[published online ahead of print,December 13,2021]
[5]Xu J,Zheng X,Cheng KK,et al.NMR-based metabolomics Reveals Alterations of Electro-acupuncture Stimulations on Chronic Atrophic Gastritis Rats[J].Sci Rep,2017,7:45580.
[6]Fernández-Coto DL,Gil J,Hernández A,et al.Quantitative proteomics reveals proteins involved in the progression from non-cancerous lesions to gastric cancer[J].J Proteomics,2018,186:15-27.
[7]Kierans SJ,Taylor CT.Regulation of glycolysis by the hypoxia-inducible factor(HIF):implications for cellular physiology[J].J Physiol,2021,599(1):23-37.
[8]张迪,袁星星,王炳予,等.合募配穴灸法治疗慢性萎缩性胃炎临床观察[J].上海针灸杂志,2017,36(12):1401-1405.
[9]范丽红,方园,黄河,等.针刺与艾灸治疗慢性萎缩性胃炎的多中心前瞻性临床研究[J].湖南中医药大学学报,2020,40(9):1060-1064.
[10]Miwa H,Endo K,Wada R,et al.Cellular proliferation and differentiation in rat atrophic gastric mucosa induced by N′-methyl-N′-nitro-N-nitrosoguanidine[J].J Clin Gastroenterol,1997,25(Suppl1):116-121.
[11]郭义.实验针灸学[M].北京:中国中医药出版社,2008:415.
[12]Du Y,Bai Y,Xie P,et al.Chronic gastritis in China:a national multi-center survey[J].BMC Gastroenterol,2014,14:21.
[13]李璟,李琪,王硕硕,等.隔物灸法对慢性胃炎患者胃黏膜保护的临床效应研究[J].世界科学技术-中医药现代化,2016,18(3):361-367.
[14]郑雪,萧有智,吴梦蝶,等.隔药饼灸对慢性萎缩性胃炎大鼠PTEN-AKT抑癌途径的作用机制研究[J].上海针灸杂志,2021,40(12):1500-1508.
[15]Liu W,Pan HF,Yang LJ,et al.Panax ginseng C.A.Meyer(Rg3) Ameliorates Gastric Precancerous Lesions in Atp4a(-/-) Mice via Inhibition of Glycolysis through PI3K/AKT/miRNA-21 Pathway[J].Evid Based Complement Alternat Med,2020,2020:2672648.
[16]Eckle T,Faigle M,Grenz A,et al.A2B adenosine receptor dampens hypoxia-induced vascular leak[J].Blood,2008,111(4):2024-2035.
[17]王坤,马林,汪花,等.穴位埋线对慢性萎缩性胃炎大鼠JAK 2-STAT 3信号转导通路相关因子表达的影响[J].针刺研究,2018,43(11):682-686.
[18]Zhou Y,Huang X,Zhao T,et al.Hypoxia augments LPS-induced inflammation and triggers high altitude cerebral edema in mice[J].Brain Behav Immun,2017,64:266-275.
[19]Vavricka S,Ruiz PA,Scharl S,et al.Protocol for a prospective,controlled,observational study to evaluate the influence of hypoxia on healthy volunteers and patients with inflammatory bowel disease:the Altitude IBD Study[J].BMJ Open,2017,7(1):e013477.
[20]Anand AC,Sashindran VK,Mohan L.Gastrointestinal problems at high altitude[J].Trop Gastroenterol,2006,27(4):147-153.
[21]Jung JE,Lee HG,Cho IH,et al.STAT3 is a potential modulator of HIF-1-mediated VEGF expression in human renal carcinoma cells[J].FASEB J,2005,19(10):1296-1298.
[22]Gao X,Wang H,Yang JJ,et al.Pyruvate kinase M2 regulates gene transcription by acting as a protein kinase[J].Mol Cell,2012,45(5):598-609.
[23]Dong T,Yan Y,Chai H,et al.Pyruvate kinase M2 affects liver cancer cell behavior through up-regulation of HIF-1α and Bcl-xL in culture[J].Biomed Pharmacother,2015,69:277-284.
[24]Sun Q,Yuan M,Wang H,et al.PKM2 Is the Target of a Multi-Herb-Combined Decoction During the Inhibition of Gastric Cancer Progression[J].Front Oncol,2021,11:767116.
[25]Lukacova S,Srensen BS,Alsner J,et al.The impact of hypoxia on the activity of lactate dehydrogenase in two different pre-clinical tumour models[J].Acta Oncol,2008,47(5):941-947.
(2022-01-06收稿 本文編辑:吴珊)
