艾拉莫德与羟氯喹治疗原发性干燥综合征有效性和安全性比较的系统分析①
2022-03-23高紫欣谷三炜姜振宇吉林大学第一医院风湿免疫科长春130021
梁 爽 姚 胜 高紫欣 谷三炜 姜振宇 马 宁(吉林大学第一医院风湿免疫科,长春 130021)
原发性干燥综合征(primary Sjogren's syndrome,pSS)是一种慢性炎症性自身免疫性疾病,好发于中年女性,男女比例达到1∶9[1]。国内患病率为0.33%~0.77%,世界患病率为0.1%~0.7%[2]。起病较隐匿,主要侵犯外分泌腺,尤其是唾液腺和泪腺,严重时可导致视力受损[3-4]。全身表现可分为非内脏(皮肤、关节痛、肌痛)和内脏(肺、心、肝或肾、胃肠、内分泌、中枢和外周神经系统);还可以存在紫癜、周围神经病变、补体水平低、高免疫球蛋白血症、中性粒细胞减少症和淋巴细胞减少症[5]。目前尚无完全治愈的方法,以减轻患者症状,提高生活质量,预防病情进展为治疗目标[6]。常用免疫抑制剂包括羟氯喹、来氟米特、吗替麦考酚酯、环孢素、艾拉莫德等[7]。艾拉莫德(iguratimod,T-614)是一种新型小分子抗风湿药物,广泛应用于日本和中国,通过抑制各种炎症细胞因子发挥抗炎作用,通过抑制B 细胞活化从而减少免疫球蛋白产生,与其他的DMARDs 药物的作用机制存在不同性和独特性,近年来广泛用于pSS 的治疗[8-12]。羟氯喹(hydroxychloroquine,HCQ)是国际指南推荐治疗pSS 的基础用药。本研究通过Meta分析方法系统评价了T-614与HCQ 治疗pSS 的有效性与安全性,为临床治疗方案的选择提供循证医学证据。
1 资料与方法
1.1 资料
1.1.1 纳入标准
1.1.1.1 研究类型 所有关于T-614 和HCQ 治疗pSS 的随机对照试验(RCT),语种限定为中文和英文。
1.1.1.2 研究对象 均经临床明确诊断的pSS 患者,不限年龄、性别、病程[6]。
1.1.1.3 干预措施 试验组采用T-614 治疗,对照组采用HCQ 治疗,同时伴有基础治疗。T-614、HCQ剂量均为常用剂量:T-614 为25 mg,bid;HCQ 为200 mg,bid;基础治疗为甲泼尼龙8 mg,qd。
1.1.1.4 结局指标 ①疗效评价:临床总有效率、ESSDAI评分(欧洲抗风湿病联盟干燥综合征疾病活动指数,European League against Rheumatism Sjogren's syndrome disease activity index)、ESSPRI 评分(欧洲抗风湿病联盟干燥综合征患者报告指数,European League against Rheumatism Sjogren's syndrome disease reported index)、泪液分泌试验(Schirmeri 试验)、唾液流率;②实验室指标:IgG、ESR、RF、PLT、CD19+CD27+B 细胞百分率、抗心磷脂抗体(ACL);③安全性指标:不良反应总发生率及各类型不良反应发生率。
1.1.2 排除标准 ①对T-614、HCQ 过敏者;②研究前2 周内接受免疫抑制剂、肾上腺皮质激素等治疗的试验;③有丙肝感染史;④患有艾滋病、淋巴瘤及结节病等疾病;⑤合并其他结缔组织病、心脑血管疾病、肝肾和造血疾病;⑥存在重要脏器功能障碍或精神障碍;⑦继发性干燥综合征;⑧重复发表的文献;⑨受试者基本信息或干预措施未提供的研究报告;⑩单纯描述性研究,无对照药物组;会议文章或无完整试验方法及结果,仅以摘要形式发表的文献。
1.2 方法
1.2.1 检索策略 计算机检索PubMed、The Cochrane Library、Embase、Web of Science、CBM、VIP、WanFang Data 和CNKI 数据库,搜集有关比较T-614与HCQ 治疗pSS 有效性和安全性的RCT,检索时限均从建库至2020 年12 月。检索采用主题词和自由词结合的方式。英文检索词包括:Iguratimod、T-614、Hydroxychloroquine、Hydroxychloroquine sulfate、HCQ、primary Sjogren's syndrome、Sjogren's syndrome、Sicca Syndrome、Sicca exocrinopathy、SS等。中文检索词包括:艾拉莫德、羟氯喹、硫酸羟氯喹、原发性干燥综合征、舍格伦综合征等。
1.2.2 文献筛选与资料提取 2 名研究者根据纳入与排除标准独立筛选文献和数据提取,若遇分歧,通过协商讨论解决。对多篇数据相同文献采用质量优先为入组原则。
1.2.3 文献质量评价 由2名研究者依据Cochrane手册5.1.0版推荐的RCT偏倚风险评估工具独立评价纳入研究的偏倚风险,并交叉核对结果。如有分歧,仍通过讨论或征求第三方意见解决。
1.3 统计学分析 采用RevMan 5.3软件对纳入研究进行统计分析。计量资料和计数资料分别采用均数差(mean difference,MD)及风险比(risk ratio,RR)为效应分析统计量,各效应量均给出其95%CI。采用χ2检验对纳入研究进行异质性分析(检验水平为α=0.1),并结合I2值定量判断异质性大小。若I2≤50%表明各研究结果间无统计学异质性,则采用固定效应模型进行Meta 分析;若I2>50%则存在异质性,需进一步分析异质性来源,进行亚组分析或敏感性分析后,若异质性消失,则采用固定效应模型分析,若异质性仍存在,则采用随机效应模型进行Meta 分析。Meta 分析的水准设为α=0.05。发表偏倚采用漏斗图进行评价。
2 结果
2.1 文献筛选流程及结果 初检共获得相关文献248 篇,经逐层筛选,最后纳入12 个RCT[13-24]。文献筛选流程结果见图1。
㉔[日]成田頼明:《行政の制度·システムの改革と会計検査のあり方》,《会計検査研究》22号【巻頭言】2000年第9期。
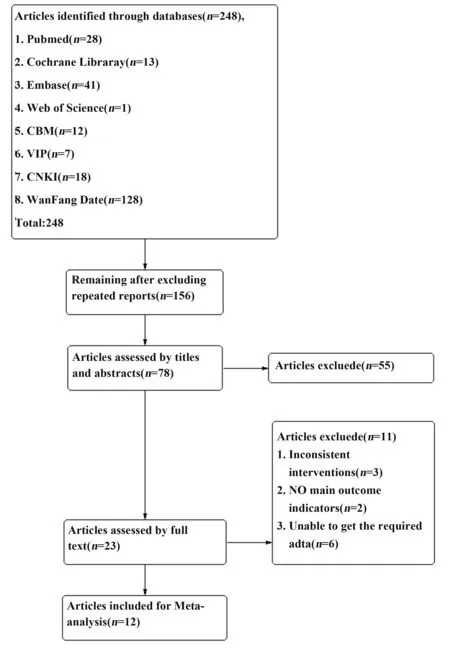
图1 文献筛选流程及结果Fig.1 Process and results of literature screening
2.2 纳入研究的基本特征与质量评价结果 纳入研究的基本特征见表1。纳入研究的偏倚风险评价结果见图2、3。
表1 纳入研究的基本特征()Tab.1 Basic characteristics of included studies()
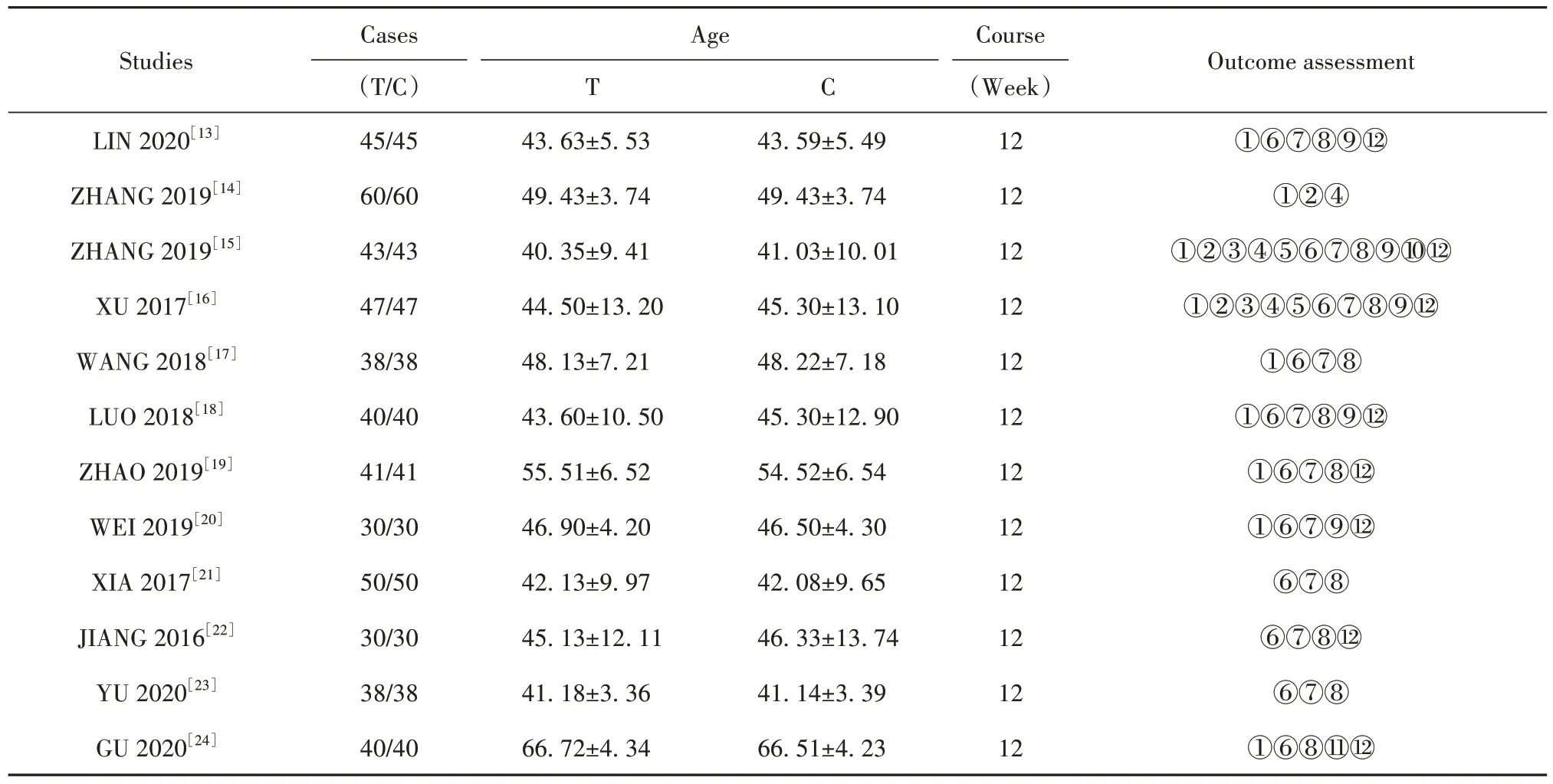
表1 纳入研究的基本特征()Tab.1 Basic characteristics of included studies()
Note:T.Test group;C.Control group;①Clinical effective rate;②ESSDAI score;③ESSPRI score;④Schirmeri test;⑤Saliva flow rate;⑥IgG;⑦ESR;⑧RF;⑨PLT;⑩CD19+CD27+B cells;⑪ACL;⑫Incidence of adverse reactions and various types of adverse reactions.

图2 纳入研究的偏倚风险评价结果Fig.2 Results of risk of bias evaluation of included studies

图3 纳入研究的偏倚风险百分比评估图Fig.3 Results of percentage risk of bias evaluation of included studies
2.3 疗效评价
2.3.1 临床总有效率纳入9 个RCT[13-20,24],共768 例患者。采用固定效应模型进行Meta 分析,结果显示:T-614组临床总有效率显著优于HCQ 组,差异有统计学意义[RR=1.23,95%CI(1.16,1.31),P<0.000 01](图4)。
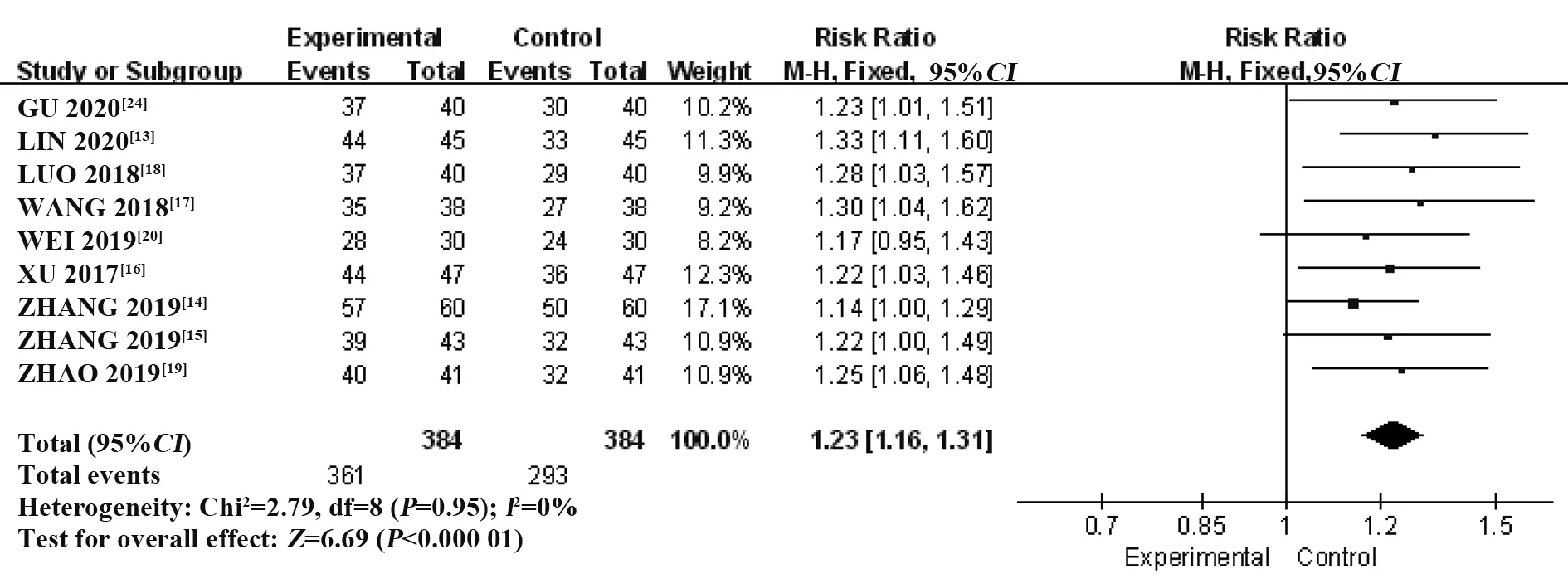
图4 T-614 组与HCQ 组治疗pSS 的临床有效率比较的Meta分析Fig.4 Meta-analysis of comparison of clinical effective rate of pSS between T-614 group and HCQ group
2.3.2 ESSDAI 评分 纳入3 个RCT,共300 例患者[14-16]。采用随机效应模型进行Meta 分析,结果显示:T-614 组ESSDAI 评分前后差值更大,说明T-614组能够明显降低患者ESSDAI 评分,显著优于HCQ组,差异有统计学意义[MD=-1.94,95%CI(-2.25,-1.33),P<0.000 01](图5)。
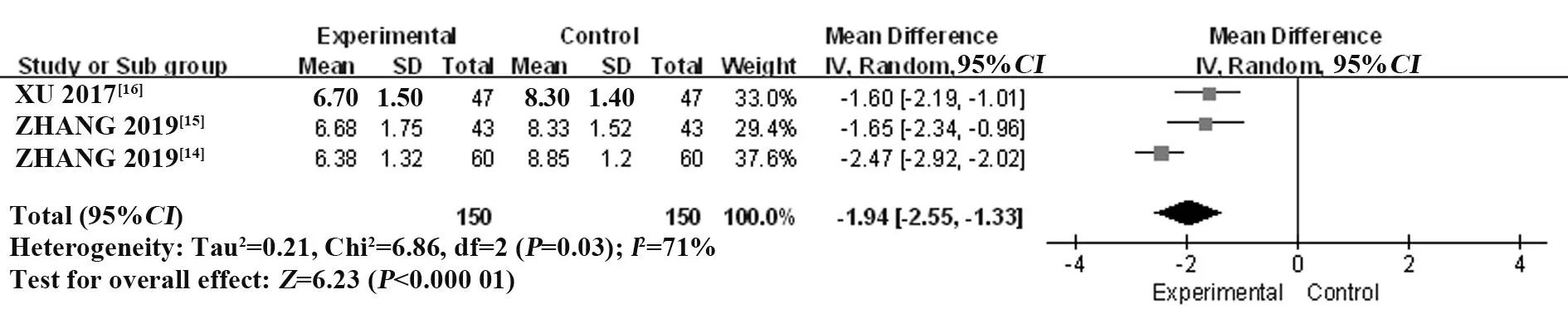
图5 T-614 组与HCQ 组治疗pSS 的ESSDAI 评分比较的Meta分析Fig.5 Meta-analysis of ESSDAI score between T-614 group and HCQ group in treatment of pSS
2.3.3 ESSPRI 评分 纳入2 个RCT[15-16],共180 例患者。采用随机效应模型进行Meta 分析,结果显示:T-614组可更有效降低患者ESSPRI评分,显著优于HCQ 组,差异有统计学意义[MD=-2.16,95%CI(-2.98,-1.34),P<0.000 01](图6)。
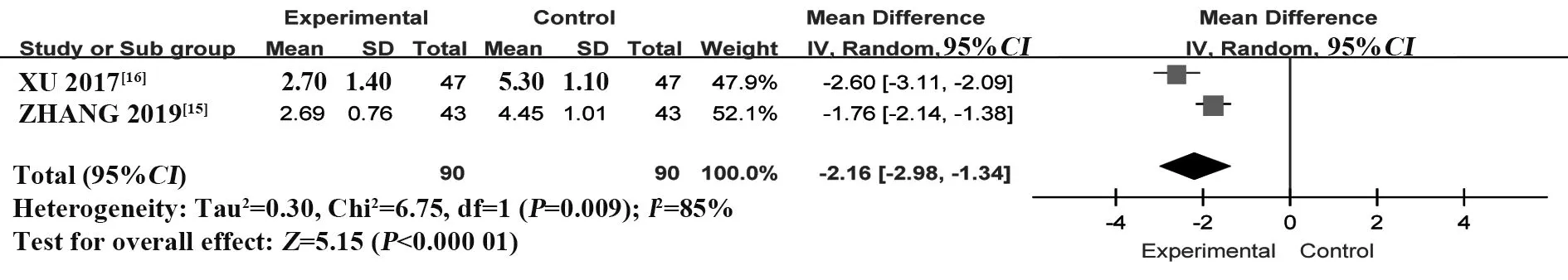
图6 T-614 组与HCQ 组治疗pSS 的ESSPRI 评分比较的Meta分析Fig.6 Meta-analysis of ESSPRI scores between T-614 group and HCQ group in treatment of pSS
2.3.4 Schirmeri试验 纳入3个RCT[14-16],共300例患者。采用随机效应模型进行Meta 分析,结果显示:T-614 组可有效提高患者泪液分泌量,Schirmeri试验值高于HCQ 组,差异有统计学意义[MD=2.09,95%CI(1.62,2.56),P<0.000 01](图7)。
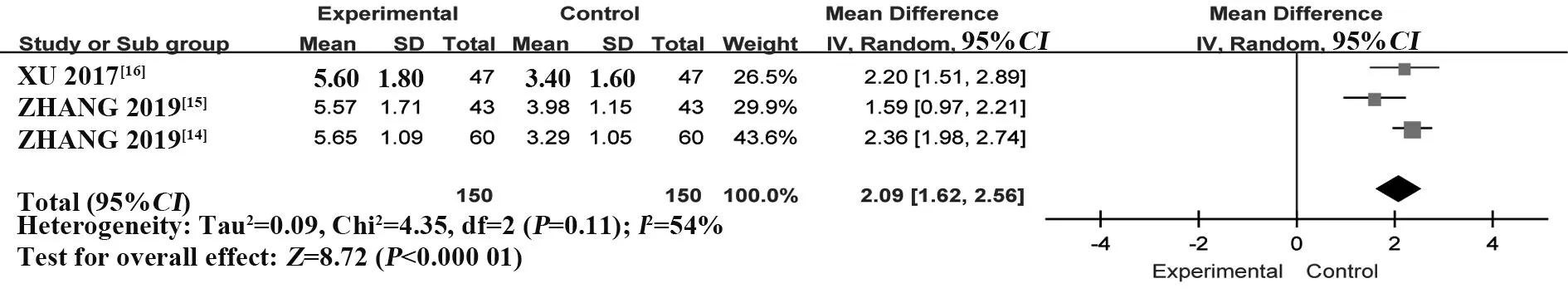
图7 T-614 组 与HCQ 组治 疗pSS 的Schirmeri 试 验比较的Meta分析Fig.7 Meta-analysis of Schirmeri test between T-614 group and HCQ group in treatment of pSS
2.3.5 唾液流率 纳入2 个RCT[15-16],共180 例患者。采用固定效应模型进行Meta 分析,结果显示:T-614 组可有效改善患者唾液流率,显著高于HCQ组,差异有统计学意义[MD=0.39,95%CI(0.29,0.49),P<0.000 01](图8)。
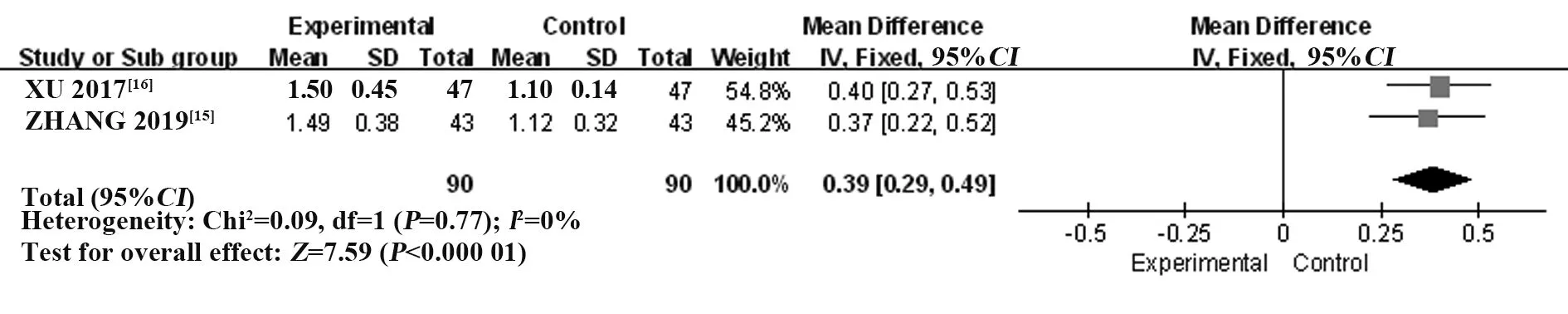
图8 T-614 组与HCQ 组治疗pSS 的唾液流率比较的Meta分析Fig.8 Meta-analysis of comparison of saliva flow rate between T-614 group and HCQ group in treatment of pSS
2.4.1 IgG 纳入11 个RCT[13,15-24],共864 例患者。采用随机效应模型进行Meta 分析,结果显示:与HCQ 组相比,T-614 组能够显著降低IgG 水平,差异有统计学意义[MD=-2.96,95%CI(-3.55,-2.37),P<0.000 01](图9)。
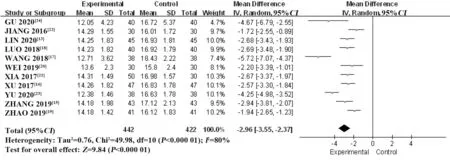
图9 T-614组与HCQ组治疗pSS的IgG比较的Meta分析Fig.9 Meta-analysis of comparison of IgG in treatment of pSS between T-614 group and HCQ group
2.4.2 ESR 纳入10 个RCT[13,15-23],共784 例患者。采用随机效应模型进行Meta 分析,结果显示:与HCQ 组相比,T-614 组能够显著降低ESR 水平,差异有统计学意义[MD=-5.67,95%CI(-8.02,-3.33),P<0.000 01](图10)。
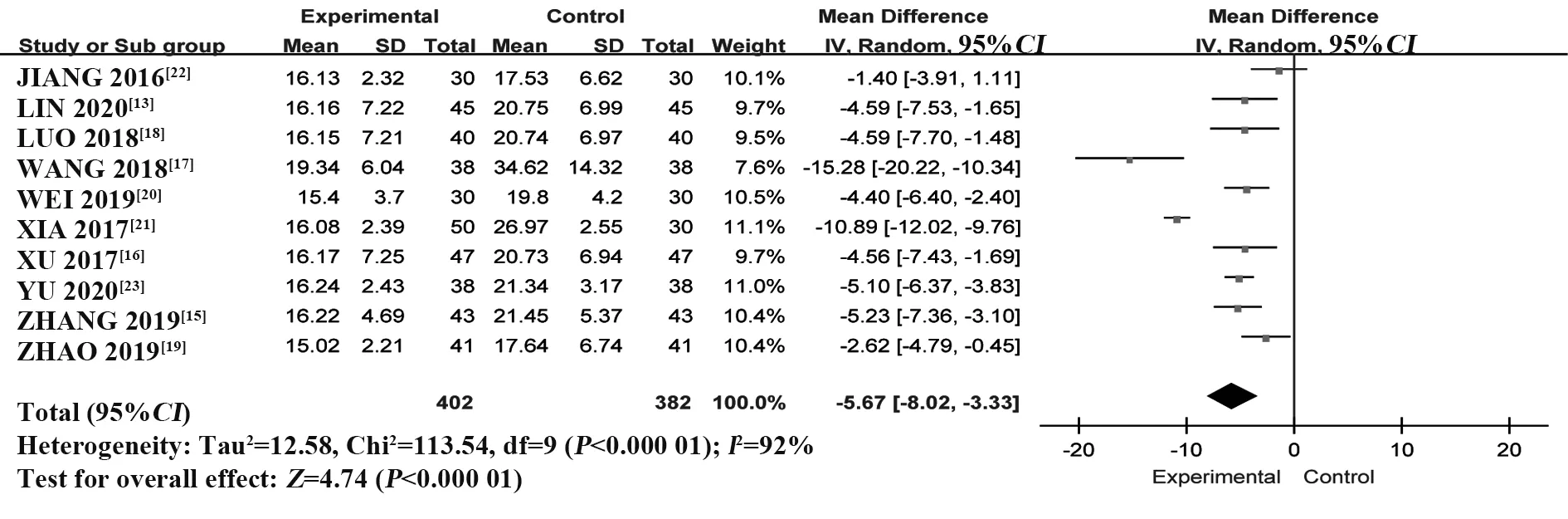
图10 T-614 组与HCQ 组治疗pSS 的ESR 比较的Meta分析Fig.10 Meta-analysis of ESR between T-614 group and HCQ group in treatment of pSS
2.4.3 RF 纳入10 个RCT[13,15-19,21-24],共804 例患者。采用随机效应模型进行Meta 分析,结果显示:与HCQ 组相比,T-614 组能够显著降低RF 水平,差异有统计学意义[MD=-4.53,95%CI(-5.80,-3.25),P<0.000 01](图11)。
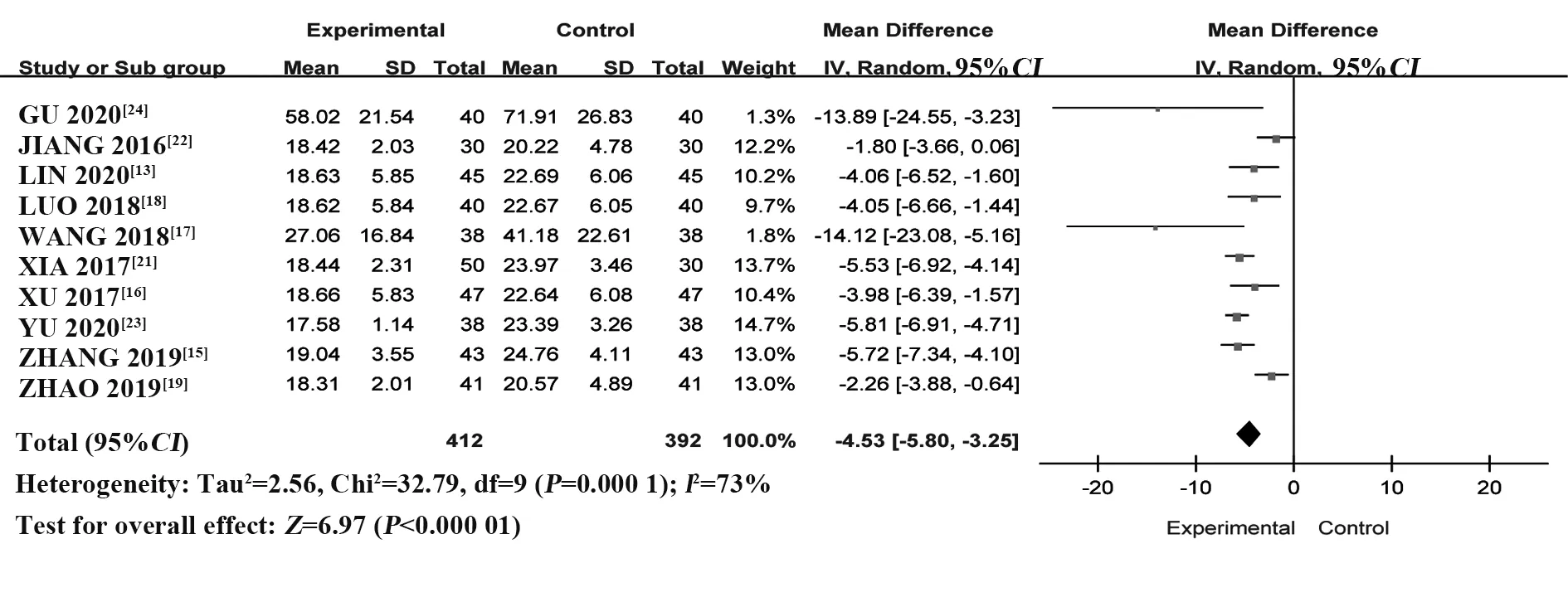
图11 T-614组与HCQ组治疗pSS的RF比较的Meta分析Fig.11 Meta-analysis of RF between T-614 group and HCQ group in treatment of pSS
2.4.4 PLT 纳 入5 个RCT[13,15-16,18,20],共410 例患者。采用随机效应模型进行Meta 分析,结果显示:与HCQ 组相比,T-614 组能够显著升高PLT,差异有统计学意义[MD=11.29,95%CI(7.53,15.06),P<0.000 01](图12)。
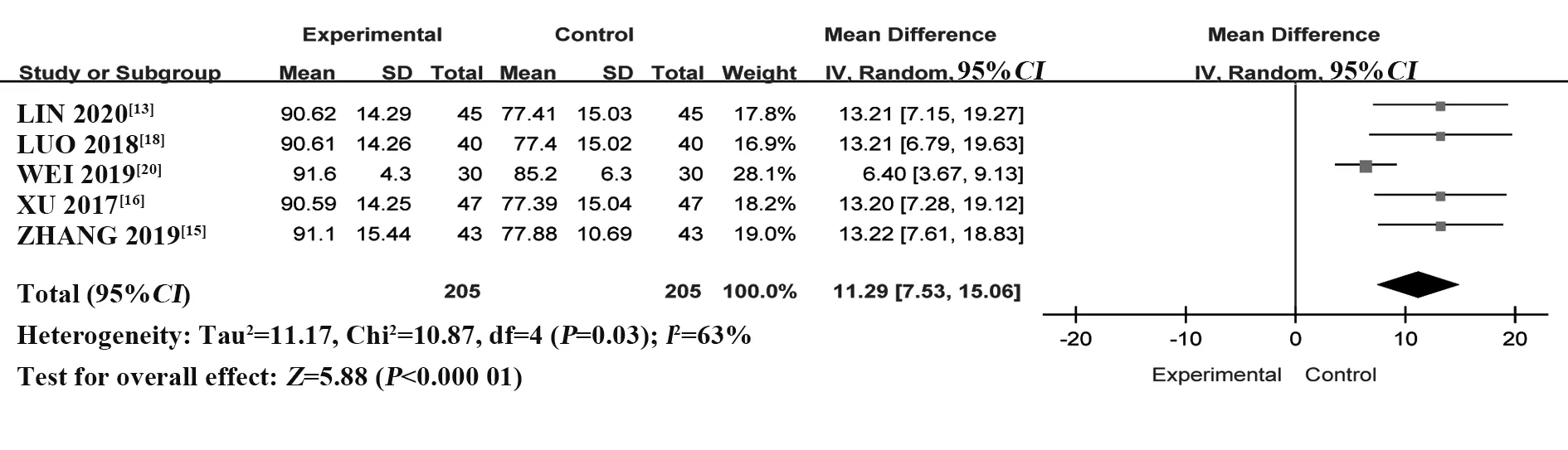
图12 T-614组与HCQ组治疗pSS的PLT比较的Meta分析Fig.12 Meta-analysis of PLT between T-614 group and HCQ group in treatment of pSS
2.4.5 CD19+CD27+B 细胞百分率纳入1 个RCT[15],共86例患者。采用固定效应模型进行Meta分析,结果显示:与HCQ 组相比,T-614 组能够显著降低CD19+CD27+B细胞百分率,差异有统计学意义[MD=-0.04,95%CI(-0.06,-0.02),P<0.000 1](图13)。
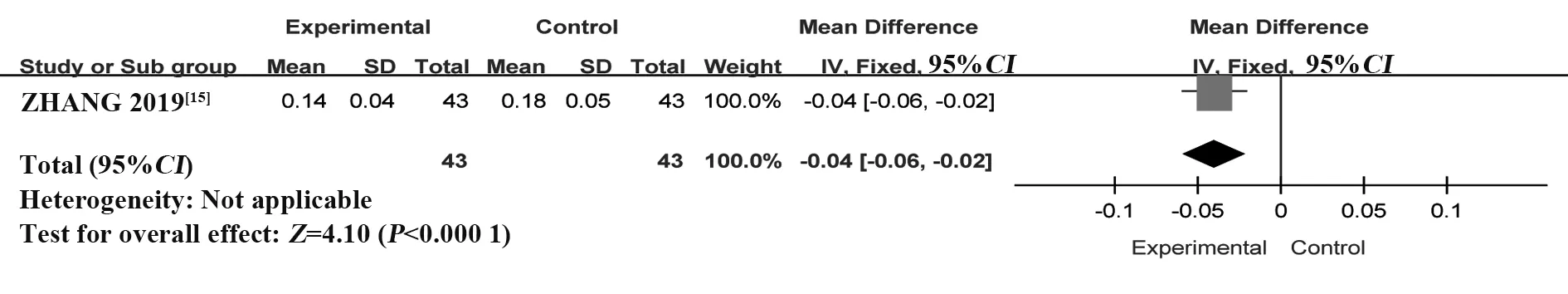
图13 T-614 组与HCQ 组治疗pSS 的CD19+CD27+B 细胞百分率比较的Meta分析Fig.13 Meta-analysis of CD19+CD27+B cells in treatment between T-614 group and HCQ group in treatment of pSS
2.4.6 抗心磷脂抗体(anticardiolipin antibody,ACL)纳入1 个RCT[24],共80 例患者。采用固定效应模型进行Meta分析,结果显示:与HCQ组相比,T-614组能够显著降低ACL,差异有统计学意义[MD=-0.33,95%CI(-0.50,-0.16),P<0.000 1](图14)。
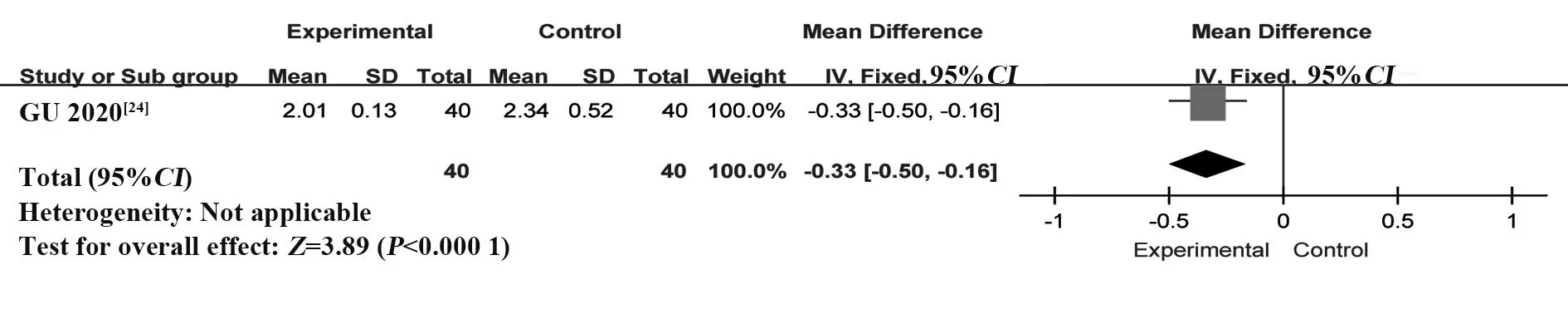
图14 T-614组HCQ组治疗pSS的ACL比较的Meta分析Fig.14 Meta-analysis of ACL between T-614 group and HCQ group in treatment of pSS
2.5 安全性评价
2.5.1 不良反应总发生率 T-614 治疗pSS 的常见不良反应包括胃肠道反应,白细胞减少;HCQ 治疗pSS 的常见不良反应包括胃肠道反应、心律失常、皮疹、眼毒性等,瘙痒、肝功能异常等较为少见;纳入8 个RCT[13,15-16,18-20,22,24],共632 例患者。采用固定效应模型进行Meta 分析,结果显示:T-614 组与HCQ组不良反应总发生率相比,差异无统计学意义[RR=0.69,95%CI(0.47,1.00),P=0.05](图15)。
2.5.2 各类型不良反应发生率 6 个RCT[13,15-16,18,20,24]报告了胃肠道反应发生率,共490 例患者。采用固定效应模型进行Meta 分析,结果显示:两组差异无统计学意义[RR=1.00,95%CI(0.51,1.95),P=1.00](表3)。8 个RCT[13,15-16,18-20,22,24]报告了皮疹发生率,共632 例患者。采用固定效应模型进行Meta 分析,结果显示:两组差异无统计学意义[RR=0.53,95%CI(0.24,1.17),P=0.12](表3)。7 个RCT[13,15-16,18-19,22,24]报告了瘙痒发生率,共572 例患者。采用固定效应模型进行Meta 分析,结果显示:两组差异无统计学意义[RR=0.62,95%CI(0.24,1.63),P=0.33](表3)。6 个RCT[13,15-16,18,20,24]报告了肝功能异常发生率,共490 例患者。采用固定效应模型进行Meta 分析,结果显示:两组差异无统计学意义[RR=0.42,95%CI(0.15,1.16),P=0.10](表3)。8 个RCT[13,15-16,18-20,22,24]报告了白细胞降低发生率,共632 例患者。采用固定效应模型进行Meta分析,结果显示:两组差异无统计学意义[RR=1.00,95%CI(0.40,2.50),P=1.00](表3)。
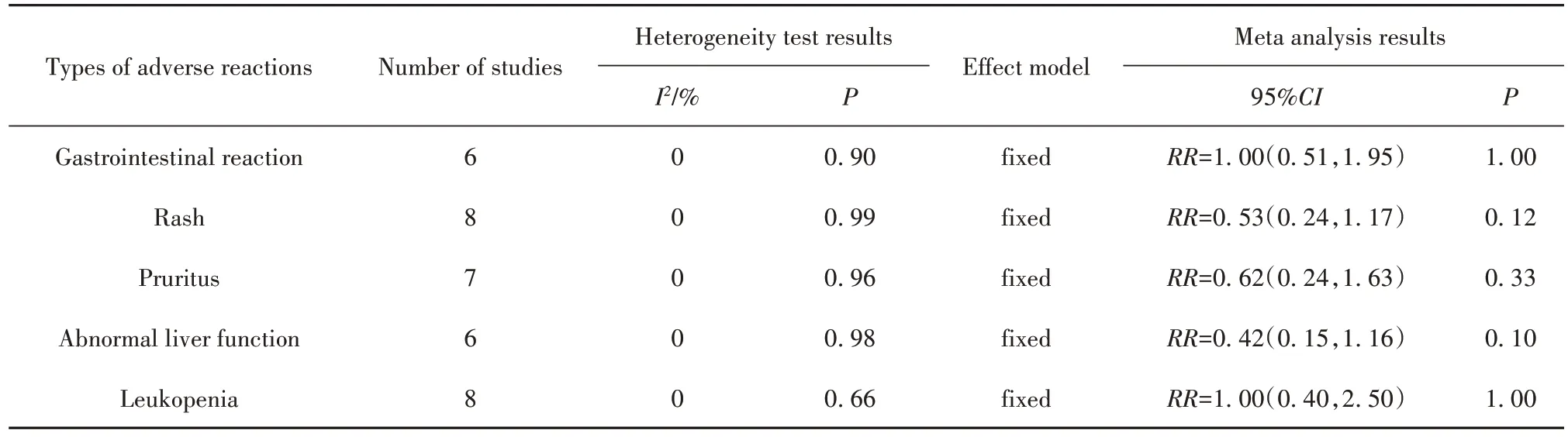
表3 T-614组与HCQ组治疗pSS的各类型不良反应的Meta分析结果Tab.3 Meta-analysis results of various types of adverse reactions in treatment of pSS between T-614 group and HCQ group
2.6 敏感性分析 结局指标中IgG、ESR 组I2值较高,表明存在统计学异质性,分别对其进行敏感性分析,采用逐篇剔除法,再进行合并分析,合并效应量及I2结果无明显变化,提示结果尚稳定。
2.7 发表偏倚 对T-614 组与HCQ 组比较临床总有效率指标绘制漏斗图进行发表偏倚检验,显示对称性较差,提示存在发表偏倚的可能性(图16)。
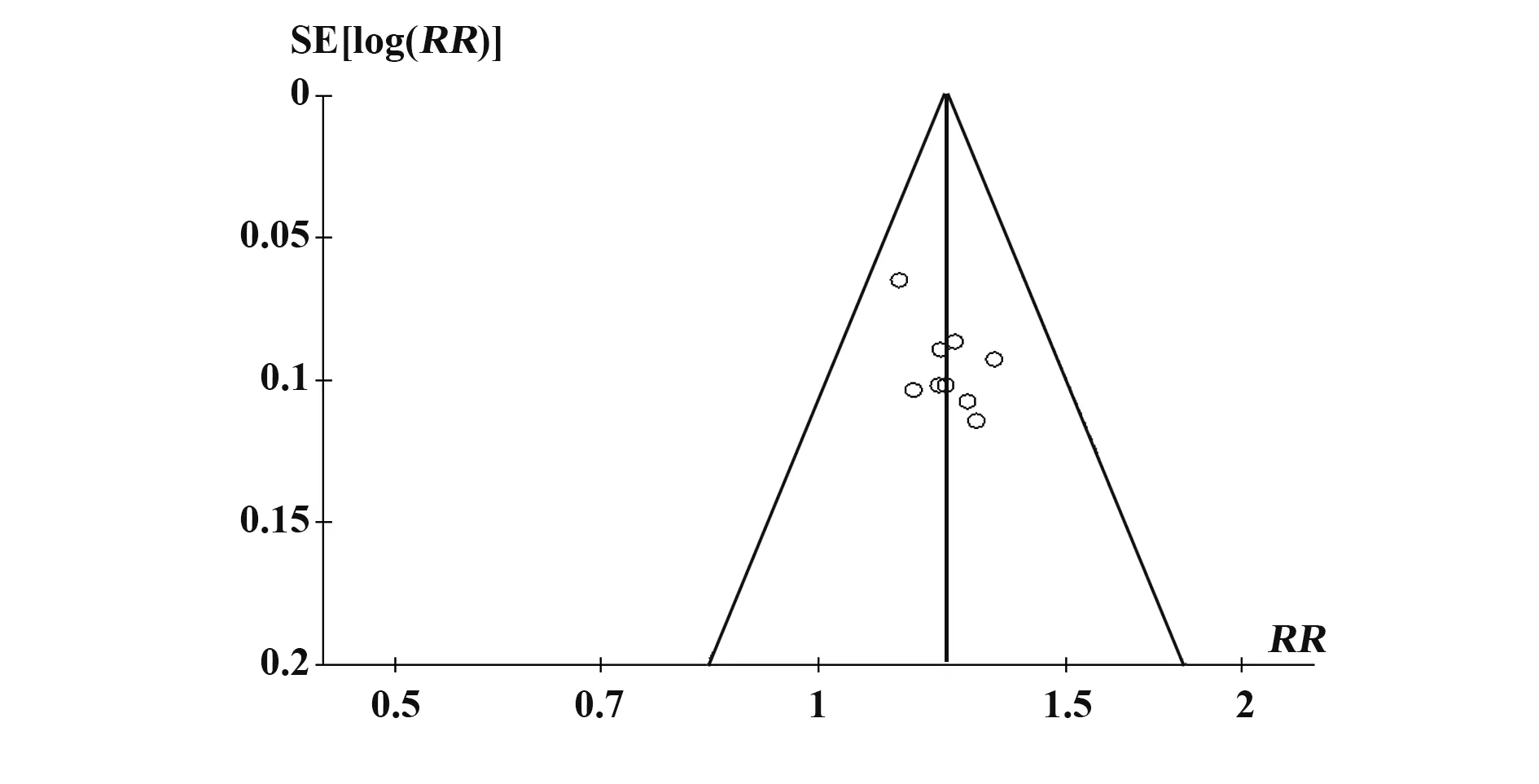
图16 针对T-614 组与HCQ 组治疗pSS 临床总有效率的漏斗图Fig.16 Funnel chart of total clinical effective rate in treatment of pSS between T-614 group and HCQ group
3 讨论
pSS 是一种复杂的异质性疾病,以外分泌腺的淋巴细胞浸润和炎症为主要特征,尤其是唾液腺和泪腺,表现为口腔和眼部干燥[25];此外,75%的pSS患者还会出现腺体外多器官系统受累,从紫癜、荨麻疹、炎症性关节炎和雷诺综合征等轻微症状,到更为严重的肾病、肺病和周围神经病变等,都可能出现[6,26]。多种复杂因素共同参与了pSS 的发病机制,包括环境、激素、基因表达和表观遗传学参与调控的免疫稳态,从而导致了上皮细胞失调、炎症和自身免疫反应[1,11]。pSS 的治疗包括减轻外分泌腺症状和改善系统症状的改善疾病抗风湿药物(DMARDs),分为局部治疗和全身治疗[27]。
T-614 是一种新型的DMARDs 药物,具有抗炎和免疫调节功能[9],2012 年在中国和日本批准用于治疗类风湿关节炎(rheumatoid arthritis,RA)[28],2014年亚太风湿病学会联盟(APLAR)会议的RA 指南中推荐可作为难治性RA 强化治疗的有效选择[10];特别是对于MTX、HCQ 等常用DMARDs 药物以及托珠单抗等生物制剂临床应答不充分的患者,均有显著疗效[29-30]。现在广泛用于治疗自身免疫性疾病和改善相关的炎症,如干燥综合征、IgG4 相关性疾病、狼疮性肾炎等[11-12]。与HCQ 相比,T-614 治疗pSS 的有效性及安全性如何,还未得到共识,因此,本研究系统评价两种药物治疗pSS 的优劣。目前ESSDAI 和ESSPRI 评分是常用的评价SS 疾病活动度和患者主观症状评分的评价标准,两者常配合应用,已经成为广泛量化SS 疾病活动的指标[11]。Schirmeri 试验、唾液流率是诊断pSS 有力的泪腺和唾液腺证据之一,也是评价治疗效果的有效指标。本研究结果显示:T-614 组的临床总有效率明显高于HCQ 组,且在改善ESSDAI 和ESSPRI 评分以及泪腺、唾液腺功能方面也明显优于HCQ 组,这说明T-614 联合甲泼尼龙在治疗疗效、改善临床症状方面明显优于HCQ联合甲泼尼龙。这可能与T-614通过有效抑制腺体胆碱酯酶活性,促进唾液和泪液的分泌,从而改善临床症状有关[23]。
pSS 患者中免疫球蛋白均明显升高,目前认为以IgG 升高为主,且与疾病活动度呈正相关[31]。另外,邵体红等[32]发现RF 高滴度阳性的pSS患者易出现腺体外脏器受累,且炎症指标及抗体水平均较高。本研究结果显示:经过规范化治疗,与HCQ 组相比,T-614组能够有效降低与pSS疾病活动度有关的IgG、ESR 和RF 的水平。对于PLT 减少的pSS 患者,T-614 组PLT 升高水平明显高于HCQ 组;同时对于ACL升高的pSS患者,T-614组降低ACL的水平明显优于HCQ 组。以上证据表明,T-614 联合甲泼尼龙能够更有效地降低pSS 疾病活动度,改善患者的临床症状,可能是更好的治疗药物。
B 细胞过度活跃是pSS 的关键致病因素,主要特征是泪腺和唾液腺异位生发中心的形成,因此,降低B 细胞活性、抑制免疫球蛋白的产生成为了治疗的关键[1,33]。研究表明,T-614 不仅抑制T 细胞增殖,而且还通过激活PKC/EGR1 通路,抑制RA 患者体内的抗体分泌细胞(ASC)分化,从而调节B 细胞分化的免疫反应,达到缓解临床症状[34]。但T-614在pSS 患者治疗中是否能够通过抑制B 细胞的活性而发挥作用,目前尚无确定研究。本研究仅有一篇文献针对治疗前后CD19+CD27+B 细胞百分率进行了比较,结果显示:与HCQ 组相比,T-614 组能够显著降低CD19+CD27+B细胞百分率,这支持了前面的观点,希望未来能够得到更多的验证。
T-614 常见不良反应包括胃肠道反应、转氨酶升高、白细胞减少等;HCQ 常见不良反应包括胃肠道反应、心律失常、皮疹、眼毒性等,瘙痒、肝功能异常等较为少见;本研究结果显示:T-614组与HCQ 组不良反应发生率方面,无明显差异。这表明T-614治疗pSS 的安全性与HCQ 相当,可成为治疗pSS 的优先推荐药物。
本研究的局限性:①纳入的RCT 整体质量不高,大多未描述具体的随机方法、随机分配的隐藏和具体的盲法实施方法,可能存在偏倚风险,影响研究结论的可信度;②纳入文献全部为中文文献,无英文文献纳入,未对其他语种及灰色文献进行检索,可能存在潜在的语言偏倚;③纳入RCT 的样本量相对较小,部分结局指标仅纳入1个RCT,检验效能可能不足。
总之,当前有限证据显示,T-614 联合甲泼尼龙治疗pSS 的疗效高于HCQ 联合甲泼尼龙,两者治疗的安全性相当。由于本研究受到纳入文献的数量和质量影响,结论可能存在一定的局限性,仍需大量高质量的研究加以证实。
