双氢青蒿素通过抑制HMGB2 表达及逆转EMT 进程抑制肝癌细胞生长及侵袭①
2022-03-23杨晨雪魏雁虹魏海峰米旭光杨广民长春中医药大学长春130021
杨晨雪 魏雁虹 魏海峰 米旭光 宋 帅 李 明 耿 辉 杨广民(长春中医药大学,长春 130021)
原发性肝癌是临床最常见的消化系统恶性肿瘤之一,全球发病率逐年上升[1-2]。与其他恶性肿瘤细胞相比,肝癌细胞具有更强的侵袭及迁移能力,因此具有起病隐匿、进展迅速等特点[3]。患者出现症状就诊时往往已处于晚期而错过最佳手术时机,导致肝癌患者预后和生存率均不理想。研究证实,高迁移率族蛋白2(high mobility group box 2,HMGB2)在肝癌细胞中表达增加,其高表达可促进肝细胞癌(hepatocellular carcinoma,HCC)细胞增殖,提高其侵袭能力[4]。新近研究表明,HMGB2 还可能是一种新型上皮-间质转化(epithelial-mesenchymal transformation,EMT)介导物[5]。EMT 过程使肿瘤细胞获得较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力,与肿瘤转移和复发密切相关[6]。逆转这一过程是抗肿瘤新药筛选的目标之一。双氢青蒿素(dihydroartemisinin,DHA)分子式为C15H24O5,分子量为284.35,为含过氧化基团的倍半萜内酯化合物,是1973年屠呦呦为鉴定青蒿素化学结构中具有羰基而创制的第一个青蒿素还原衍生物,随着研究不断深入,发现其不仅具有抗疟活性,还具有抗炎、抗肿瘤、抗肺纤维化等作用,甚至具有调节免疫抗肿瘤作用,在抗肿瘤复发方面亦显示出较好的应用前景,但对其抗肿瘤作用机制尚缺乏系统研究[7]。本文通过体外实验观察DHA 对肝癌细胞生长及迁移、侵袭的抑制作用,并从DHA 对HMGB2 表达及EMT 进程影响的角度分析其抗肿瘤作用机制,为临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人肝癌细胞株HepG2 由吉林省人民医院中心实验室提供;人肝癌细胞株LM3(WHELAB C1010)购自上海盈湾生物科技有限公司。
1.1.2 药品与试剂 DHA 购自北京索莱宝科技有限公司;顺铂购自江苏豪森药业股份有限公司;高糖培养基DMEM 购自德国BRAND 公司;胎牛血清(FBS)购自美国CLARK公司;青霉素-链霉素双抗购自美国Gibco 公司;甲基噻唑蓝(MTT)购自美国Sigma 公司;细胞凋亡试剂盒、RIPA 裂解液均购自上海碧云天生物技术有限公司;Transwell 小室购自Corning公司;一抗与二抗均购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养 HepG2 和LM3 细胞均采用含10%FBS 及1%青霉素链霉素双抗的DMEM 培养基于37℃、5%CO2孵育,当细胞达到80%~100%融合时消化传代,选取对数生长期细胞进行后续实验。
1.2.2 MTT 检测细胞存活率 取对数增长期HepG2 细胞株制备细胞悬液,采用完全培养基将细胞浓度稀释为10×105个/ml,接种于96孔板,100µl/孔,继续培养24 h 至细胞完全贴壁,分别加入0、2.5、5、10、20、40µg/ml 顺铂溶液处理24 h、48 h、72 h,检测不同浓度顺铂在不同时间对HepG2 细胞存活率的影响。按照同样方法,采用0、20、40、80、160、320 mmol/L DHA 处理HepG2 细胞24 h、48 h、72 h,检测不同浓度DHA 在不同时间对HepG2 细胞存活率的影响。同理,采用0、40、80、160、320、640µg/ml顺铂溶液处理LM3 细胞24 h、48 h、72 h,检测不同浓度顺铂在不同时间对LM3 细胞存活率的影响,以及采用0、40、80、160、320、640 mmol/L DHA 处理LM3 细胞24 h、48 h、72 h,检测不同浓度DHA 在不同时间对LM3 细胞存活率的影响。以上实验每组均设5 个复孔,24 h 后加入MTT(20µl/孔),4 h 后弃培养基,100 µl/孔加入DMSO,振荡混匀5 min 后酶标自动分析仪测定490 nm处吸光度。
1.2.3 划痕实验 取对数生长期HepG2 细胞接种于6 孔板,24 h 后细胞融合度达100%时,用枪头小侧划破细胞中轴,分别加入含2.5 µg/ml 顺铂和20 µmol/L DHA 的无血清DMEM 培养基,并设置阴性对照组。同理,用含40 µg/ml 顺铂和40 µmol/L DHA的无血清DMEM 培养基处理LM3细胞,并设置阴性对照组。以上实验每组设2个重复。0 h、24 h、48 h、72 h时显微镜拍摄划痕愈合程度。
1.2.4 侵袭实验 采用含5%FBS的DMEM 培养基将HepG2细胞制成1×105个/ml细胞悬液,各Transwell小室上层加入100µl 细胞悬液,小室下室分别加入含2.5 µg/ml 顺铂、20 µmol/L DHA 的含10%FBS 的DMEM 培养基500µl,并设立阴性对照。同理用含5%FBS的DMEM培养基将LM3细胞制成1×105个/ml细胞悬液,各Transwell 小室上层加入100µl 细胞悬液,小室下室加入含40 µg/ml 顺铂、40 µmol/L DHA的含10%FBS 的DMEM 培养基500 µl,并设立阴性对照。培养48 h 后进行苏木精、伊红染色,显微镜拍照计数。
1.2.5 流式细胞术检测细胞凋亡率 取对数生长期HepG2细胞接种于6孔板,24 h后分别加入含10、20 µg/ml 顺铂、80、160 µmol/L DHA 的完全培养基,并设置阴性对照组。同理,采用含40、80µg/ml顺铂和80、160 µmol/L DHA 的完全培养基处理LM3 细胞,并设置阴性对照组。24 h 后PBS 洗涤2 次,采用不含EDTA 的胰酶消化,收集细胞,Annexin V/PI双染色法通过流式细胞仪检测细胞凋亡率。
1.2.6 Western blot 取对数生长期HepG2 和LM3细胞制成细胞悬液,并分为两组,HepG2 细胞组采用2.5 µg/ml 顺铂处理以及20 µmol/L DHA 处理;LM3 细胞组采用40 µg/ml 顺铂处理以及40 µmol/L DHA 处理。48 h 后将上述细胞加入适量蛋白裂解液(RIPA∶PMSF=100∶1)提取细胞总蛋白,BCA 法测定蛋白浓度,进行SDA-PAGE 电泳,转至PVDF 膜,5%脱脂牛奶封闭,分别加入Caspase-3、Cleavedcaspase3、Bax、Bcl-2、HMGB2、E-cadherin、N-cadherin、Vimentin一抗(1∶1 000)4℃孵育过夜,第2天用辣根过氧化物酶标记的二抗室温孵育2 h,显影仪显影,分析。
1.3 统计学分析 采用GraphPad Prism 5.0 软件进行统计学分析,计量资料采用表示,两组间连续变量比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 DHA 对肝癌细胞存活率的影响 MTT 检测结果显示,随着顺铂以及DHA 药物浓度提高,与阴性对照组相比,顺铂组以及DHA 组细胞存活率显著降低(P<0.05,图1A)。HepG2细胞在2.5µg/ml顺铂、20µmol/L DHA及LM3细胞在40µg/ml 顺铂、40µmol/L DHA 同一药物浓度作用时,培养24 h、48 h、72 h,随着时间增加细胞存活率显著降低(P<0.05,图1B)。
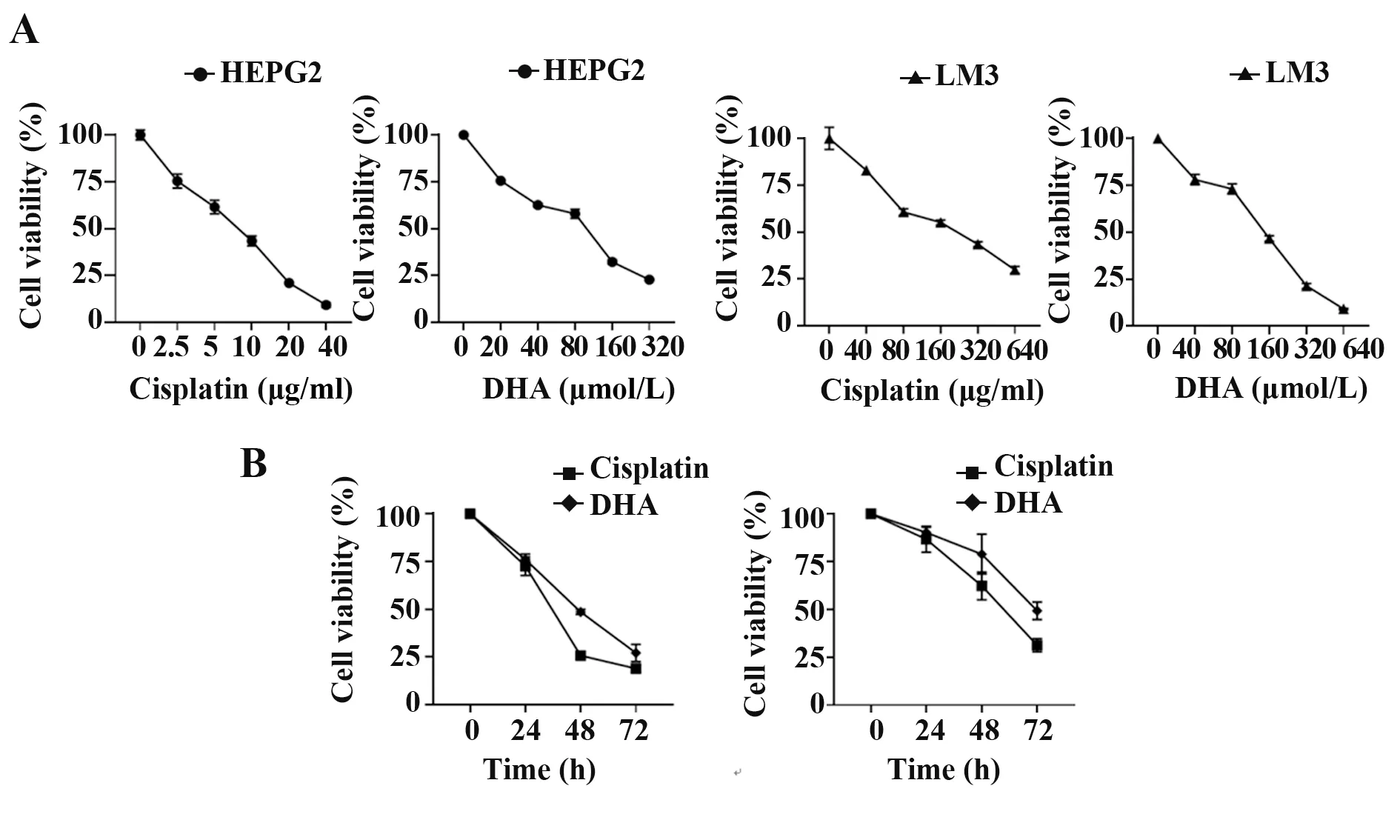
图1 DHA对HepG2和LM3细胞存活率的影响Fig.1 Effects of DHA on survival rate of HepG2 and LM3 cells
2.2 DHA 对肝癌细胞迁移能力的影响 与阴性对照组相比,顺铂及DHA 处理的两组细胞24 h 时HepG2 细胞和LM3 细胞迁移率明显降低,48 h、72 h时,两组细胞划痕愈合率显著降低(P<0.05 或P<0.01,图2)。
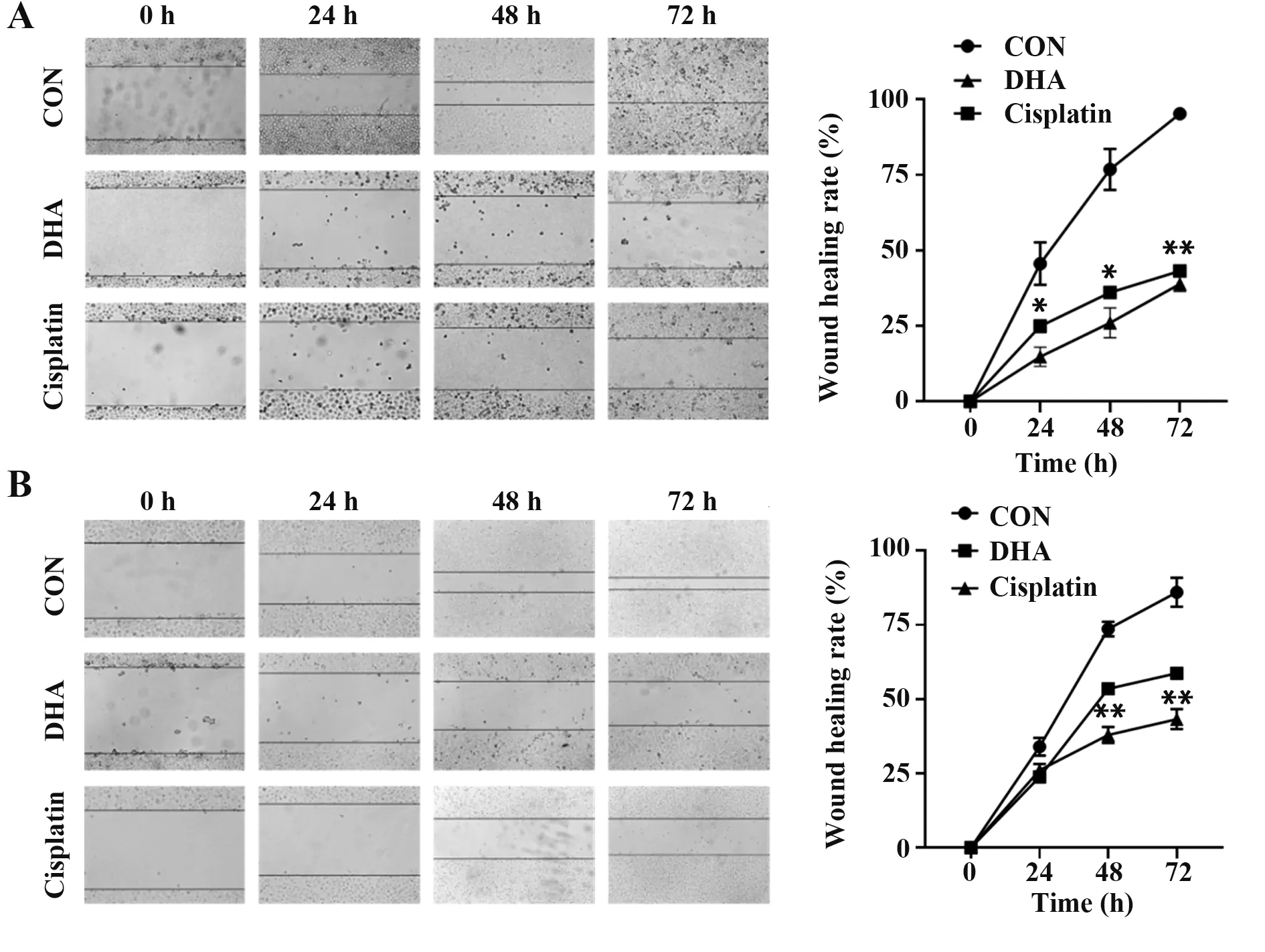
图2 DHA对HepG2和LM3细胞迁移的影响Fig.2 Effects of DHA on migration of HepG2 and LM3 cells
2.3 DHA 对肝癌细胞侵袭能力的影响 Transwell侵袭实验结果显示,两种肝癌细胞经过顺铂以及DHA 处理后,侵入小室的肿瘤细胞数明显少于阴性对照组(P<0.001,图3)。
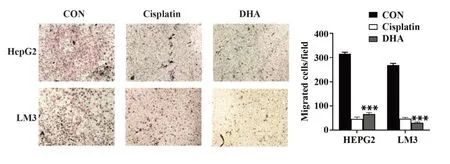
图3 DHA对HepG2和LM3细胞侵袭的影响Fig.3 Effects of DHA on invasion of HepG2 and LM3 cells
2.4 DHA 对肝癌细胞凋亡及凋亡相关蛋白表达的影响 与对照组(0.03%)相比,随着顺铂和DHA药物浓度增加,肝癌细胞凋亡率逐渐提高。80、160µmol/L DHA 作用于HepG2 细胞24 h 后,凋亡率分别为5.84%和81.26%(P<0.05),80、160 µmol/L DHA 作用于LM3 细胞24 h 后,凋亡率分别为7.61%和24.70%(P<0.05,图4)。Western blot 结果显示,与阴性对照组相比,两种肝癌细胞经过顺铂和DHA作用48 h 后,Cleaved-caspase3、Bax 表达明显增加,Bcl-2表达显著降低(P<0.05,图5)。
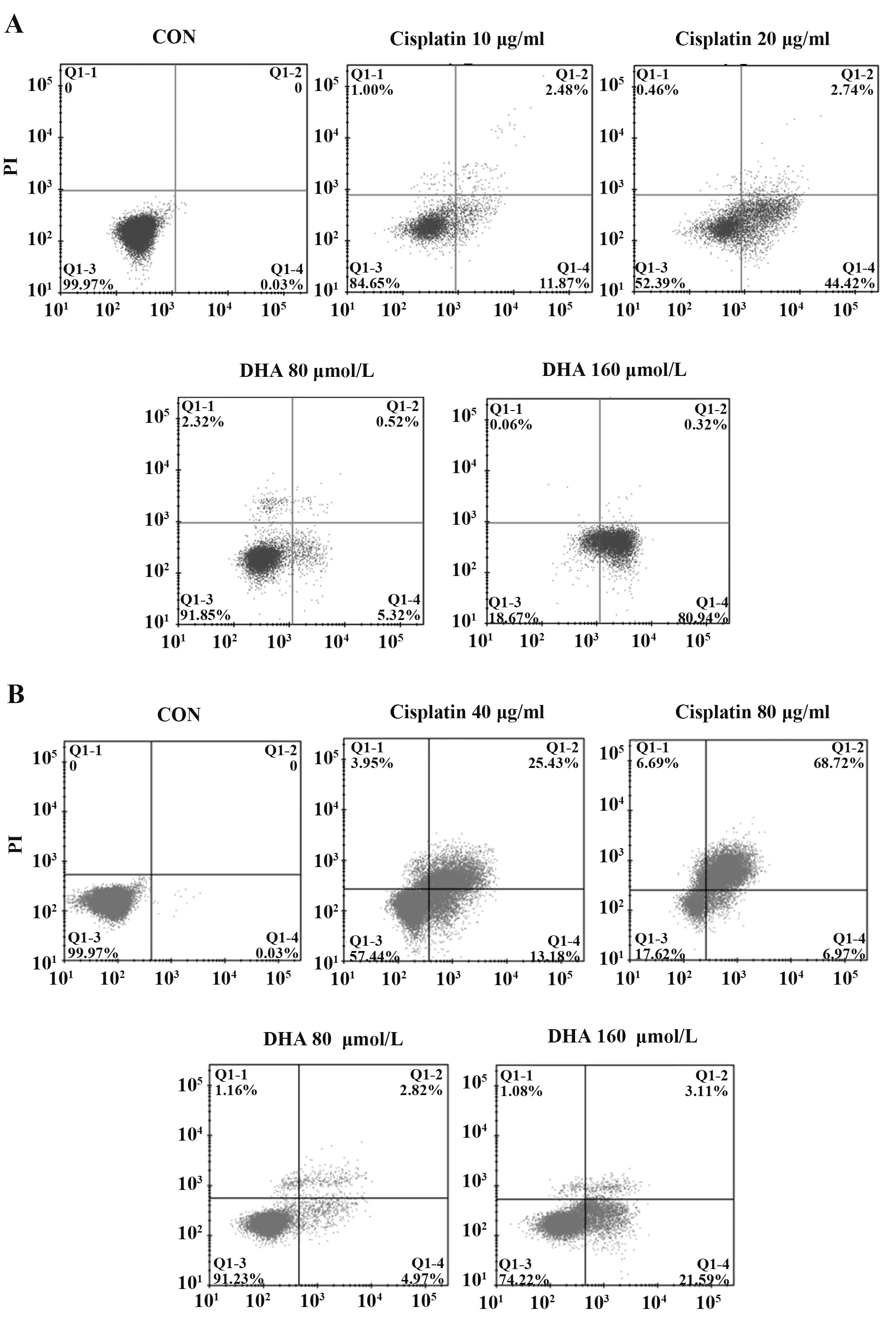
图4 DHA对HepG2和LM3细胞凋亡的影响Fig.4 Effects of DHA on apoptosis of HepG2 and LM3 cells
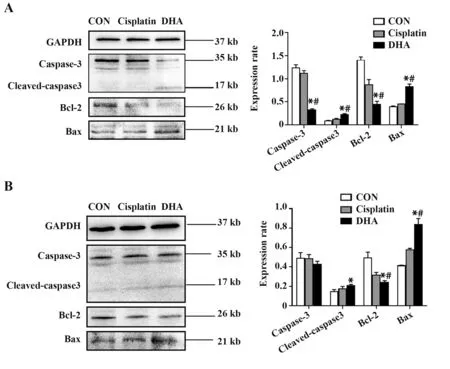
图5 DHA 对HepG2 和LM3 细 胞Caspase-3、Cleavedcaspase3、Bax及Bcl-2蛋白表达的影响Fig.5 Effects of DHA on expressions of Caspase-3,Cleaved-caspase3,Bax and Bcl-2 proteins in HepG2 and LM3 cells
2.5 DHA 对HMGB2 以及EMT 相关蛋白表达的影响 Western blot结果显示,DHA 可显著抑制肝癌细胞HMGB2 表达(P<0.05),且在两种肝癌细胞实验中均发现,与阴性对照组相比,DHA 处理组、顺铂组E-cadherin表达增加,而N-cadherin、Vimentin 表达降低(P<0.05,图6)。
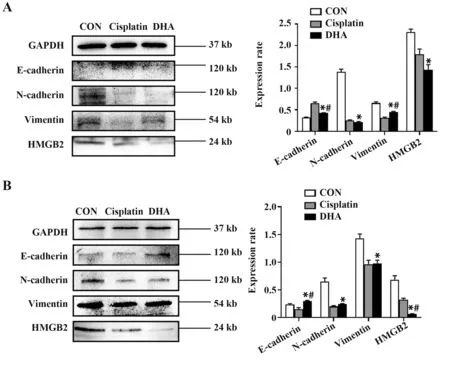
图6 DHA 对HepG2 和LM3 细 胞HMGB2 及EMT 相 关蛋白表达的影响Fig.6 Effects of DHA on expressions of HMGB2 and EMT related proteins in HepG2 and LM3 cells
3 讨论
原发性肝癌治疗过程中化疗药物有效率低、不良反应大,导致肝癌患者预后较差,远期疗效不尽如人意。尤其是常用的铂类化疗药物易产生耐药性,且不能特异性针对肿瘤细胞,对自身正常细胞有较大危害,因此急需探索一种对人体伤害较小的新型药物[8]。DHA在多种肿瘤研究中被证实具有抗肿瘤作用或与其他化疗药物一起产生协同增效作用[9-10]。本研究通过体外实验,采用不同浓度DHA 作用于HepG2 和LM3 两种不同人肝癌细胞,24~72 h 后观察DHA 对肝癌细胞增殖的抑制作用,结果发现DHA 可显著抑制肝癌细胞生长,且DHA 剂量越大、作用时间越长,肝癌细胞存活率越低,且呈时间-剂量依赖性。常规化疗药物顺铂在两种不同肝癌细胞中显示出不同抗肿瘤作用,对于高转移潜能的肝癌LM3细胞,需要更大剂量才能发挥杀伤作用(HepG2和LM3 细胞IC50分别为13.79 及336.12 µg/ml),这种选择性抗肿瘤作用可以解释为什么临床使用相同含铂化疗方案但不同患者间疗效不尽相同。肿瘤在个体间的异质性决定部分肝癌患者可能需要更大的顺铂剂量才能达到治疗效果,而在实际临床应用中,高剂量化疗药物同样会带来巨大副作用和不良反应,一直是肿瘤治疗的难点。而本研究发现,DHA 不仅与一定剂量的顺铂化疗药物具有相同功效的抗肿瘤作用,且对两种不同类型肝癌细胞的生长抑制作用差异不大(HepG2 和LM3 细胞IC50分别为143.89 及242.12µmol/L),显示出较好的临床应用前景。
为探究DHA 抑制肝癌细胞生长的原因,本研究通过流式细胞技术和Western blot 实验发现,DHA可促进肝癌细胞凋亡,并促进肝癌细胞凋亡相关蛋白Cleaved-caspase3、Bax 表达,Bcl-2 表达降低,且DHA 对HepG2 细胞凋亡的影响与剂量联系密切,20µmol/L DHA 作用于HepG2 细胞24 h 时细胞凋亡率为5.09%,与对照组(0.03%)差异有统计学意义(P<0.05),浓度为40 µmol/L 时细胞凋亡率为5.44%,80 µmol/L DHA 时细胞凋亡率为5.84%,而160 µmol/L 时细胞凋亡率则达到81.26%,说明DHA 对肝癌细胞凋亡的影响在一定浓度范围内作用区别不大,但DHA 在更高浓度后对肝癌细胞HepG2 的影响显著提高,但对LM3 细胞却无此趋势,可能是肿瘤细胞异质性导致药物作用效果不同。当然,由于药物吸收利用度的关系,体内外实验存在巨大差别,对于成药可能性而言,160µmol/L有效药物浓度过大,尚无法有力说明其有多显著的抗肿瘤作用,有待后续通过动物实验进一步研究。
此外,本研究通过划痕及侵袭实验验证了DHA对肝癌细胞侵袭及转移的影响,结果显示,DHA 处理后肝癌细胞迁移及侵袭能力显著降低,提示DHA可有效对抗肝癌复发和转移。同时发现,与对照组相比,DHA 处理组HMGB2 表达明显降低,说明HMGB2 可能是DHA 抑制肝癌细胞增殖、侵袭及迁移的靶点。近年人们发现HMGB2 在胃癌、胶质母细胞瘤和胰腺癌中高表达,是一种可在炎症反应、细胞分化、细胞迁移与侵袭中发挥重要作用的细胞外信号分子[11]。LI 等[12]敲除胃癌细胞MALAT1 发现,HMGB2 表达显著降低,细胞增殖及侵袭能力减弱;WU 等[13]通过对敲低HMGB2 的3 种胶质母细胞瘤细胞进行检测后发现,3 种细胞迁移和侵袭能力均不同程度减弱,且侵袭相关标志物p53、MMP2 和TIMP2 表达减少;CAI 等[14]构建了抑制HMGB2 表达的胰腺癌细胞系后发现,糖酵解相关蛋白GLUT1、HK2 和LDHA mRNA 表达相对阴性对照组明显降低,说明HMGB2 可促进胰腺癌细胞糖酵解和增殖。刘爱蕙等[15]通过靶向沉默乳腺癌细胞HMGB2 表达,实验组较空白对照组侵袭癌细胞数明显减少,提示HMGB2 与癌细胞增殖及侵袭相关。高迁移率族蛋白广泛分布于真核生物的单核巨噬细胞核,属于免疫性非组蛋白,既往研究表明其与过敏性紫癜、类风湿关节炎、系统性红斑狼疮等免疫性疾病密切相关。HMGB2是一种炎症诱导因子,通过诱导肿瘤细胞炎症因子持续产生形成慢性炎症状态,促进免疫抑制微环境形成。DHA 具有免疫调节作用,可能通过调节HMGB2 表达干扰肿瘤免疫微环境,可能是DHA 与其他化疗药物协同增效作用的机制之一,值得深入研究。
EMT 是上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,在癌症转移过程中发挥重要作用。为进一步探讨DHA 抑制肝癌细胞迁移及侵袭能力的机制,本研究观察了DHA 对肝癌细胞EMT进程的影响,结果发现DHA处理后的肝癌细胞E-cadherin 表达显著增加,N-cadherin、Vimentin 表达明显减少,可有效逆转肝癌EMT 进程。且本研究发现顺铂对肝癌细胞EMT 进程同样具有一定抑制作用,类似的研究结果也有报道。如王绩英等[16]发现肺癌A549细胞中顺铂单独使用可抑制A549细胞增殖,减弱A549 细胞迁移侵袭运动能力,同时上调E-cadherin mRNA 及蛋白表达。钱亚云等[17]发现人肝癌细胞HepG2 中顺铂可抑制肝癌细胞增殖,缩短迁移距离,降低N-cadherin、Vimentin表达,同时增加E-cadherin蛋白表达。但长期大量应用顺铂导致肿瘤细胞耐药后,顺铂反而会加速EMT进程。如杨丞等[18]研究表明,长时间顺铂诱导的宫颈癌耐药细胞株发生了EMT,可以解释顺铂在初期应用时疗效很好,但一旦发生耐药,肿瘤复发和转移依旧不可避免,因此抗肿瘤中药和顺铂联用就显得非常必要。
近年研究中,NAVID等[5]用HSP90抑制剂处理黑色素瘤细胞后发现,HSP90 抑制剂可通过EMT 相关NF-κB信号通路调节HMGB2表达,提示HMGB2表达与黑色素瘤细胞发生EMT 密切相关。YUAN 等[19]发现丹参酮可抑制胃癌细胞EMT 进程,HMGB2 高表达可促发胃癌细胞EMT。HAN 等[20]发现HMGB2在结直肠癌中过表达,沉默长链非编码RNACRCMSL可释放HMGB2,并将其重新定位于细胞核与Oct4结合,进而上调结直肠癌细胞EMT 相关基因表达,故可通过促进结直肠癌细胞HMGB2 表达促发EMT。提示HMGB2可能是EMT的上游靶点。
综上所述,DHA 可抑制肝癌细胞存活,并通过激活Caspase-3 诱导肝癌细胞凋亡,并通过下调HMGB2 表达抑制EMT 发生,从而阻碍肝癌细胞侵袭及迁移,在抗肝癌治疗及控制肝癌复发转移方面显示出巨大潜力。DHA 对肝癌作用的其他机制、体内作用情况如何以及治疗剂量下的毒副作用仍需进一步研究。
