康柏西普对增生性糖尿病视网膜病变患者氧化应激水平和炎症因子浓度的影响
2022-03-23黄玥李旌张茜沈碧波郑岩
黄玥 李旌 张茜 沈碧波 郑岩
在糖尿病患者中,约有30%的人合并糖尿病视网膜病变(diabetic retinopathy DR)[1]。炎症反应、氧化压力的升高和糖化蛋白的累积互相影响,是DR早期的重要病变机制。有证据表明在DR患者的房水中,白介素-6(interleukin-6,IL-6)和人单核细胞趋化蛋白-1(human monocyte chemoattractant protein-1,MCP-1)等的浓度显著高于患糖尿病但是没有视网膜临床表现的病人,而后者又明显高于正常血糖的对照组[2]。
增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)最主要的标志是新生血管的形成[3,4],而高血糖引起的血管内皮生长因子(vascular endothelial growth factor VEGF)的上调是新生血管发生的主要原因[5]。高血糖引起的 VEGF的上调和一系列的炎性因子之间复杂的相互作用被认为是PDR发展中的重要作用机制[6]。有实验表明抗VEGF治疗可以减少白细胞浸润,促进血管收缩,加速血管成熟,因此从这个角度来说抗VEGF治疗同时也有抗炎作用[7]。
玻璃体腔注射抗VEGF药物目前已经成为治疗 PDR的重要手段[8]。那么抗VEGF治疗会对PDR患者视网膜内的炎症和氧化压力微环境带来一些什么样的变化呢?在本文中,我们将观察PDR患者,在玻璃体腔注射抗VEGF 药前后,房水中炎症细胞因子VEGF、IL-6、MCP-1水平以及氧化应激指标丙二醛(malondialdehyde,MDA)水平的变化和他们之间的相关性,来进一步探讨PDR的发生发展机制。
资料与方法
一、对象
1.选取2016年3月至2017年11月在新华医院眼科行玻璃体腔注射康柏西普药,并行玻璃体切除术的PDR患者共74例(75只眼)入组,其中男性35例,女性39例,年龄(54.1±13.6)岁。
2.纳入标准:糖尿病的诊断标准符合1999年世界卫生组织(World Health Organization,WHO)糖尿病诊断及分类标准,均为2型糖尿病,病程≥5年,<18年;PDR的诊断按照2002年悉尼国际临床分级标准。
3.排除标准:有其他严重的心脏、肝、肾等全身疾病史者;有青光眼、葡萄膜炎等其他眼部疾病病史者;以前有过视网膜激光、玻璃体注射药物史,眼部手术史者。
二、方法
前瞻性临床研究。纳入研究的每例患者均常规检查裸眼视力、矫正视力、眼压、裂隙灯显微镜、眼部B型超声、散瞳行检眼镜、眼底照相等检查。纳入研究的所有患者均被确诊为PDR,并需要进行玻璃体腔注射抗VEGF药物治疗和玻璃体切除术治疗。
1.操作过程:(1)患者于注射前3 d使用左氧氟沙星滴眼液点眼,4次/d。3 d后,在新华医院手术室行玻璃体腔注射。(2)术前0.5%奥布卡因滴眼,常规消毒铺巾,0.5%聚维酮碘溶液冲洗结膜囊,固定眼球,在角膜缘内1 mm进行前房穿刺,吸取未经稀释的房水50~100 μl。然后距角膜缘3.5 mm的睫状体平坦部垂直进针,单次注射0.5 mg康柏西普,注射完后,妥布霉素地塞米松眼药膏涂眼包扎。收集的房水立即放入-80 ℃的低温冰箱保存。 (3)各研究对象在玻璃体腔注射抗VEGF药后7 d,在新华医院仍由同一位资深医生行玻璃体切除术,术前0.5%奥布卡因滴眼,常规消毒铺巾,0.5%聚维酮碘溶液冲洗结膜囊,固定眼球,在角膜缘内1 mm进行前房穿刺,吸取未经稀释的房水50~100 μl,取样后常规行玻璃体切除术。收集的房水立即放入-80 ℃的低温冰箱保存。
三、MDA定量
1.使用Abcam公司的Lipid Peroxidation (MDA) Assay kit试剂盒(货号ab118970)进行检测。实验原理为硫代巴比妥酸(thiobarbituric acid,TBA)与MDA的加成物MDA-TBA在OD 532 nm波长激发光下有最大吸光度,可通过检测OD 532 nm波长激发光吸光度值进行定量检测。
2.按照试剂盒说明书提供的实验方法,步骤如下:(1)制备MDA梯度浓度的标准品溶液并对样本溶液进行适当稀释(房水样本不稀释)。(2)取标准品溶液和样本稀释溶液各50 μl与150 μl TBA溶液进行充分混合加入到96孔板中。(3)95 ℃环境下孵育60 min,冷却至室温后,在微孔板读板机(microplate reader)上检测OD 532 nm波长激发光吸光度值。(4)根据各梯度浓度标准品溶液的吸光度值和相应浓度值制作标准曲线,并通过标准曲线计算各样本溶液中MDA的浓度值。
四、VEGF,IL-6,MCP-1定量
(1)采用 ELISA法检测VEGF,IL-6,MCP-1的含量。(2)试验前将试剂和待测样品置于室温下(20~25 ℃)平衡。(3)按照要求用蒸馏水稀释浓缩清洗液,充分混匀备用。(4)标记好试验所需的微孔。(5)在微孔中分别加入标准品和样品,每孔加入100 μl,并做好相应标记。(6)将包被微孔板覆膜放置于37 ℃孵育60 min,充分弃尽孔内的液体,用洗涤液将反应板充分洗涤4~6次。(7)每孔依照次序加入底物反应液Ⅰ50 μl,再加入底物反应液Ⅱ 50 μl,充分混匀,在室温下避光反应5~30 min。(8)向各孔中加入终止液,轻轻混匀30秒。(9)在30 min之内使用酶标仪在450 nm处读取吸光度值。根据定比稀释标准品的OD值绘制标准曲线 ,根据样品OD值和标准曲线 ,算出标本中VEGF,IL-6,MCP-1的含量。
五、统计学分析方法
使用R3.4.1软件包进行统计学分析,药物注射前后比较采用配对Wilcoxon检验,相关性分析采用Spearman秩相关分析。P<0.05表示差异具有统计学意义。
结 果
一、入组患者一般情况
本项研究一共纳入了74例(75只眼)PDR的患者,年龄(54.1±13.6)岁,男性35例,女性39例,术前视力均低于0.3,其中玻璃体出血32只眼,视网膜下出血33只眼,伴有增生膜21只眼,牵拉性视网膜脱离7只眼。平时使用胰岛素控制血糖的患者54例,口服降糖药的有20例。注射抗VEGF药前和行玻璃体切除术前患者空腹血糖均控制在8.0 mmol/l以下(见表1)。

表1 入组PDR患者的数据
二、玻璃体注射康柏西普前后房水中VEGF、MDA、IL-6和MCP-1水平的变化
玻璃体注射康柏西普后房水中IL-6和MCP-1浓度的个体差异较大,其浓度在注射后升高,配对Wilcoxon检验证实其差异有统计学意义。而房水中的MDA浓度在注射后降低,且差异有统计学意义(P<0.05)(见表2)。
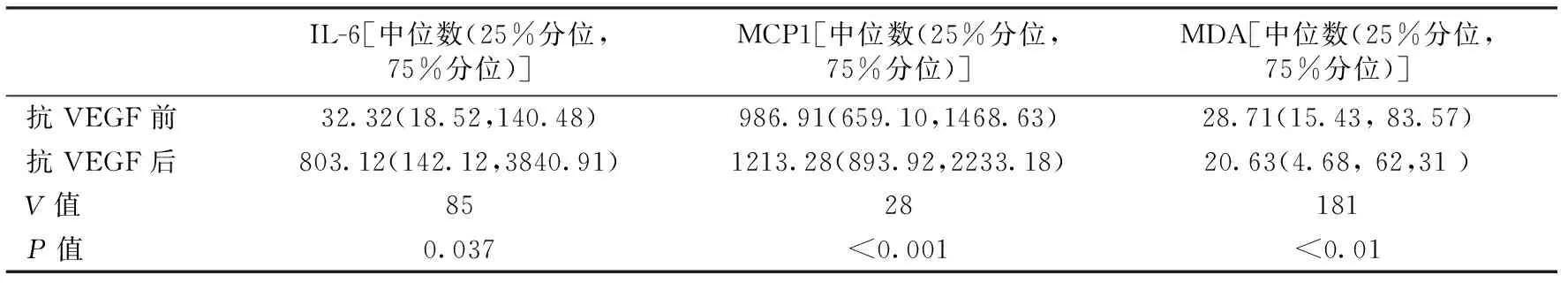
表2 PDR患者玻璃体注射康柏西普前后房水中细胞因子和MDA中位数水平的变化(pg/ml)
玻璃体注射康柏西普后VEGF浓度变化有显著统计学差异,其中63只眼房水中VEGF浓度低至不可测(0),11只眼中检测到低浓度的VEGF,分别为1.34 pg/ml,1.37 pg/ml,1.47 pg/ml,16.18 pg/ml,3.21 pg/ml,0.53 pg/ml,0.07 pg/ml,14.47 pg/ml,0.15 pg/ml,3.12 pg/ml,2.11 pg/ml(见表3)。

表3 PDR患者玻璃体注射康柏西普前后房水中VEGF中位数水平的变化(pg/ml)
三、PDR患者房水中细胞因子间以及MDA之间的相关性分析:
Spearman相关分析显示,患者房水中IL-6和MCP-1浓度在注射康柏西普前后始终存在比较强的相关性(图1,2),其中注射前r=0.681,P<0.001,注射后r=0.614,P<0.001。IL-6和MCP-1本身在注射前后也存在较强的相关性(图3,4),其中IL-6注射前后r=0.376,P<0.05,MCP-1注射前后r=0.638,P<0.001。
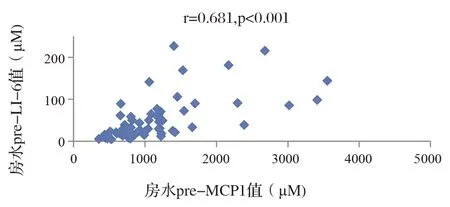
图1 房水pre-MCP1水平和pre-IL6水平的相关性

图2 房水post-IL6水平和post-MCP1水平的相关性

图3 房水pre-MCP1水平和pre-MDA水平的相关性
Spearman相关分析显示,在注射康柏西普前,患者房水中MDA和MCP-1存在较强的相关性(图3),r=0.651,P<0.001。MDA和IL-6 也存在较强的相关性(图4),r=0.530,P>0.05。在注射康柏西普后,没有发现MDA和MCP-1的相关性,r=-0.323,P>0.05;也没有发现MDA和IL-6的相关性,r=-0.372,P>0.05。

图4 房水pre-IL6水平和pre-MDA水平的相关性
讨 论
临床上和传统意义上DR一直被认为是一个血管损伤性的疾病,直到上个世纪末,对于其病理的研究也主要集中在微循环异常方面,然而从这个世纪开始,特别是近十年来,大量的基于糖尿病患者和动物模型的研究表明糖尿病带来的视网膜损伤在视网膜微循环异常显现前就已经存在,这主要表现在视网膜神经节细胞的凋亡,感光细胞的异常以及视网膜胶质细胞,例如Müller细胞和小胶质细胞的异常活化。而导致这些异常的一个重要原因在于长期高糖导致的氧化压力的增加和炎症因子浓度的升高。促进氧化压力和炎症因子浓度升高的因素除了视网膜本身代谢异常外,另一方面还可能是因为血管渗透性增加导致的血-视网膜屏障的破坏,从而使得外周血中的白细胞得以进入视网膜组织,进一步加剧了视网膜微环境的恶化,并促进新生血管的形成。基于这些研究结果,临床上给予DR患者的抗炎症药物例如水杨酸盐(阿司匹林)和米诺环素也证实了具有预防不可逆的血管和神经损伤的作用[9]。
氧化微环境和炎症微环境的破坏同时也推动了DR病程的进展。在PDR阶段,由于VEGF浓度的长期增高,新生血管出现。目前用抗VEGF药物中和眼内的VEGF从而阻止新生血管的生成,具有比较好的临床效果,然而这个治疗方法只适用于PDR,而且有相当多的DR患者对这个治疗方法并没有有效的反应,提示新的靶向治疗的开发势在必行,而对于炎症和氧化压力的控制可能就是下一个控制DR发生发展的窗口[10]。
VEGF除了增加血管通透性外,本身具有趋化作用,尤其对巨噬细胞,因此可以直接加剧视网膜组织的炎症反应,那么抗VEGF治疗是不是能对眼内的炎症微环境有缓解作用呢?我们的实验结果证实玻璃体腔内康柏西普注射在短期内(7 d),MDA的浓度有明显的降低,提示组织内氧化压力有减少的趋势。但是却没有降低房水中IL-6和MCP-1的效果,反而有增高的趋势。这可能和两次取房水之间的间隔较短有关。
Forooghian等[11]等的研究中检测了29例PDR患者,玻璃体注射抗VEGF药后短期内(7 d)眼房水中细胞因子的变化,发现IL-6、MCP-1和IL-8均较注射前增高。丁国龙等[12]对59例(63只眼)PDR患者房水中细胞因子的研究中也发现,虽然短期内(7 d)玻璃体注射抗VEGF药前后眼房水中细胞因子的变化无显著统计学差异,但IL-6、MCP-1的浓度均呈增高趋势。
但是Jeon等[13]等发现,玻璃体注射抗VEGF药后,玻璃体腔内炎性因子有升高的趋势,但这个过程是急性且短暂的,注药后1 d,IL-6、IL-8显著升高;7 d后IL-6浓度显著低于第1天,IL-8没有变化;但是在1个月后IL-6、IL-8的浓度与注药前无显著差异。而Roxane等[14]在糖尿病黄斑水肿(diabetic macular edema, DME)患者中,连续2次的雷珠单抗注射(2个月)后,患者房水中的ICAM-1, VEGF,IL-6和MCP-1 浓度比注射前有显著降低。
所以,玻璃体注射抗VEGF药后炎症因子的升高是短暂的,一方面可能是由于玻璃体内注射联合前房穿刺术引起了一系列的炎性反应,导致眼前房内炎性因子的短暂增高;另一方面,可能是眼内VEGF被抑制后的代偿反应机制,其具体机制需进一步研究。我们的研究两次取房水的时间间隔为7 d,因此无法揭示玻璃体注射抗VEGF药后玻璃体内炎症因子的变化趋势,这给我们今后的研究提供了方向。
而玻璃体注射康柏西普后在短期内(7 d)房水中MDA的浓度有明显的降低,提示抗VEGF治疗后组织内氧化压力有减少的趋势。Vlatka Brzovi-ari[15]等的研究中提示,PDR患者血浆中VEGF水平与MDA水平呈显著正相关 (P<0.05),SOD水平与年龄呈负相关(P<0.05)。Hiroshi Izuta[16]等的研究中发现PDR患者玻璃体中VEGF水平与MDA水平呈显著正相关(P<0.05)。而郑纯[17]等认为玻璃体注射抗VEGF药物后能有效增强患者的抗氧化能力和减少过氧化物的蓄积,从而缓解视网膜的病理过程,最终改善病情。
另外,我们的研究发现,所有研究对象房水中MCP-1、IL-6、MDA在注射康柏西普前后均有一定的相关性。
患者房水中IL-6和MCP-1浓度在注射康柏西普前后始终存在比较强的相关性,以及本身在注射前后也存在较强的相关性,提示了IL-6和MCP-1共同参与了PDR复杂的病理过程。在高血糖状态下,MCP-1能活化白细胞,并介导其产生炎症介质,如IL-6等。而IL-6R/IL-6复合体又能刺激内皮细胞合成MCP-1,后者能强有力地趋化单核细胞,两者起协同作用。
其次,我们研究还发现在注射康柏西普前,患者房水中MDA和MCP-1、IL-6均存在较强的相关性,提示了氧化应激与炎症反应在微血管病变中存在密切的相互作用。Domingueti等[18]等报道显示,持续的高血糖状态不仅促进患者体内炎症反应的发生,同时也可以促进氧化应激的发生。持续的高血糖导致蛋白质及脂质的结构和功能异常,进而促进炎症因子的产生,同样炎症因子的增加也可以刺激氧自由基的产生,形成正反馈效应,促进糖尿病患者微循环障碍,导致微血管并发症的发生。本研究中检测的MDA 是膜脂过氧化最重要的产物之一,可作为机体氧化水平的标志物[19],IL-6和MCP-1是PDR的重要炎症介质,提示PDR患者中氧化应激和炎症存在相互促进作用。
但是我们在眼内注射康柏西普后的PDR患者,眼内VEGF水平显著下降后,未发现房水中IL-6、MCP-1和MDA的相关性,从另一方面提示了VEGF不仅是血管发生和血管生成过程中的重要调控因子,也与高血糖状态下氧化程度增高和炎症反应有关,它和IL-6、MCP-1之间复杂的相互作用机制在PDR 的发生发展中起着重要的作用。
本研究还根据性别对所有患者进行分组,结果显示注射前后性别对房水中IL-6、MCP-1和MDA水平均无影响。
