鲍鱼内脏酶解物可调节肠道菌群及短链脂肪酸缓解小鼠系统低度炎症
2022-03-22何晓彤孙力军孙东方胡连花房志家
何晓彤, 王 晨, 孙力军*, 孙东方, 胡连花, 龚 丽, 房志家, 邓 旗
( 1.广东海洋大学食品科技学院 广东省水产品加工与安全重点实验室 广东省海洋生物制品工程实验室 广东省海洋食品工程技术研究中心 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088;2.广东省现代农业装备研究所,广东 广州 510630)
系统低度炎症是一种机体受到慢性应激(如连续的熬夜、压力等)、药物、不当饮食等诱发的免疫调节系统失衡引起的非特异性、全身性、持续性的促炎或抑炎反应失衡的病理状态[1-3],常呈现喉咙肿痛、口腔溃疡等“上火”症状[4],长期的系统低度炎症可进一步引起机体免疫和代谢失衡,诱发多种代谢性慢病。目前的抗炎药物主要针对短期的局部炎症,长期使用副作用大,容易引起机体的不良反应。因此,寻找安全性高且针对性强的抗炎物质十分必要。鉴于药食同源,针对系统低度炎症的致病机制采用特定的食物源活性组分进行干预是最直接安全的手段。近些年,我国大力开发海洋资源,许多能促进人身体健康的海洋源活性物质被开发利用,具有潜在的经济价值。鲍鱼内脏作为鲍鱼加工过程中的下脚料,含有丰富的蛋白质、多糖和脂质等[5-6],有文献报道,由鲍鱼内脏酶解得到的多肽在体外显示了较强的抗炎、抗氧化活性[7-9]。因此,鲍鱼内脏酶解物具有抗系统低度炎症的潜能,同时还能提高鲍鱼下脚料的附加值。近年来越来越多的研究发现,肠道中的菌群及其代谢产物可以直接或间接参与机体的免疫和代谢调节[10]。研究证实肠道菌群紊乱可能是系统低度炎症发生的重要诱因,其中菌群结构及其代谢物短链脂肪酸(SCFAs)组成失衡可能发挥关键作用[11-12],但鲍鱼内脏酶解物在抗系统炎症中发挥的作用尚待明确。本研究拟在通过给小鼠灌胃高剂量辣椒素构建系统低度炎症模型基础上,给模型小鼠灌胃不同剂量的鲍鱼内脏酶解物,从血清炎性因子水平、肠道菌群结构和功能及粪便SCFAs含量变化,考察鲍鱼内脏酶解物对模型小鼠系统低度炎症的干预作用,为开发高效安全的抗系统低度炎症新产品提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级4周龄雄性C57BL/6J小鼠,体质量18~20 g,购自北京斯贝福生物技术有限公司,许可证批号:SCXK(京)2016-0002。整个实验过程中,实验动物自由摄食和饮水,饲养环境温度(25±1) ℃,昼夜明暗交替(12 h/12 h)。本动物实验方案遵循广东海洋大学动物实验伦理委员会的相关规定制定和执行。
1.1.2 试剂 辣椒素(纯度99.5%),购自河南兴隆生物科技有限公司;皱纹盘鲍鱼,购自广东湛江湖光镇市场;Swisse深海鱼油,购自澳大利亚Wellness Pty Ltd;碱性蛋白酶,购自南宁庞博生物工程有限公司;肿瘤坏死因子-α(TNF-α) ELISA试剂盒、白细胞介素-1β(IL-1β) ELISA试剂盒、白细胞介素-6(IL-6)ELISA试剂盒、白细胞介素-10(IL-10)ELISA试剂盒,购自深圳欣博盛生物科技股份有限公司;微板定量显色基质法鲎试剂盒,购自厦门鲎试剂生物科技股份有限公司;乙酸、丙酸、丁酸、异丁酸和戊酸标准品,购自上海麦克林生化科技有限公司;异戊酸、己酸、异己酸标准品,购自上海阿拉丁生化科技有限公司。
1.1.3 仪器与设备 VarioskanFlash酶标仪(SPY-11234,美国赛默飞世尔科技公司);三重四级杆气质联用仪(GCMS-TQ8050 NX,日本岛津公司);高速冷冻台式离心机(ST16R,赛默飞世尔科技(中国)有限公司)。
1.2 方法
1.2.1 鲍鱼内脏酶解物的制备 取新鲜鲍鱼的内脏,按照料液比1∶50(m/V)加入蒸馏水混合,pH调节至7.5,再加入3 000 U/g碱性蛋白酶,51 ℃酶解4 h,经灭酶活、过滤后,5 000 r/min离心10 min,取上清液,200 nm的微滤膜除杂,所得提取液冷冻干燥即得鲍鱼内脏酶解物(含氮物质为97.0%,总糖含量为1.2%)。
1.2.2 小鼠分组和处理 30只雄性小鼠,适应性喂养1周后,随机分成6组,每组5只,分笼饲养。空白对照组(NC)小鼠灌胃生理盐水,辣椒素致炎模型组(PC)小鼠灌胃16 mg/(kg·d)辣椒素(下同),鱼油对照组(IM)小鼠同时灌胃2.50 g/(kg·d)鱼油和辣椒素,鲍鱼内脏酶解物低剂量组(ABL)同时灌胃0.30 g/(kg·d)鲍鱼内脏酶解物和辣椒素,鲍鱼内脏酶解物中剂量组(ABM)同时灌胃0.60 g/(kg·d)鲍鱼内脏酶解物和辣椒素,鲍鱼内脏酶解物高剂量组(ABH)同时灌胃1.20 g/(kg·d)鲍鱼内脏酶解物和辣椒素,每天灌胃1次,持续7 d。
1.2.3 小鼠血清炎性因子和LPS的测定 灌胃7 d后,对小鼠进行眼球取血,收集的血液4 ℃、8 300 r/min离心8 min,吸取上清即为血清,并4 ℃保藏备用。按照试剂盒的操作步骤,对小鼠血清进行TNF-α、IL-1β、IL-6、IL-10和LPS含量检测。
1.2.4 小鼠肠道菌群的测定 小鼠灌胃7 d,收集各组小鼠粪便样品,每只小鼠取3颗粪便,置于无菌EP管中,-80 ℃低温冰箱备用。将收集到的粪便样品送至杭州谷禾信息技术有限公司进行测序。SDS裂解液冻融法进行样品DNA提取,PowerMax提取试剂盒提取基因组DNA,再对细菌16S rRNA基因V4区域进行 PCR 扩增,使用的扩增引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。Barcode采用特定的7-bp特定序列合成到序列中。PCR产物纯化、定量后,使用Illlumina HiSeq4000 pair-end 2×150 bp 测序平台测序。根据Barcode序列和引物序列从原始数据中拆分各个样本的数据。截去Barcode和引物序列后使用Vsearch v2.4.4对每个样品的reads进行拼接,再对序列质量进行质控和过滤,得到特征表和特征序列,并利用生物信息学进行分析。
1.2.5 小鼠粪便短链脂肪酸含量的测定 用GC-MS法检测粪便中短链脂肪酸的含量。取粪便样品50 mg与100 μL 15%磷酸混合,再加100 μL 125 μg/mL的内标(异己酸)溶液和900 μL乙醚匀浆 1 min,于4 ℃、 12 000 r/min离心10 min,取上清过膜备用。色谱条件:色谱柱为VF-17MS 毛细管柱(30 m×0.25 mm ID×0.25 μm)。柱温初温为90 ℃,以10 ℃/min 升至120 ℃,再以5 ℃/min升至150 ℃,最后以25 ℃/min升至250 ℃,维持2 min,进样口温度为250 ℃;载气流速为1.0 mL/min;离子源温度为230 ℃,传输线温度为250 ℃。质谱条件:EI源,电子能量为70 eV,单离子扫描模式。
1.2.6 统计学分析 实验所得数据使用spss22.0相关程序进行统计分析,数据以“平均值±标准差”表示,多组间比较采用ANOVA方差分析,以P<0.05表示统计学上有显著性差异。
2 结果与分析
2.1 鲍鱼内脏酶解物对辣椒素致炎小鼠血清炎性因子的影响
由图1可知,与空白对照组相比,灌胃辣椒素后小鼠的血清中促炎因子TNF-α和 IL-6水平显著升高(P<0.05),分别升高了67%和45%,而与模型组相比,经低、中、高剂量鲍鱼内脏酶解物干预后的小鼠血清中的促炎因子IL-1β和IL-6水平显著性降低(P<0.05),且降低程度比鱼油组高,基本恢复到正常水平,表明灌胃辣椒素能使小鼠体内促炎因子水平升高,经鲍鱼内脏酶解物干预后,能降低体内促炎因子水平,且趋于空白组。而与空白对照组相比,模型组小鼠血清中抑炎因子IL-10水平显著降低,经鱼油干预后,IL-10水平有所升高,而经鲍鱼内脏酶解物干预后,IL-10水平继续下降,说明鲍鱼内脏酶解物没有提高小鼠体内抑炎因子水平。

图1 鲍鱼内脏酶解物对辣椒素致炎小鼠血清炎性因子的影响Fig.1 Effects of abalone visceral enzyme hydrolysate on serum inflammatory factors in capsaicin-induced inflammatory miceNC为空白对照组,PC为辣椒素致炎模型组,IM为鱼油对照组,ABL为鲍鱼内脏酶解物低剂量组,ABM为鲍鱼内脏酶解物中剂量组,ABH为鲍鱼内脏酶解物高剂量组,下图同;A为小鼠血清中TNF-α水平图,B为小鼠血清中IL-β水平图,C为小鼠血清中IL-6水平图,D为小鼠血清中IL-10水平图。不同小写字母表示两组间差异具有统计学意义(P<0.05)NC is blank control group, PC is capsaicin induced inflammatory model group, IM is fish oil control group, ABL is low dose group of abalone visceral hydrolysate, ABM is middle dose group of abalone visceral hydrolysate, ABH is high dose of abalone visceral hydrolysate, same as below. A is TNF-α level map in mouse serum, B is IL-β level map in mouse serum, C is IL-6 level map in mouse serum, D is IL-10 level map in mouse serum. Different lowercase letters indicated that there was significant difference between the two groups (P<0.05)
2.2 鲍鱼内脏酶解物对辣椒素致炎小鼠血清中LPS含量的影响
各组小鼠血清中LPS水平见图2,模型组小鼠血清中LPS含量相对于空白对照组显著升高(P<0.05),增加了2.7倍,而经低、中、高剂量鲍鱼内脏酶解物干预后,小鼠血清中的LPS含量相对于模型组显著降低(P<0.05),分别降低了37.6%、53.9%和61.7%,其中高剂量更接近空白对照组水平,且效果优于鱼油。
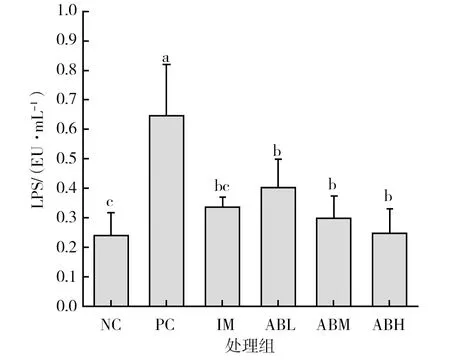
图2 各组小鼠血清中LPS水平Fig.2 The level of LPS in serum of mice in each group不同小写字母表示两组间差异具有统计学意义(P<0.05)Different lowercase letters indicate that there is significant difference between the two groups (P< 0.05)
2.3 鲍鱼内脏酶解物对辣椒素致炎小鼠肠道菌群OTU的影响
各组小鼠肠道菌群OTU韦恩图见图3。空白对照组的OTU值为275,模型组的OTU值为240,说明灌胃辣椒素能使小鼠肠道菌群OTU值明显降低;低、中、高剂量鲍鱼内脏酶解物组的OTU值分别为231、258和245,中、高剂量组的OTU值均有所升高,说明中、高剂量鲍鱼内脏酶解物可以提高因辣椒素致炎而降低的肠道菌群物种多样性。
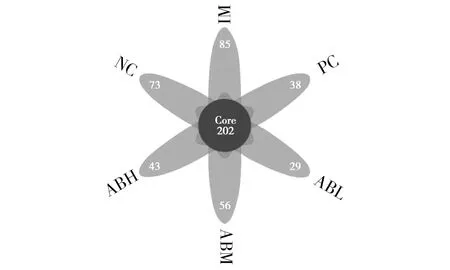
图3 各组小鼠肠道菌群OTU韦恩图Fig.3 OTU Wayne diagram of intestinal flora of mice in each group
2.4 鲍鱼内脏酶解物对辣椒素致炎小鼠肠道菌群Alpha多样性的影响
各组小鼠肠道菌群Alpha多样性各指数见表1。模型组与空白对照组的Shannon指数和Chao1指数均没有显著性差异,而与模型组相比,鱼油组和中剂量鲍鱼组的Shannon指数和Chao1指数显著升高(P<0.05),低剂量组和高剂量组没有显著性差异,说明在Alpha多样性上,灌胃辣椒素没有使肠道菌群的丰度和多样性发生显著性变化,而中剂量鲍鱼内脏酶解物能使肠道菌群的丰度和多样性增加,其效果与鱼油相似。
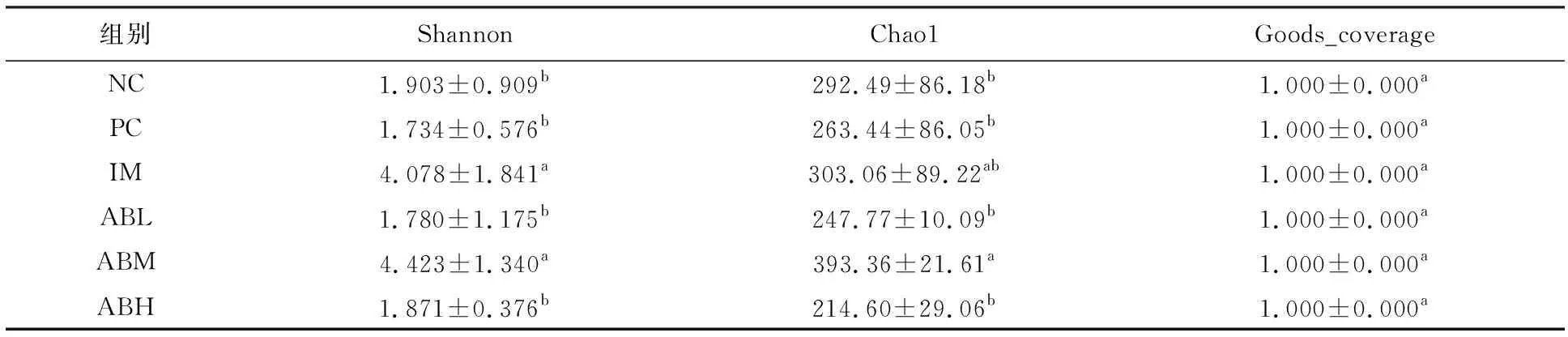
表1 鲍鱼内脏酶解物对小鼠肠道菌群Alpha多样性各指标的统计Table 1 Statistics of abalone visceral enzyme hydrolysate on Alpha diversity of intestinal flora in mice
2.5 鲍鱼内脏酶解物对辣椒素致炎小鼠肠道菌群在门水平下丰度的影响
各组小鼠肠道菌群在门水平上的构成丰度见图4。与空白对照组相比,模型组小鼠肠道菌群的变形菌门相对丰度显著增加了49.1%,成为最主要的菌门,放线菌门相对丰度有所增加,而厚壁菌门和拟杆菌门相对丰度显著降低。鱼油组的小鼠肠道菌群结构和丰度与空白组较接近,基本趋向于正常。而与模型组相比,鲍鱼内脏酶解物低、中剂量组的变形菌门相对丰度分别降低了30.1%和70.1%,放线菌门相对丰度均有所降低,而厚壁菌门相对丰度均显著增加,分别增加了31.4%和61.8%。而高剂量组小鼠肠道菌群变形菌门、放线菌门相对丰度分别降低了8.5%和2.3%,拟杆菌门丰度增加了11.9%。

图4 各组小鼠肠道菌群在门水平的构成Fig.4 The composition of intestinal flora at the phylum level in each group of mice
2.6 鲍鱼内脏酶解物对辣椒素致炎小鼠肠道菌群在属水平下丰度的影响
各组小鼠肠道菌群在属水平的构成丰度见图5。与空白对照组相比,模型组小鼠肠道菌群中的寡养单胞菌属(Stenotrophomonas)和棒状杆菌属(Corynebacterium)相对丰度显著增加,分别增加了41.5%和4.3%,且乳杆菌属(Lactobacillus)和阿洛巴氏菌属(Allobaculum)相对丰度显著降低。鱼油组的小鼠肠道菌群结构和相对丰度与空白组较接近,基本趋向于正常。而与模型组相比,鲍鱼内脏酶解物低剂量组的寡养单胞菌属和棒状杆菌属相对丰度分别降低67.3%和3.2%,且乳杆菌属相对丰度增加到49.2%,中剂量组的寡养单胞菌属相对丰度降低了79%,几乎未检出,棒状杆菌属相对丰度也有所降低,而乳杆菌属、阿洛巴氏菌属、瘤胃球菌属(Ruminococcus)、拟杆菌属 (Bacteroides)相对丰度明显增加,所占比例分别增加到49.2%、51.7%、4.3%和0.7%;高剂量组肠道菌群中的寡养单胞菌属和乳杆菌属相对丰度占总菌群的94.2%,其中寡养单胞菌属相对丰度占88.6%,相比于模型组,其所占比例明显增加。
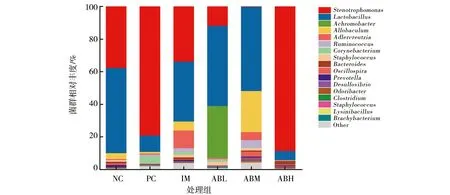
图5 各组小鼠肠道菌群在属水平的构成Fig.5 The composition of intestinal flora at the genus level in each group of mice
2.7 鲍鱼内脏酶解物对辣椒素致炎小鼠肠道中革兰阴性菌的影响
各组小鼠肠道中革兰阴性菌相对丰度见图6,与空白组相比,灌胃辣椒素后,小鼠肠道中的革兰阴性菌的相对丰度显著升高(P<0.05),而经低剂量和中剂量的鲍鱼内脏酶解物干预后,与模型组相比,小鼠肠道中的革兰阴性菌相对丰度显著降低(P<0.05),但高剂量组的革兰阴性菌的相对丰度无显著差异。

图6 各组小鼠肠道中革兰阴性菌相对丰度图Fig.6 Relative abundance map of gram-negative bacteria in intestinal tract of mice in each group不同小写字母表示两组间差异具有统计学意义(P<0.05)Different lowercase letters indicate that there is significant difference between the two groups (P< 0.05)
2.8 鲍鱼内脏酶解物对辣椒素致炎小鼠粪便中短链脂肪酸含量的影响
各组小鼠粪便中短链脂肪酸的含量见图7。与空白对照组相比,模型组小鼠粪便中的总短链脂肪酸含量显著降低(P<0.05),降低48.3%,其中乙酸和丙酸含量分别降低43.4%和18.7%(P<0.05),异戊酸的含量升高37%(P<0.05),丁酸、异丁酸和戊酸没有显著性差异。而鱼油组的各种短链脂肪酸与空白组基本没有显著差异。与模型组相比,鲍鱼内脏酶解物各干预剂量组的总短链脂肪酸显著升高(P<0.05),乙酸和丙酸含量显著升高(P<0.05),均基本恢复至空白对照水平,且低、中剂量组的异戊酸含量显著降低(P<0.05),可恢复到正常水平。
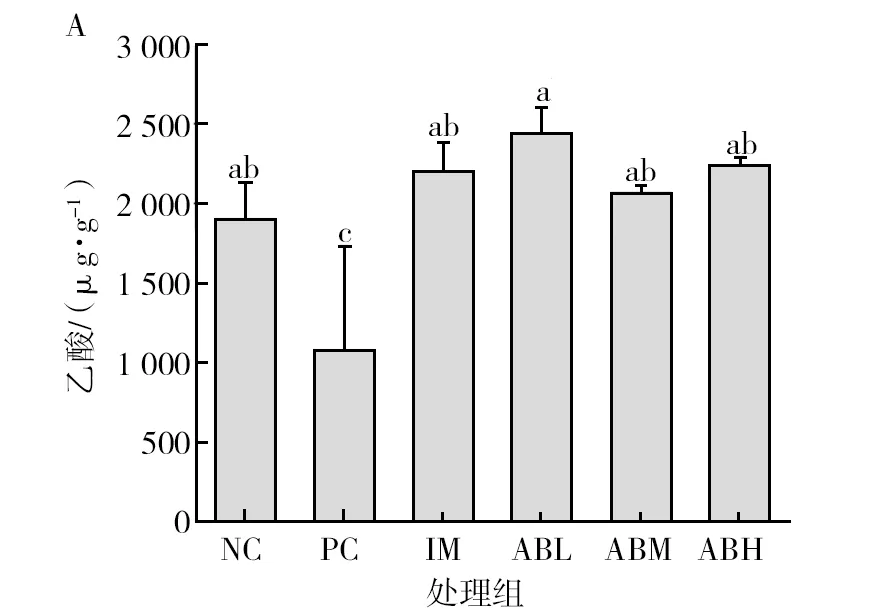
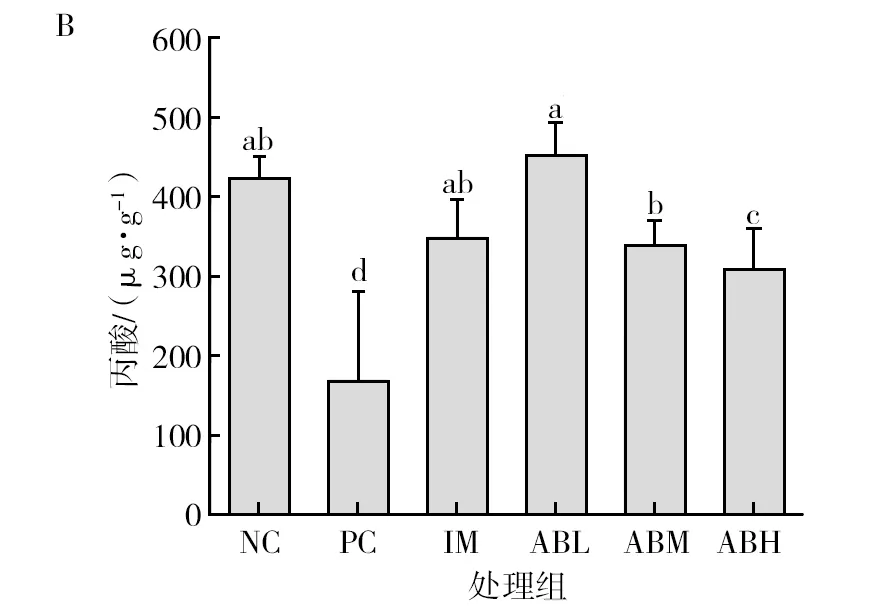
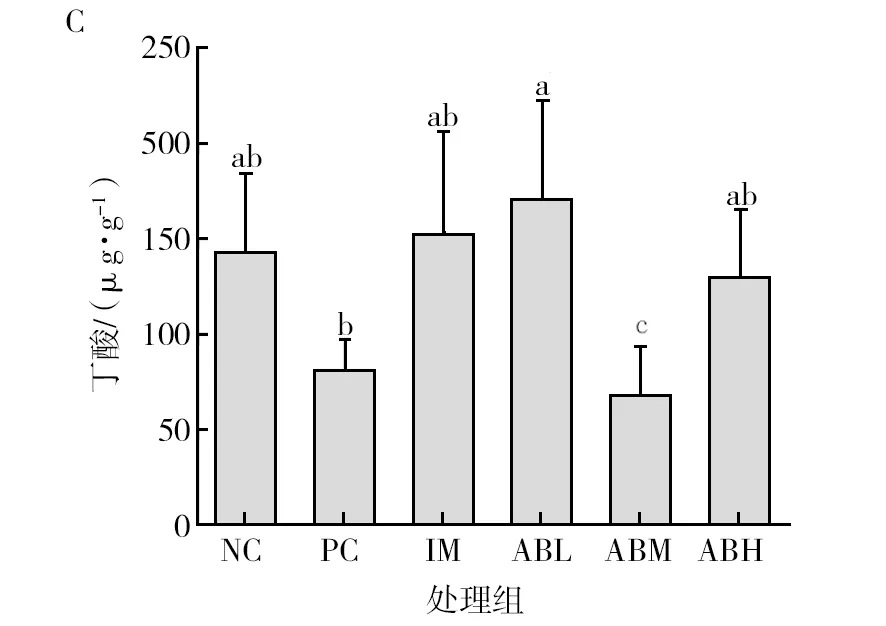

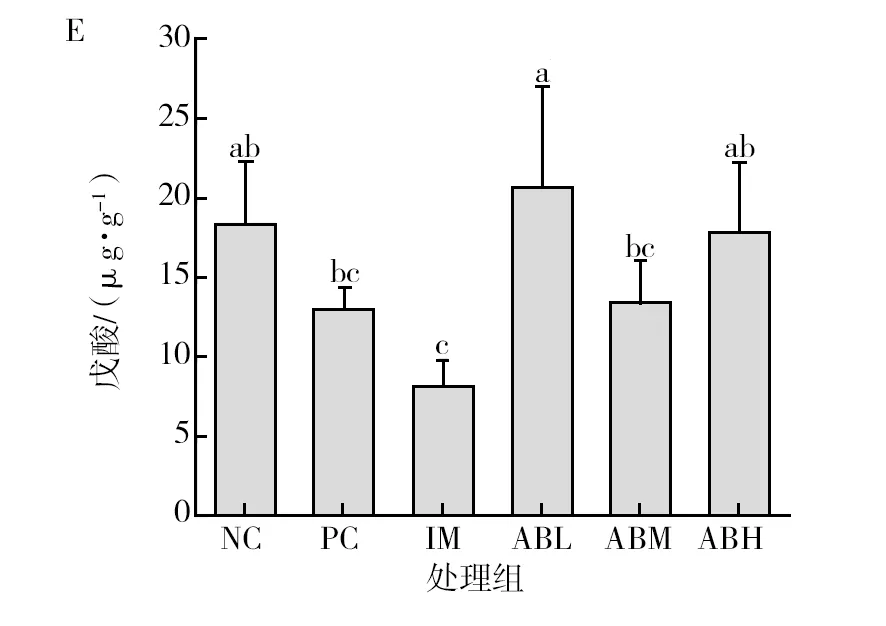
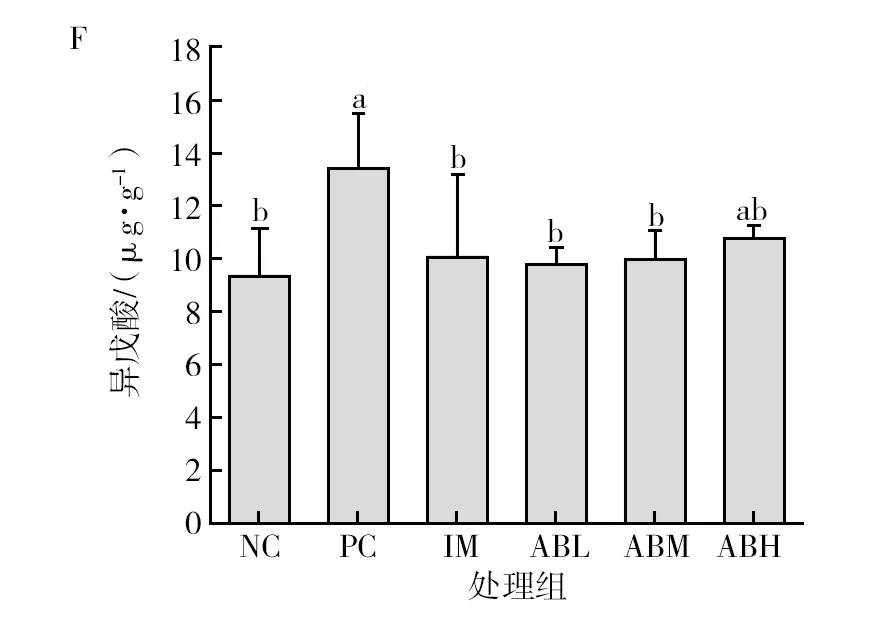
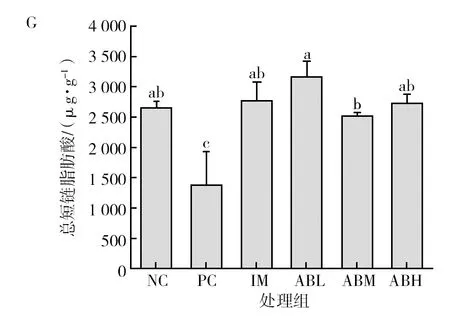
图7 鲍鱼内脏酶解物对辣椒素致炎小鼠粪便中短链脂肪酸含量的影响Fig.7 Effects of abalone visceral enzymatic hydrolysate on the content of short-chain fatty acids in feces of capsaicin-induced inflammatory miceA为粪便中乙酸含量图,B为粪便中丙酸含量图,C为粪便中丁酸含量图,D为粪便中异丁酸含量图,E为粪便中戊酸含量图,F为粪便中异戊酸含量图,G为粪便中总短链脂肪酸含量图;不同小写字母表示两组间差异具有统计学意义(P<0.05)A is the content of acetic acid in feces, B is the content of propionic acid in feces, C is the content of butyric acid in feces, D is the content of isobutyric acid in feces, E is the content of valeric acid in feces, F is the content of isovaleric acid in feces, G is the content of total short chain fatty acids in feces. Different lowercase letters indicated that there was significant difference between the two groups (P<0.05)
3 讨 论
本研究发现给小鼠灌胃高剂量的辣椒素后,小鼠血清中TNF-α、IL-6水平相对于空白对照组显著升高,血清中脂多糖(LPS)含量显著升高了2.7倍,说明模型建立成功[13]。有文献报道,深海鱼油富含EPA和DHA,具有较好的抗炎抗氧化效果,是一种典型的食源性抗炎活性物质[14-16]。经过鲍鱼内脏酶解物干预后,小鼠血清中IL-6、IL-β、LPS水平显著降低,并基本恢复至空白组水平,且降低促炎因子的含量是鱼油的2.2倍,说明鲍鱼内脏酶解物抗系统炎症的效果显著优于鱼油,鲍鱼内脏酶解物在防治系统性低度炎症方面具有极大的潜力和应用前景。
有文献报道,肠道菌群与系统低度炎症存在密切关系[17-18]。变形菌门是肠道菌群失调的微生物标志,若丰度增加,会加重炎症反应[19],而棒状杆菌能在黏膜上生长繁殖并分泌外毒素,引起局部炎症。本研究发现,高剂量的辣椒素会引起肠道中寡养单胞菌属、棒状杆菌属等致病菌大量繁殖,导致肠道菌群紊乱。而低、中剂量组鲍鱼内脏酶解物干预,能显著降低肠道中寡养单胞菌属和棒状杆菌属相对丰度,能显著升高因灌胃辣椒素而降低的乳杆菌属、阿洛巴氏菌属、瘤胃球菌属和拟杆菌属相对丰度。乳酸杆菌作为肠道益生菌,能调节机体肠道内环境稳态[20],并且阿洛巴氏菌属、瘤胃球菌属和拟杆菌属均属于产SCFAs类群,能增加肠道中SCFAs含量,发挥抗炎和改善肠道屏障的功能[21],表明低、中剂量的鲍鱼内脏酶解物能恢复肠道菌群原有结构,改善肠道内环境稳定,降低机体炎症反应。且低、中剂量组鲍鱼内脏酶解物还能显著降低因高剂量辣椒素增加的革兰阴性菌,基本恢复至空白对照组水平。革兰阴性菌细胞壁的主要成分为LPS,当肠道中革兰阴性菌丰度比例显著降低时,能抑制LPS进入血液中[22],与本研究中测定的血清中 LPS 含量变化趋势相一致,表明低、中剂量组鲍鱼内脏酶解物可通过抑制肠道中的革兰阴性菌生长,阻碍LPS进入血液,缓解高剂量辣椒素诱发的系统炎症反应。
短链脂肪酸(SCFAs)作为肠道菌群的代谢产物,已被证明能改善机体的系统性炎症反应和维持肠道内环境稳态[23-24]。其中,阿洛巴氏菌属、瘤胃球菌属和拟杆菌属能促进肠道中丁酸、乙酸和丙酸的产生,丁酸、乙酸和丙酸能增加肠上皮细胞紧密连接蛋白 ZO-1 等的表达,减少促炎因子的生成[25-27],而异戊酸含量增多会引起结肠平滑肌松弛,对肠道健康起负作用[28],因此SCFAs合适的含量对健康尤为重要。本研究发现,辣椒素通过降低总SCFAs含量,来改变肠道通透性,损坏肠道屏障,加剧炎症反应。而鲍鱼内脏酶解物能通过增加瘤胃球菌属和拟杆菌属丰度来增加乙酸、丙酸的合成,提高总SCFAs的含量,进而增强肠道屏障功能,维护肠道内微生态平衡,降低机体炎症水平且说明鲍鱼内脏酶解物的抗炎机制可能与丁酸无关。
综合分析可知,一定剂量的鲍鱼内脏酶解物能通过调节肠道菌群结构和肠道短链脂肪酸组成来缓解因辣椒素诱导的小鼠系统低度炎症,其增加肠道中乳杆菌属、阿洛巴氏菌属、拟杆菌属和瘤胃球菌属等短链脂肪酸产生相关菌的相对丰度,降低肠道中革兰阴性菌的相对丰度,进而增加乙酸、丙酸和总SCFAs含量,降低异戊酸的含量,阻碍LPS入血或直接抑制炎症通路的表达,从而降低血液中促炎因子的水平,起到缓解系统低度炎症的作用。本研究结果可为系统性低度炎症的干预与治疗提供新思路,也可为开发高效安全的缓解系统低度炎症新产品提供参考。
