Claudin-6基因在食管鳞状细胞癌组织中的表达
2022-03-22张俊会赵丽岩聂红峰孟庆聚郑书深申社林魏世平
张俊会,李 辉,赵丽岩,聂红峰,孟庆聚,郑书深,申社林,李 娜,魏世平
(1.邢台医学高等专科学校,河北 邢台 054000;2.邢台市第一医院,河北 邢台 054000)
Claudins是组成细胞间紧密连接必不可少的骨架蛋白,有27个成员[1],其异常表达与多种肿瘤的发生、侵袭与转移有关,近来研究发现不同肿瘤组织中有不同的claudin表达,是肿瘤治疗的有效靶点[2]。食管癌是由食管黏膜上皮或腺体发生的消化道恶性肿瘤,我国是食管癌高发地区之一[3]。我们检测了claudin-6基因在食管鳞状细胞癌组织中的表达,并探讨其与临床病理参数的相关性,以期为临床食管癌的诊断和预后评估提供参考。
1 材料与方法
1.1 材料
邢台医学高等专科学校第二附属医院病理科2016-12—2018-12月留存的42例食管鳞状细胞癌石蜡包埋组织,其中低分化15例,高分化、中分化共27例;男性30例,女性12例;年龄43~97岁,平均(63±9.58)岁。以上病例手术前均未进行放疗和化学药物治疗。对照组为12例正常食管上皮组织。
1.2 试剂
Claudin-6抗体购自Affinity公司,免疫组化试剂盒、原位杂交检测试剂盒购于武汉博士德生物工程公司。Claudin-6 mRNA寡核苷酸探针:从基因库中查找到claudin-6基因的全序列(LOCUS:NM_021195,1389bp,mRNA),依此设计探针序列为:5′-TCAGG ACGAC TCCCA GGATC TGCAT TCCGG CA-3′,地高辛标记,由上海生工生物技术公司合成。
1.3 方法
免疫组化法:将制好的石蜡切片经63℃加热、二甲苯及梯度乙醇脱蜡至水,柠檬酸抗原修复液抗原修复2 min(高温高压条件下),其后的操作方法依据试剂盒说明书进行,DAB显色剂显色,苏木素复染后中性树胶封片。
原位杂交法:在无RNA酶环境进行操作,组织切片依常规方法脱蜡至水。用蛋白酶在37 ℃条件下消化30 min,使mRNA核酸片段充分暴露。加预杂交液40 ℃预杂交3 h。滴加杂交液,专用盖玻片覆盖,恒温箱40 ℃杂交过夜。滴加生物素化鼠抗地高辛试剂,37 ℃条件下孵育60 min。滴加SABC,37 ℃条件放置20 min。滴加亲和素化过氧化物酶,37 ℃环境孵育20 min。显色剂使用DAB。
1.4 结果判定
免疫组织化学方法检测claudin-6表达,其阳性表达于细胞膜及胞质内(图1~2),原位杂交法检测claudin-6 mRNA阳性表达出现在细胞质内(图3~4)。判定标准[4]:观察阳性染色的强弱并记分,无着色(0分)、淡黄色(1分)、棕黄色(2分)及棕褐色(3分);观察阳性着色细胞数并赋分值,在每张切片上选取5个视野(200倍)计数阳性细胞的百分比,阳性细胞数≤10%、11%~50%、51%~75%及75%以上分别计1、2、3、4分。两项得分相乘得分大于3分者为阳性。

图1 Claudin-6在正常食管黏膜上皮的阴性表达(免疫组织化学染色 ×200) 图2 Claudin-6在中分化食管鳞癌的阳性表达(免疫组织化学染色 ×200)

图3 Claudin-6 mRNA在正常食管黏膜上皮的阴性表达(原位杂交染色 ×100) 图4 Claudin-6 mRNA在高分化食管鳞癌的阳性表达(原位杂交染色 ×200)
1.5 统计学方法
采用SPSS 17.0处理数据,组间率(%)的比较采用χ2检验。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 Claudin-6在正常食管上皮组织及食管鳞状细胞癌中的表达
在正常食管上皮组织及食管鳞状细胞癌中,claudin-6及claudin-6 mRNA阳性表达率为25%、64.3%及25%、69%,组间阳性表达率差异有统计学意义(P<0.05)(表1)。

表1 Claudin-6在正常食管上皮组织及食管鳞状细胞癌中的表达
2.2 Claudin-6与食管鳞状细胞癌临床生物学行为的关系
Claudin-6及Claudin-6 mRNA表达均与食管鳞状细胞癌组织分化程度有关(P<0.05),二者在浸润深度、有无淋巴结转移及年龄、性别组内的表达差异无统计学意义(P>0.05)(表2)。
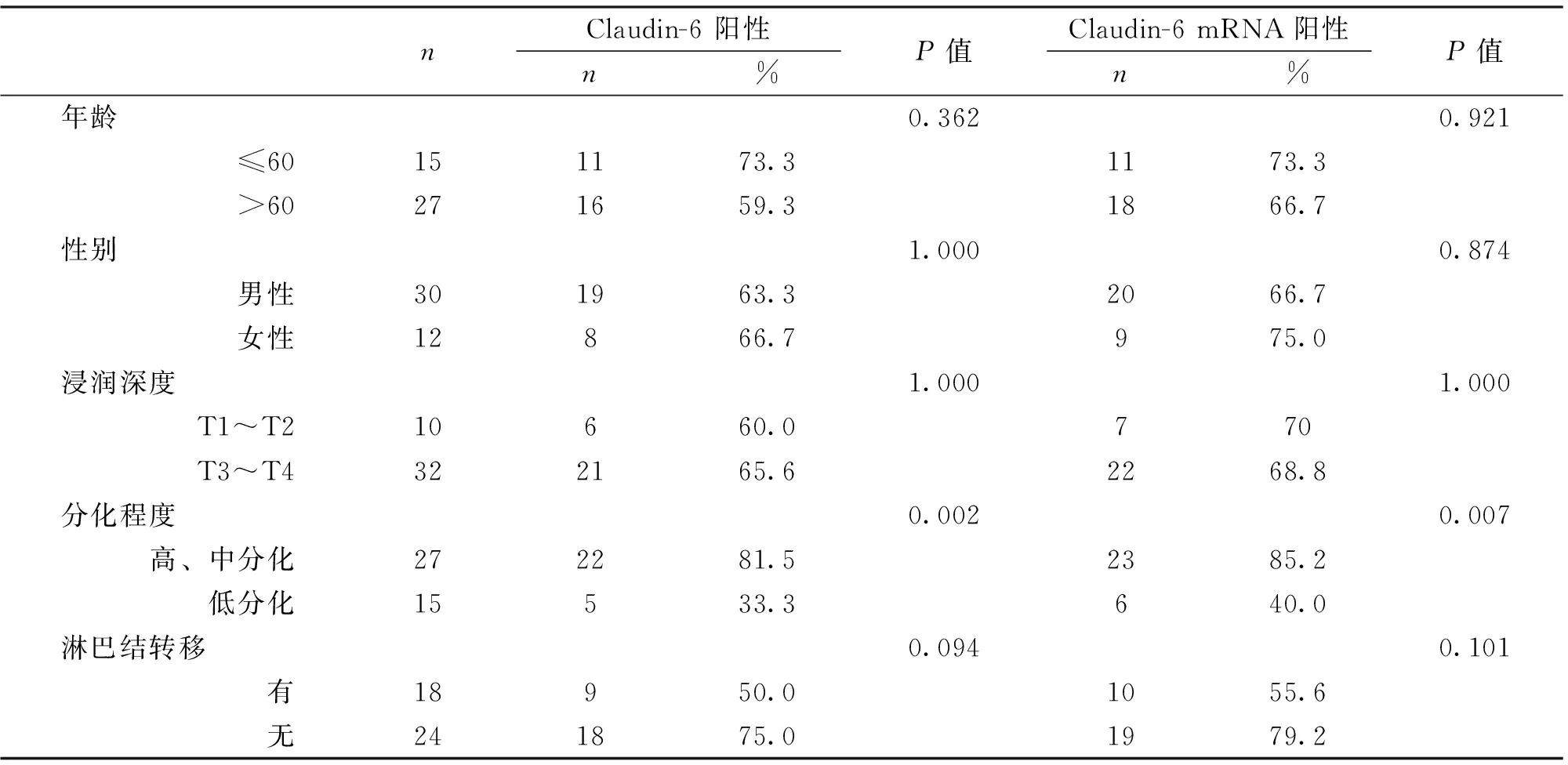
表2 Claudin-6与食管鳞状细胞癌临床生物学行为的关系
3 讨 论
紧密连接(tight junctions,TJS)是细胞间的重要连接体,其与细胞正常结构和生理功能均密切相关,参与细胞的极性排列及细胞之间信号传递[5-6],紧密连接包括claudins、occlaudin和连接黏附分子(JAMs)等,其中claudins起主要作用。Claudins在人体多种组织中均有表达,其表达异常可导致上皮细胞极性丧失,细胞间黏附力下降,导致肿瘤发生发展[7-8]。不同claudins在食管癌中表达不同,同一种claudins在不同病理类型的食管癌中表达也不一致。姜琳娜等[9]发现claudin-7在食管鳞癌组织中的表达较癌旁组织明显增多,左剑辉等[10]发现在食管鳞癌组织中claudin-10表达显著高于手术切缘食管黏膜组织,Sung等[11]发现食管鳞癌中claudin-4低表达,Shi等[12]发现食管鳞癌组织中claudin-4及claudin-4 mRNA均呈低表达且claudin-4低表达与肿瘤分期、淋巴结转移和复发与否相关。在食管腺癌中,Takala等[13]发现claudin-3、claudin-4及claudin-5呈高表达,而在正常食管鳞状上皮中表达很低。有研究表明[14-15],claudin-3在食管腺癌中高表达,claudin-4在食管腺癌中表达适度增加,而claudin-7在食管腺癌及正常食管上皮细胞中的表达未见明显差异。王军等[16]研究发现,食管腺癌组织中claudin-3 mRNA及claudin-3表达明显高于正常食管黏膜,而食管鳞癌组织中claudin-3 mRNA及claudin-3表达与正常食管黏膜相比变化不明显。同时有研究[17]发现claudin-2在食管腺癌中比Barrett食管中的表达更显著。
本研究中claudin-6 mRNA及claudin-6在食管鳞状细胞癌中的表达显著高于正常食管上皮组织,提示claudin-6高表达与食管鳞状细胞癌发生有关,与相关文献[9-10]报道类似。食管鳞状细胞癌组织中claudin-6及claudin-6 mRNA的表达在高、中分化组的阳性表达率明显高于低分化组,表明二者的表达与食管鳞状细胞癌组织分化程度有关。同时本研究发现claudin-6及claudin-6 mRNA的表达与食管鳞状细胞癌组织的浸润深度及淋巴结转无相关。食管癌发生发展的具体机制较为复杂,细胞间黏附结构的破坏和极性丧失是上皮细胞恶性转化的标志[12]。Claudins与细胞极性和细胞间黏附力有关,claudins家族不同成员在食管癌中表达不尽相同,claudin的表达缺失可导致肿瘤发生和发展。Kuo等[18]通过对食管鳞状细胞癌手术标本分析认为Nm23H1表达减少激活了Akt信号通路,从而使claudin-1表达减少,导致食管鳞癌细胞侵袭性增强。而claudins表达升高与肿瘤发生和发展的确切机制尚不清楚,有待进一步深入研究。
