和厚朴酚通过NF-κB信号通路抑制IL-1诱导的人肺癌细胞H460血管生成
2022-03-22成旭东于栋伟沈夕坤黄玉宇
成旭东,陈 婷,范 玲,林 梦,陈 汀,于栋伟,唐 樑,沈夕坤,黄玉宇
(1.南京中医药大学附属苏州市中医医院,江苏 苏州 215009;2.苏州市中西医结合医院,江苏 苏州 215101)
肺癌是临床发病率、死亡率最高的癌症[1]。虽然过去的几十年中在外科手术技术,放化疗和免疫治疗方面取得了长足的进步,肺癌的1年相对生存率已显著提高(从34%增至47%),但是IV期患者的5年相对生存率已降至4%。而61%肺癌患者被诊断时已经是Ⅲ或Ⅳ期[2]。因此亟需寻找合适的治疗肺癌的有效方法。
肿瘤血管生成与新血管的形成有关,新血管从血液中提供氧气和营养。不受控制的血管生成为肿瘤的增殖、侵袭和转移创造了有利条件[3]。肿瘤细胞是由微环境驱动的。微环境分泌与血管内皮细胞受体结合的多种促血管生成细胞因子。这导致内皮细胞活化,导致肿瘤细胞异常增殖和迁移[4]。因此,在临床实践中,血管生成可以代表针对肿瘤的有效治疗靶标。VEGF家族是参与肿瘤血管生成的主要的细胞因子。肿瘤细胞分泌的炎性细胞因子激活了细胞内信号转导通路[5]。因此,具有抑制肿瘤微环境炎性因子,抑制肿瘤血管生成的化合物可能具有良好的抑制肿瘤的效果。
和厚朴酚(honokiol,HNK)是从木兰植物的叶子和树皮中分离出来的木脂素。HNK具有广泛的药理作用,例如神经保护作用和抗炎作用。近年来,HNK阻断肿瘤增殖,诱导肿瘤细胞凋亡,控制肿瘤细胞迁移和侵袭的能力备受关注[6]。HNK对乳腺癌、结肠癌、胃癌、肺癌等癌症均具有一定的抑制作用[7]。因此,本研究探讨了HNK对肿瘤微环境炎性因子诱导的肺癌细胞血管生成的作用及潜在机制。
1 材料和方法
1.1 材料
1.1.1细胞株 H460细胞系获自中国科学院典型培养物保藏委员会细胞库。HUVEC细胞购自美国ATCC。
1.1.2药物与试剂 HNK(纯度>99%)购自中成都曼思特生物科技有限公司。Cell Counting Kit-8(CCK-8试剂盒,货号C0038)、重组人IL-1β(货号:P6470)、RIPA裂解液(货号:P0013B)、磷酸化蛋白酶抑制剂(货号:P1081)、BCA蛋白定量检测试剂盒(货号:P0012)、5×蛋白上样缓冲液(货号:P0015)购自碧云天生物技术有限公司。多聚甲醛(货号:C104190)和Triton X-100(货号:T109027)购自上海阿拉丁生化科技股份有限公司。BD Matrigel基质胶(货号:356234)购自美国BD 公司。Transwell小室(货号:CLS3470)购自美国Corning公司。RNA提取液(货号:G3013)、逆转录试剂盒(货号:G3330)、SYBR试剂盒(货号:G3322)购自武汉赛维尔生物科技有限公司。胎牛血清购自Gibco公司(货号10099-141)。抗体VEGF(货号:bs-0279R),NF-κB p65(货号:bs-0465R),p-IκBα(货号:bs-2513R),IκBα(货号:bs-1287R),p-IKKα(货号:bs-5399R)和IKKα(货号:bs-4880R)购自北京博奥森生物技术有限公司。GAPDH(货号:A19056)由武汉爱博泰克生物科技有限公司提供。蛋白Marker(货号:26616)购自Thermo公司。兔二抗和鼠二抗购自美国Jackson公司。常用试剂购自国药集团化学试剂有限公司。
1.1.3主要仪器 Heracell 150i CO2培养箱(美国Thermo Fisher公司);SW-CJ-1FD超净工作台(苏净集团苏州安泰空气技术有限公司);DMIL倒置显微镜(德国徕卡公司);IX73荧光倒置光学显微镜及图像采集系统(日本Olympus公司);Multifuge台式高速冷冻型微量离心机(美国Thermo Fisher公司);Stepone plus荧光定量PCR仪 (美国ABI公司);NanoDrop2000超微量分光光度计(美国Thermo Fisher公司);ME55/02电子天平(梅特勒-托利多仪器(上海)有限公司);Direct-Q 3纯水仪(美国Millipore公司);Multiskan Sky全波长酶标仪(美国Thermo Fisher公司);Eco-Mini电泳仪(德国耶拿公司);GelDoc XR Biorad 凝胶成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1CCK-8测定细胞活力 取对数生长期的人肺癌H460细胞,以1×103细胞/孔的密度接种在96孔板中,加入不同剂量的HNK(0、5、10、20、30、40或50 μmol·L-1)处理24、48和72 h。以含0.1%DMSO的完全培养基作为对照组。根据说明书将10 μL CCK-8溶液加入每个孔中,并在37 ℃下孵育4 h。使用酶标仪在450 nm的波长处测量吸光度。根据说明书公式计算细胞存活率。
1.2.2免疫荧光检测H460细胞VEGF表达 将H460细胞接种于带有载玻片的24孔板(1×105细胞/孔)中,并孵育24 h。用0.3 nmol·L-1的IL-1诱导H460细胞24 h,再加入10 μmol·L-1HNK溶液培养24 h,并用4%多聚甲醛固定15 min。用0.3%Triton X-100透化20 min,5%BSA封闭1 h,VEGF一抗4 ℃下孵育过夜。PBST洗片后,避光条件下FITC荧光二抗孵育1 h,然后DAPI染核。荧光显微镜下采集图像。
1.2.3实时定量PCR 测定H460细胞VEGF mRNA的表达 收集对数期生长的H460细胞,按5×105个/孔加入6孔板中,用0.3 nmol·L-1的IL-1诱导H460细胞24 h,再加入5、10、20 μmol·L-1HNK溶液培养24 h。利用TRIzol试剂提取H460细胞的RNA总量。随后,使用定量SYBR Green PCR试剂盒进行实时荧光定量。引物由武汉Servicebio公司合成,内参为GAPDH。使用比较Ct(2-ΔΔCt)进行VEGF mRNA数据分析。RT-PCR中使用的引物序列见Tab 1。

Tab 1 PCR primer sequence
1.2.4Western blot检测细胞蛋白水平的表达 用0.3 nmol·L-1的IL-1诱导H460细胞24 h,再加入5、10、20 μmol·L-1HNK溶液孵育H460细胞24 h。收集细胞,用RIPA缓冲液裂解10 min,4 ℃和14 000 r·min-1下离心10 min。以BSA为标准,BAC法测定蛋白浓度。每组30 μg蛋白10%SDS-PAGE凝胶电泳分离,并转移到PVDF膜上。5%脱脂奶中封闭2 h后,加入一抗,4 ℃孵育过夜,洗膜后,室温下孵育二抗1 h。孵育后,ECL发光,凝胶成像系统显影,分析各蛋白条带相对灰度值。
1.2.5HUVEC细胞划痕试验 取对数生长期的HUVEC细胞接种在含6孔板中,并培养24 h,直到形成单层融合细胞。用200 μL无菌移液器吸头划两条直线,PBS洗去细胞和碎片。用0.3 nmol·L-1的IL-1诱导H460细胞24 h,再加入10 μmol·L-1HNK和或PDTC培养H460细胞的条件培养基。使用倒置显微镜在0 h和24 h拍摄划痕的相同区域的代表性图像。测量划痕两端之间的距离,采用如下公式计算24 h细胞迁移率。

1.2.6HUVEC细胞侵袭测定 收集HUVEC细胞,无血清培养基制成1×108L-1的细胞悬液,接种在transwell上腔室中,加入IL-1诱导后HNK和或PDTC处理过的H460细胞的条件培养基中。下腔加入600 μL包含10%胎牛血清的完全培养基。继续孵育24 h。取出小室,擦去上室中未迁移的HUVEC细胞后,将迁移的细胞甲醇固定,并用结晶紫溶液染色20 min。倒置显微镜下随机选取5个视野,拍摄并计算细胞数目。
1.2.7HUVEC细胞毛细管形成试验 将50 μL基质胶涂在96孔板中,并在37 ℃孵育30 min以固化。将用HNK和或PDTC处理的H460细胞培养基培养的HUVEC(1×104细胞/孔)接种并孵育24 h。通过显微镜(Zeiss,Oberkochen,德国)观察毛细管。通过计数闭环或促血管生成结构来评估毛细管的形成。实验重复3次。

2 结果
2.1 HNK对H460细胞增殖活性的影响不同浓度HNK作用于人肺癌H460细胞24、48、72 h,采用CCK-8测定H460细胞增殖。结果如Fig 1A所示,随着HNK浓度的升高,其对H460细胞增殖的抑制明显增加(P<0.05)。表明HNK能够明显抑制H460细胞增殖,并且具有浓度和时间依赖性。计算得到不同时间HNK作用H460的IC50值,24 h为22.82 μmol·L-1,48 h为15.69 μmol·L-1,72 h为11.83 μmol·L-1。因此选择最大浓度为20 μmol·L-1的HNK处理24 h作为后续实验的条件。
2.2 HNK对IL-1诱导的H460细胞增殖活性的影响采用0.3 nmol·L-1IL-1处理H460细胞,模拟肿瘤微环境中的炎症状态的刺激作用。结果表明,IL-1明显提高了H460细胞的增殖能力(P<0.05)。同时可以观察到随着HNK浓度的升高,其对IL-1诱导的H460细胞增殖的抑制明显增加(P<0.05)(Fig 1B)。结果表明,HNK可以以时间和剂量依赖性方式降低肺癌细胞的活力。
2.3 HNK对IL-1诱导的H460细胞中VEGF mRNA水平的影响RT-PCR测定H460细胞中VEGF mRNA的表达水平。结果表明,IL-1明显增加了H460细胞中VEGF的mRNA水平,而HNK以浓度依赖的方式下调VEGF的mRNA表达(Fig 2)。
2.4 HNK对IL-1诱导的H460细胞中VEGF蛋白水平的影响Western blot结果表明,IL-1明显增加了H460细胞中VEGF蛋白的表达水平。加入HNK后,VEGF的表达水平明显降低,并且呈剂量依赖关系(Fig 3)。
2.5 HNK对IL-1诱导的H460细胞中VEGF免疫荧光强度的影响如Fig 4,免疫荧光实验中,H460细胞受到IL-1刺激后VEGF荧光强度明显增强,10 μmol·L-1HNK处理后VEGF荧光强度明显降低。

Fig 1 Inhibition of HNK on cell viability of H460 cells
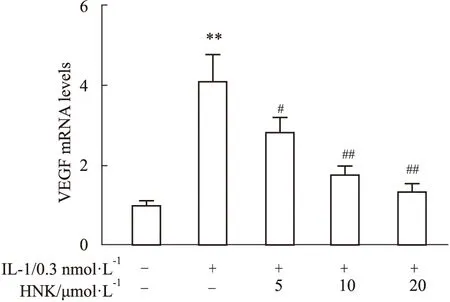
Fig 2 Inhibition of HNK on VEGF mRNA levels in H460 cells
2.6 HNK对NF-κB信号通路蛋白的影响采用Western blot测定HNK对H460细胞中NF-κB信号通路。结果表明,IL-1诱导的H460细胞中,p-NF-κB/p65、p-IκBα和p-IKKα表达明显增加,NF-κB/p65、IκBα和IKKα表达无明显变化。加入HNK后,p-NF-κB/p65、p-IκBα和p-IKKα表达水平明显降低。并且随着HNK浓度增加,p-NF-κB/p65、p-IκBα和p-IKKα表达抑制越明显。同时,HNK对NF-κB/p65、IκBα和IKKα表达影响不明显(Fig 5)。
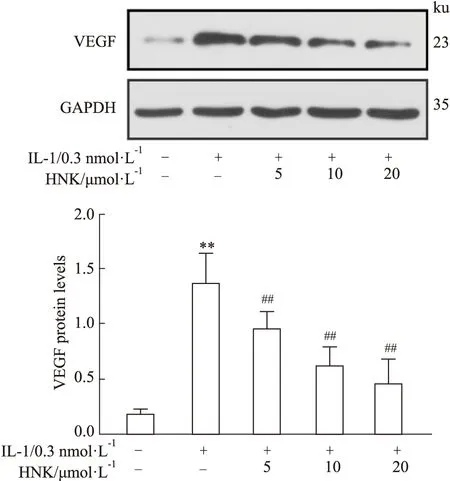
Fig 3 Effect of HNK on VEGF protein levels in H460 cells

Fig 4 Effect of HNK on VEGF expression in H460 cells detected by immunofluorescence
2.7 PDTC验证HNK通过NF-κB信号通路影响VEGF mRNA的表达应用NF-κB抑制剂PDTC验证NF-κB通路在HNK抑制VEGF中的调控作用。实验结果表明10 μmol·L-1PDTC降低H460细胞中IL-1诱导的VEGF的mRNA水平,并且HNK和PDTC的组合产生了更明显降低VEGF mRNA表达水平的效果(Fig 6)。
2.8 PDTC验证HNK通过NF-κB信号通路影响VEGF蛋白的表达Western blot结果表明,HNK和PDTC同样具有抑制IL-1诱导的VEGF表达,HNK与PDTC共同作用可以更明显地抑制VEGF表达水平(Fig 7)。结果证实了HNK通过NF-κB信号通路下调了用IL-1预处理的细胞中VEGF的表达水平。

Fig 5 Effect of HNK on NF-κB signaling pathway protein expression

Fig 6 HNK inhibited VEGF mRNA levels by NF-κB signaling pathway
2.9 HNK对HUVEC细胞增殖的影响不同浓度HNK作用于HUVEC细胞24 h,采用CCK-8测定HUVEC细胞增殖的影响。结果如Fig 8A所示,随着HNK浓度的升高,其对HUVEC细胞增殖的抑制增加,只有当HNK浓度高于20 μmol·L-1时才差异具有显著性(P<0.05)。

Fig 7 HNK inhibited VEGF protein levels by NF-κB signaling pathway
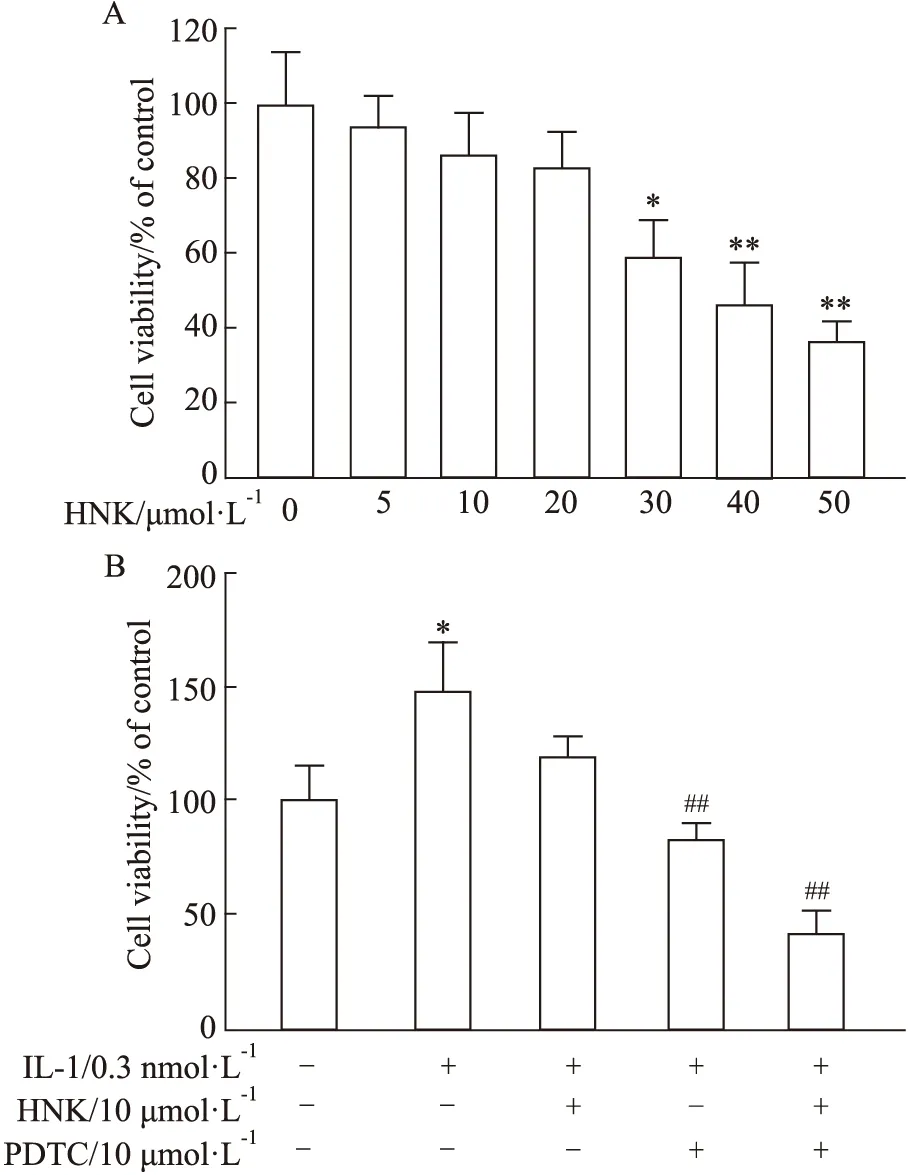
Fig 8 Inhibition of HNK on cell viability of HUVECs
IL-1诱导H460条件培养基可以诱导HUVEC细胞异常增殖,HNK与PDTC作用H460细胞的条件培养基对HUVEC具有一定抑制作用,当HNK和PDTC共同作用的条件培养基对HUVEC具有明显的抑制作用(P<0.01)(Fig 8B)。
2.10 HNK对HUVEC细胞横向迁移的影响划痕试验结果如Fig 9所示,IL-1诱导H460条件培养基可以诱导HUVEC细胞横向迁移,HNK与PDTC作用H460细胞的条件培养基对HUVEC横向迁移具有一定抑制作用,当HNK和PDTC共同作用的条件培养基对HUVEC的横向迁移具有明显的抑制作用(P<0.01)。

Fig 9 HNK inhibited HUVEC lateral migration through NF-κB signaling pathway
2.11 HNK对HUVEC细胞纵向迁移的影响Transwell试验结果见Fig 10,IL-1诱导H460条件培养基可以诱导HUVEC细胞纵向迁移,HNK与PDTC作用H460细胞的条件培养基对HUVEC纵向迁移具有一定抑制作用,当HNK和PDTC共同作用的条件培养基对HUVEC的纵向迁移具有明显的抑制作用(P<0.01)。
2.12 HNK对HUVEC细胞小管生成的影响如Fig 11所示,IL-1诱导的H460细胞培养基明显增加HUVEC的毛细管形成,而单独用PDTC或HNK处理的H460细胞的条件培养基加PDTC则可以抑制小管形成。HNK和PDTC共同作用的条件培养基对HUVEC的小管生成具有明显的抑制作用(P<0.01)。

Fig 10 HNK inhibited longitudinal migration of HUVECs through NF-κB signaling pathway
3 讨论
抑制血管生成是NSCLC靶向治疗的重要组成部分,受到了越来越多的临床关注[8]。肿瘤微环境中各种炎症刺激促进异常血管生成是肿瘤恶性病变的关键事件[9]。本研究证实了HNK可以通过调节NF-κB信号通路抑制肿瘤的血管生成。
IL-1是由肿瘤细胞或微环境中产生的促炎性因子之一,可以使炎症和免疫力之间的平衡趋向于诱导抗肿瘤反应[10]。IL-1与肺癌、卵巢癌、乳腺癌和其他癌细胞的黏附、侵袭和血管生成有关[11-12]。IL-1可以诱导H460细胞的异常增殖。HNK对IL-1诱导的H460具有明显的抑制作用。这些结果为HNK的后续评估和抗血管生成作用提供了基础。
VEGF是肿瘤血管生成的关键介质,可以通过表达癌基因,各种生长因子或缺氧来上调VEGF。VEGF通过直接作用于内皮细胞来诱导血管生成。此外,已经证明VEGF可以诱导血管内皮细胞浸润基础基质并形成毛细血管样小管[13]。VEGF增强内皮细胞的趋化性以及纤溶酶原激活物和胶原酶的表达[14]。因此,VEGF是血管生成的关键介质,因为它促进血管生长和重构,并促进内皮细胞的有丝分裂和存活。HNK抑制H460细胞中VEGF的合成,抑制肿瘤血管生成。
文献研究表明,抑制NF-κB调节VEGF的表达水平[15]。在缺氧胰腺肿瘤中,PKM2与NF-κB/p65相互作用以激活HIF-1α及其靶基因VEGF的转录,从而增加血管的形成,从而促进肿瘤的生长[16]。NF-κB可以调节HIF-1α并影响乳腺癌中VEGF的表达[17]。NF-κB天然抑制剂如山奈酚已被证明可通过ERK-NF-κB-cMyc-p21-VEGF途径抑制卵巢癌细胞的血管生成[18]。HNK抑制NF-κB信号通路主要蛋白NF-κB/p65、IκBα和IKKα激活,降低肺癌细胞中VEGF的表达。
总而言之,这项研究的数据表明,HNK可以降低肺癌的体外血管生成,其潜在机制是NF-κB信号通路。这些发现为进一步研究HNK在NSCLC的临床治疗提供了科学依据。
