Piezo1通过激活Src激酶介导高压诱导心房肌细胞电重塑
2022-03-22罗贯豪彭德威李路安李巧巧罗雪珊邓春玉薛玉梅吴书林
房 媛,李 倩,罗贯豪,彭德威,李路安,李巧巧,罗雪珊,邓春玉,薛玉梅,饶 芳,吴书林
(华南理工大学医学院,广东 广州 510006)
心房颤动(atrial fibrillation,AF)是临床上常见的心律失常之一,可导致血栓栓塞和心力衰竭等并发症,严重影响患者生活质量,已成为公共健康问题[1]。心房电重构是指心房肌细胞的电生理特性发生改变,是AF发生的主要病理机制之一[2],其主要内容包括心房有效不应期(atrial effective refractive period,AERP)和动作电位时程(action potential duration,APD)的缩短,频率适应性下降等。已有研究表明[3],ICa,L以及L型钙通道蛋白α1c亚单位(L-type calcium channel α1C,Cav1.2)表达在AF患者及AF动物模型中下降,与APD和AERP缩短密切相关。
流行病学研究显示[4],高血压是AF发生的重要心血管风险因素之一。然而,机械应力在AF发病中的作用尚未阐明。我们的前期研究发现,高静水压可通过诱导HL-1细胞ICa,L和Cav1.2表达下调导致心房肌细胞发生电重构,使AF易于发生[5]。但目前关于高静水压导致AF电重构的具体分子机制研究甚少。Piezo1是近年鉴定出的哺乳动物中的机械门控离子通道,可将机械力转变为生物信号参与细胞的机械转导[6]。在感知和调节血管机械压力方面起重要作用。血管内皮细胞上的Piezo1可介导流体剪切力引起的动脉扩张,以维持成年小鼠的基础血压[7]。拉伸力可激活小动脉平滑肌细胞的Piezo1,上调细胞中Ca2+浓度,影响高血压时小动脉血管结构重塑[8]。但Piezo1在心房肌细胞中的表达和功能研究有限。
c-Src编码膜相关的酪氨酸激酶,参与细胞生长和分化,亦可通过调控心房肌细胞ICa,L的通道功能参与AF的发生[9]。我们的前期研究提示Src参与了高静水压下心房肌细胞的ICa,L以及Cav1.2蛋白的表达下降。然而,压力激活Src的上游分子机制仍需进一步探究。本研究旨在探讨机械敏感性离子通道Piezo1在调控高静水压下心房肌细胞电重构中的作用并探索其可能的分子机制,为临床上高血压合并AF的防治提供新的思路。
1 材料与方法
1.1 实验动物及取材30~32周龄♂ SPF级SHR 16只,与之周龄、性别匹配的Wistar大鼠8只作为对照,购自北京维通利华,生产许可号为SCXK(京)2016-0006,质量检测单位为中山大学实验动物中心。经中山大学实验动物伦理委员会审核(SYSU-IACUC-2020-000220)。将SHR随机分为2组,SHR组和SHR+Val组(30 mg·kg-1·d-1),以及对照组Wistar大鼠,连续灌胃给药8周,每日1次。完成相关实验操作后进行取材,留取心房组织,-80 ℃保存。
1.2 主要试剂和仪器抗Cav1.2抗体(Alomone,ACC003AN4902);抗Piezo1抗体(Alomone,APC-087);抗Src抗体(AbcamAB47405);抗GAPDH抗体(Proteintech,075501);RIPA裂解液(Beyotime Biotechnology,3228972),一抗、二抗稀释液(Absin,D29A01),兔二抗/鼠二抗(CST,7074/7076);凝胶电泳装置(Bio-Rad);超灵敏化学发光成像仪(GE ImageQuant LAS500),P97拉制仪(Sutter,America),EPC10膜片钳放大器及附件(HEKA,德国)。
1.3 方法
1.3.1心房肌细胞株HL-1细胞的培养 HL-1细胞由William Claycomb教授(美国路易斯安那州立大学)惠赠。纤维连接蛋白和0.2 g·L-1凝胶预处理培养瓶,细胞培养于含10%胎牛血清、100 μmol·L-1去甲肾上腺素、2 mmol·L-1谷氨酰胺的Claycomb培养基中,置于37 ℃,5% CO2培养箱内孵育。定期显微镜下观察细胞密度及状态。每24~48 h换液1次。细胞密度长至60%-70%对细胞进行相应处理。使用本课题组自行研制的加压装置(专利号:20140109263.1,中国)对HL-1细胞进行高静水压造模,分别予以0、20、40 mmHg处理。
1.3.2Western blot实验 取黄豆大小动物左心耳组织标本,眼科剪剪碎和实验处理后的HL-1细胞,预冷PBS冲洗,加入含蛋白酶抑制剂的RIPA裂解液冰上裂解30 min。12 000 r·min-1离心15 min,留取上清。BCA法测定蛋白浓度,20~40 μg样本用中性裂解液及4×上样缓冲液配置成等上样体积,55 ℃或100 ℃加热10 min变性蛋白。10% SDS-PAGE电泳分离蛋白,恒压80 mV 电泳30 min 后转120 mV电泳,蛋白转至PVDF膜,恒流200 mA转膜2 h。5%脱脂牛奶TBST室温封闭1 h,一抗(目的蛋白1 ∶1 000,GAPDH 1 ∶5 000)4 ℃孵育过夜。次日用抗兔或抗鼠Ⅱ抗(1 ∶5 000),室温孵育1 h后TBST洗膜。ECL试剂盒显影蛋白条带,使用软件ImageJ测量目的蛋白与内参蛋白灰度值,进行统计分析。
1.3.3全细胞膜片钳记录 细胞消化贴壁1~2 h后进行膜片钳实验。采用两步法拉制玻璃电极,灌注电极内液指弹法排出气泡并将电极置于推进器上,控制电极尖端入液后的电阻在2~5 MΩ间,出现方波后补偿液接电位。细胞产生微小形变,方波跳动电阻微升时进行细胞封接,待高阻(阻抗>1 GΩ)封接稳定后,负压或电破膜形成稳定的全细胞状态,快慢电容及串联电阻补偿后,形成全细胞记录。通过EPC10膜片钳放大器记录信号。在电压钳模式下将细胞钳制在-40 mV,施以自-50~+50 mV,阶跃10 mV,波宽300 ms,频率0.2 Hz的刺激,测量并记录膜电容(membrane capacitance,Cm)及ICa,L,电流钳模式下测量并记录AP。使用Patchmaster软件控制命令电位并进行数据采集。使用Clampfit 10.4软件对单个记录进行数据测量。ICa,L细胞外液成分(mmol·L-1):TEA-Cl 140,CaCl2·2H2O 5,MgCl2·6H2O 2,Glucose·H2O 10,HEPES 10,用Tris将pH调至7.4。ICa,L细胞内液成分(mmol·L-1):Choline-Cl 126,CsCl 5.4,MgCl2·6H2O 1,NaH2PO4·2H2O 0.33,Glucose·H2O 10,HEPES 10,CaCl2·2H2O 2,用CsOH将pH调至7.4。记录AP的细胞外液成分(mmol·L-1):NaCl 136,KCl 5.4,MgCl2·6H2O 1,D-glucose 10,HEPES 10,CaCl2·2H2O 1.8,NaH2PO4·2H2O 0.33,用NaOH将 pH 调至7.4。记录AP的电极内液成分(mmol·L-1):KCl 140,MgCl2·6H2O 1,HEPES 10,EGTA 5,Na2-ATP 5,用KOH 使pH调至7.2。
2 结果
2.1 大鼠左心耳组织蛋白表达结果Western blot结果显示与对照组Wistar大鼠相比,SHR左心耳组织中的Cav1.2表达下降(P<0.01),而Piezo1(P<0.01)和Src的表达升高(P<0.05);缬沙坦干预后,可使SHR心房Cav1.2蛋白表达回升(P<0.05),Piezo1(P<0.01)和Src(P<0.05)蛋白表达下调(Fig 1)。提示高血压可诱导心房肌细胞电重构,Piezo1/Src信号通路可能参与相关病理过程。
2.2 高静水压对心房肌细胞电重构的影响通过自制的高压装置,为体外培养的心房肌HL-1细胞施予一定的高静水压(20或40 mmHg)负荷。全细胞膜片钳检测心房肌细胞APD和ICa,L,结果显示,相较于常压组,20 mmHg组的APD无明显改变(P>0.05,n=9/10),而40 mmHg组APD90(74.23±19.83 ms in 0 mmHgvs63.81±20.22 ms in 20 mmHg,及50.03±6.62 ms in 40 mmHg)、APD70(50.38±15.01 ms in 0 mmHgvs39.13±13.21 ms in 20 mmHg及29.42±4.60 ms in 40 mmHg),APD50(27.87±9.27 ms in 0 mmHgvs22.39±9.49 ms in 20 mmHg及16.97±4.04 ms in 40 mmHg)均明显缩短(APD50,APD90,P<0.05,APD70P<0.01,n=7 in 40 mmHg)(Fig 2A-B)。但3组间的动作电位幅值(action potential amplitude,APA)无明显改变(Fig 2C)。ICa,L的峰值电流密度呈压力依赖性的减少(峰值电压+10 mV时,-2.48±0.13 pA/pF in 0 mmHgvs-1.56±0.15 pA/pF in 20 mmHgvs-0.75±0.07 pA/pF in 40 mmHg,P<0.01,n=10/8/11 in 0 mmHg,20 mmHg及40 mmHg group)(Fig 2D-E)。
随压力梯度增加,Cav1.2蛋白表达降低(P<0.05 in 40 mmHg),而Piezo1和Src的蛋白表达明显增加(P<0.05,P<0.01 in 40 mmHg)(Fig 2F-G)。与动物模型的结果一致,表明高静水压可促进心房肌细胞电重构,表现为ICa,L减少且Cav1.2表达降低,APD缩短,Piezo1/Src信号通路可能在其中发挥作用。
2.3 Piezo1抑制剂GsmTx4可逆转高压条件下HL-1细胞的电重塑高压(40 mmHg)处理HL-1细胞前予Piezo1抑制剂GsmTx4(3.0 μmol·L-1)预处理1 h,记录心房肌细胞AP和ICa,L。结果表明,相较于40 mmHg加压组,APD90(50.03±6.62 ms in 40 mmHgvs72.25±21.94 ms in 40 mmHg+GsmTx4)、APD70(29.42±4.60 ms in 40 mmHgvs45.27±12.35 ms in 40 mmHg+GsmTx4)、APD50(16.97±4.04 ms in 40 mmHgvs27.87±9.32 ms in 40 mmHg+GsmTx4)均明显延长(P<0.05,n=9/7/11 in 0 mmHg,40 mmHg及40 mmHg+GsmTx4),APA无明显变化(Fig 3)。ICa,L的激活电位,锋电位以及反转电位无明显影响(Fig 4A-B),但ICa,L峰值电流密度明显增加(峰值电压+10 mV时,-2.48±0.13 pA/pF in 0 mmHgvs-0.75±0.07 pA/pF in 40 mmHgvs-1.88±0.15 pA/pF in 40 mmHg+GsmTx4,P<0.01,n=10/11/11 in 0 mmHg,40 mmHg及40 mmHg+GsmTx4)(Fig 4C),ICa,L的激活曲线和复活曲线在加压后负向移动,失活曲线在加压后正向移动,并均在加入抑制剂后逆转。但动力学上差异均无显著性(P>0.05)(Fig 4D-E)。
与电流结果一致,Cav1.2的表达在加入GsmTx4后回升(P<0.05)(Fig 4F),同时,Src表达明显下降(P<0.05)(Fig 4G-H)。提示Piezo1通过Src参与高压下ICa,L的下调。
2.4 Piezo1激动剂Yoda1模拟高压条件下Cav1.2表达的下调常压下给予不同浓度(1,3,10 μmol·L-1)的Piezo1特异性激动剂Yoda1处理HL-1细胞48 h,结果显示,与对照组(DMSO组)相比,Yoda1(10 μmol·L-1)可使Cav1.2的表达下调(P<0.01),而Src的表达上调(P<0.01)(Fig 5)。与上述高静水压处理结果一致。
3 讨论
本研究旨在探讨高静水压对心房肌细胞电重构的影响及可能的机制。我们发现,1)与Wistar大鼠相比,Piezo1和Src蛋白表达升高,而Cav1.2的蛋白表达下降。给予降压药物缬沙坦后上述指标均出现逆转。2)给予心房肌细胞HL-1细胞高静水压干预后,可使细胞的ICa,L和Cav1.2蛋白表达下调,APD缩短,Src激活;而抑制Piezo1可使心房肌细胞电重构得到改善;常压下激动Piezo1,心房肌细胞可发生类似于高压状态下心房肌细胞的电重构及相关信号分子的改变。表明高压状态下,新型机械力敏感性离子通道Piezo1可激活Src,引起ICa,L以及Cav1.2表达下降进而引心房电重构。
尽管高血压和AF之间的流行病学联系已经确立,但高血压患者AF易感性增加的发病机制仍不完全清楚[10]。体内心血管系统主要承受3种力学刺激,血流对细胞表面产生的摩擦力-剪切应力,搏动的血流使血管扩张和回缩产生的牵张力,以及血流对单位面积血管壁的侧压力(即血压),也称为静水压[11]。高血压患者左室舒张功能受损,左心房压力升高,其主要的机械应力变化为静水压和牵张力的增加。单个心房肌细胞受到的拉伸和压力增加,是心房重构过程的主要刺激因素[10]。在多种高血压动物模型中,证实高血压可引起心房结构重构及电重构,从而增加房性心律失常的易感性[12-13]。但机械力学在其中所起的直接作用及其相关分子机制远未阐明。目前,已有的机械力学在AF发病细胞机制方面的研究多关注牵张力,却忽略了压力和容量负荷所致的高压负荷这一重要致病因素。高静水压导致心房肌细胞电重构,进而导致AF的研究较少。
AF的电重构是指心房肌电生理特性发生改变。1995年,心房电重构的概念首次被Wijffels等[14]提出,即“房颤致房颤”假说。房颤维持的心房重构因素包括APD和AERP缩短,心房不应期频率适应不良等。L型钙通道以及ICa,L下降与APD的缩短密切相关[15]。我们的前期研究显示,炎症和高静水压可通过诱导ICa,L和Cav1.2表达下降导致心房肌细胞电重构,使AF易于发生[16]。但细胞如何感知静水压力的升高并发生下游一系列重构效应目前尚未完全阐明。
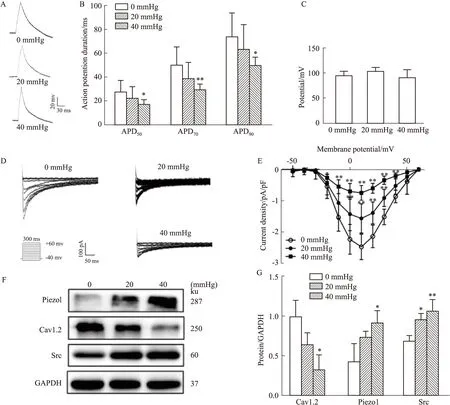
Fig 2 Effect of high hydrostatic pressure on ion channel remodeling and expression of Piezo1 and Src in HL-1

Fig 3 Effects of GsmTx4 on APD in HL-1 cells after high hydrostatic pressure

Fig 4 Effect of GsmTx4 on electrophysiological properties of ICa,L and protein expression of Cav1.2 in HL-1 cells after high hydrostatic pressure

Fig 5 Effect of Yoda1 on protein expression of ion channel Cav1.2 and Src in HL-1
机械敏感性离子通道是一种能够感受细胞膜机械力变化,将机械信号转化为电信号或化学信号的离子通道。新型离子通道Piezo是新近鉴定出来的哺乳动物机械门控离子通道,包含Piezo1和Piezo2两个结构类似的蛋白。不同于Piezo2在感觉组织中表达,Piezo1主要在暴露于流体压力的非感觉组织中表达,广泛参与血管发育、动脉重塑和血压调节等病理生理过程中[7-8]。但其在心房肌细胞中的表达和功能研究有限,现有研究也仅关注了牵张力[17]。因此,本研究以高血压大鼠和HL-1细胞为研究对象,探究Piezo1是否在机械应力增加(高静水压)所致心房肌细胞电重塑中起作用。本研究发现,Piezo1在高压情况下表达上调,且激动Piezo1可模拟高压情况下的电重塑改变,而加入Piezo1抑制剂后钙电流以及蛋白表达的改变发生逆转,虽然电流的峰值大小在加压以及加入抑制剂后发生相应的变化,但是通道动力学表现上各组间均无明显差异,提示ICa,L下降是通道蛋白表达量的下降所致。上述结果表明Piezo1通过下调L型钙通道蛋白的表达参与了高压下心房肌细胞的ICa,L下降,进而引起心房肌细胞电重塑。
Src激酶家族是一些具有酪氨酸蛋白激酶活性的蛋白质,在细胞增殖和分化等功能中发挥重要作用。虽然其在致癌中的作用已得到广泛的研究,但在心律失常中的重要作用研究甚少[18]。我们的前期研究提示,高静水压下Src参与L型钙通道的表达下降以及ICa,L的下降,引发电重构最终导致AF的发生。本研究结果发现,激动Piezo1可激活Src,而抑制Piezo1则逆转其激活,证明了Src可作为Piezo1的下游,参与心房肌细胞的电重构。但是,Piezo1对其具体的激活机制尚需进一步的探究。
综上所述,本研究证实了Piezo1通过激活Src参与高压下心房肌细胞ICa,L的下降,引起心房肌细胞电重构进而促进AF的发生。
(致谢:本实验研究在广东省人民医院医学研究部心血管药理实验室进行,在此非常感谢各位实验室成员对本实验研究所付出的艰辛努力。)
