核苷酸结合寡聚化结构域样受体蛋白3炎症小体在PCOS中的研究进展
2022-03-21高晴鱼文欢何佳静张学红
高晴,鱼文欢,何佳静,张学红*
(1.兰州大学第一临床医学院,兰州 730000;2.兰州大学第一医院,兰州 730000;3.甘肃省生殖医学与胚胎重点实验室,兰州 730000)
多囊卵巢综合征(PCOS)是一种常见的生殖内分泌疾病,同时也是一种异质性疾病,是育龄期女性不孕的主要原因,以月经异常、排卵障碍、高雄激素为主要临床表现。PCOS的发病机制至今尚未阐明,一些学者认为PCOS与炎症[1]密不可分。随着炎症小体逐渐成为研究热点,越来越多的证据表明,核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体参与PCOS的发生发展。
NLRP3炎症小体是一种位于细胞内的多蛋白复合物,可促进白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)等炎症因子的成熟、释放。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白(ASC)和含半胱氨酸的天冬氨酸水解酶-1前体(Pro-caspase-1)组成[2]。NLRP3炎症小体在受到相应刺激后,Pro-caspase-1可成为活化的Caspase-1,进而将Pro-IL-1β及Pro-IL-18转化为有活性的IL-1β及IL-18[3],并在炎症反应中发挥重要作用。目前,关于NLRP3炎症小体在PCOS中的研究较少,NLRP3炎症小体的深入研究可为PCOS的发病机制及诊疗提供新思路。
一、NLRP3炎症小体的概述
炎症小体是近些年来新发现的一种参与机体炎症反应的多蛋白复合物[4],在固有免疫中发挥至关重要的作用,通常由受体蛋白、ASC和Pro-caspase-1组成。根据受体蛋白的不同,炎症小体主要分为NLRP1、NLRP3、包含半胱天冬酶募集结构域(CARD)的NOD样受体蛋白4(NLRC4)、NLRP6、黑色素瘤缺乏因子2(AIM2)、干扰素γ诱导蛋白16(IFI16)等。根据是否依赖ASC,炎症小体又可分为依赖ASC的炎症小体,包含NLRP3、NLRP6、AIM2、IFI16等;不依赖ASC的炎症小体,包含NLRP1、NLRC4等。当前研究最为广泛、最为深入的炎症小体是NLRP3炎症小体,其由NLRP3、ASC和Pro-caspase-1构成。其中,NLRP3蛋白包含3个结构域[5]:位于中间的核苷酸结合寡聚化结构域(NACHT)、识别配体的富亮氨酸重复区域以及连接ASC的热蛋白结构域。ASC蛋白主要由热蛋白结构域和CARD结构域两部分组成;效应器蛋白Pro-caspase-1包括CARD结构域和效应结构域两部分(图1)。
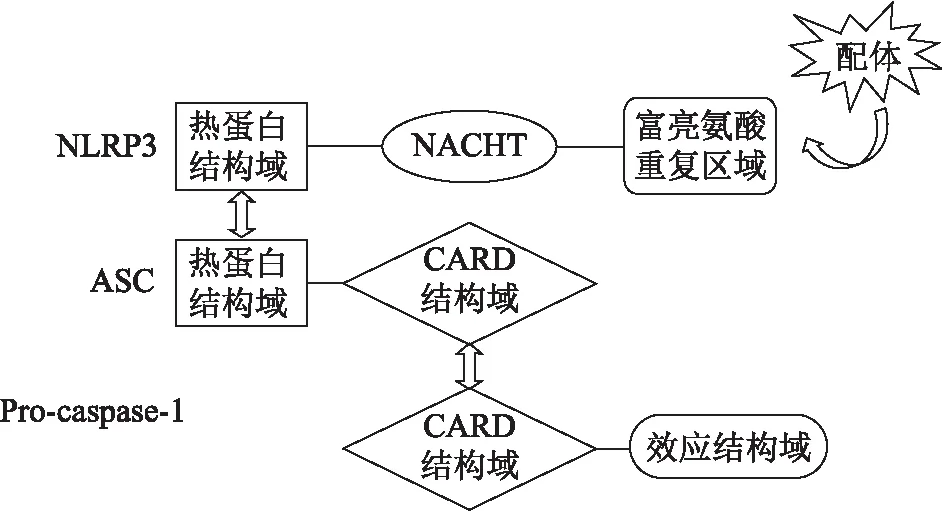
图1 NLRP3炎症小体的结构示意图
NLRP3炎症小体作为一种炎症介质,参与体内的炎症反应,并与一些疾病的发生发展关系密切[6]。NLRP3炎症小体是一种存在于胞质内的多蛋白复合体,广泛存在于人体的多种细胞中,当机体受到刺激时可以介导炎症反应。目前,学者普遍认为,NLRP3炎症小体的活化分为启动和激活两个阶段[7]:第一阶段为启动阶段,即机体在受到如脂多糖(LPS)[8]、细菌或病毒核酸、三磷酸腺苷(ATP)、尿酸等病原相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)的刺激时,通过作用于Toll样受体(TLR),从而激活核因子(NF-κB)信号通路[9],进而介导NLRP3蛋白、Pro-IL-1β及Pro-IL-18等转录;第二阶段为激活阶段,即在受到各种激活剂刺激后,NLRP3蛋白的NACHT区域寡聚化,同时,NLRP3的热蛋白结构域与ASC的同型结构域连接,而ASC通过CARD与Pro-caspase-1相结合,进而组装成结构形式为NLRP3-ASC-Pro-caspase-1的NLRP3炎症小体,从而介导下游级联放大的炎症反应。与此同时,Pro-caspase-1通过自我剪切可形成活化的Caspase-1,有活性的Caspase-1可使Pro-IL-1β及Pro-IL-18成熟、释放,参与体内的炎症反应。除此之外,Caspase-1也可剪切消皮素D(GSDMD)并使其激活,活化的GSDMD使细胞膜形成孔隙,致使细胞内外分子进出失衡、细胞肿胀,从而释放大量IL-1β、IL-18等炎症因子,进而引发炎症反应并诱导细胞焦亡[10]。NLRP3炎症小体启动、激活过程见图2。

图2 NLRP3炎症小体启动、激活过程示意图
NLRP3炎症小体可被多种不同的刺激物激活,然而其具体的激活机制尚未阐明,当前普遍认为NLRP3炎症小体的激活途径有以下几种:活性氧(ROS)升高、K+外流、Ca2+的信号传导以及溶酶体破裂等。Zhou 等[11]研究发现,抑制线粒体呼吸链的复合体从而提高ROS水平时,NLRP3炎症小体会发生自发性激活,由此推断,线粒体来源的ROS可激活NLRP3炎症小体,进而介导炎症反应。此外,K+外流被认为是NLRP3炎症小体激活的共同通路。He 等[12]研究发现,NLRP3炎症小体的大多数激活物可以通过诱导K+外流,降低胞内K+浓度,促进NLRP3炎症小体的激活。Youm 等[13]研究发现,β-羟丁酸可减少K+外流,抑制斑点形成及ASC聚合,从而抑制NLRP3炎症小体激活。有证据表明,在类风湿性关节炎患者中,Ca2+浓度升高并触发钙敏感受体信号通路,增强巨噬细胞吞噬胶体钙蛋白颗粒的作用,从而诱导NLRP3炎症小体激活,增加IL-1β释放[14]。Zhou 等[15]研究发现,在动物体内溶酶体破裂能够促进NLRP3炎症小体以及IL-1β的激活。
二、NLRP3炎症小体在PCOS中的作用
PCOS是一种常见的内分泌疾病,发病率可高达17%,多伴有肥胖,因排卵障碍导致育龄期不孕,其常见的并发症包括心血管疾病[16]、2型糖尿病[17]等。PCOS病因较为复杂,其发病机制至今尚不明确,然而,越来越多的证据表明,炎症在PCOS的发生发展中起到了关键作用。
PCOS患者的慢性低度炎症主要源于内脏脂肪的堆积[18]。当PCOS患者中的脂肪细胞缺氧坏死时会聚集大量炎细胞,产生大量炎症因子[19],其炎症因子水平可显著高于正常妇女。此外,PCOS患者的NIMA相关蛋白激酶7(NEK7)和NLRP3的表达水平也显著高于正常妇女[20],因此,我们推断炎症与PCOS密切相关。Rostamtabar等[21]研究发现,PCOS患者的NLRP3炎症小体、AIM2炎症小体、炎症小体组分(Caspase-1和ASC)以及下游炎症标志物IL-18的表达水平均显著高于正常妇女,且IL-18的表达水平与NLRP3炎症小体的表达水平呈显著正相关。研究表明,炎症小体可能通过NLRP3、AIM2的途径激活,进而诱导炎症小体相关组分上调,从而在PCOS的发病机制中发挥重要作用。PCOS小鼠模型中Toll样受体4(TLR4)、NLRP3炎症小体以及下游炎症因子IL-1β的表达水平显著升高,该PCOS模型小鼠表现为卵巢颗粒细胞焦亡,卵泡成熟障碍并导致排卵障碍[22]。与此相反,在使用NLRP3炎症小体ATP酶抑制剂INF39后,NLRP3、ASC等的表达被显著抑制。由此推测,PCOS经由TLR4信号通路,激活NLRP3炎症小体,促进IL-1β等炎症因子的表达,诱导卵巢颗粒细胞焦亡、卵巢间质纤维化,从而影响卵泡发育成熟,导致排卵障碍,不孕风险增加。TLR4通路介导NLRP3炎症小体激活进而参与PCOS进程,而NLRP3抑制剂可显著抑制这一过程。因而,NLRP3的靶向治疗可为减轻PCOS的炎症状态及改善排卵提供一个新的研究方向。
1.NLRP3炎症小体在卵泡微环境方面的作用:PCOS的主要临床表现之一是卵巢呈多囊样改变,出现稀发排卵或不排卵等排卵障碍的情况。PCOS患者的外周血及卵泡液中IL-1β和IL-18等炎症因子含量显著增加,其中,卵巢颗粒细胞分泌的炎症因子是卵泡微环境的主要成分[23]。细胞内的炎症反应破坏了线粒体的结构和功能,并诱导氧化应激、影响细胞代谢,同时抑制细胞增殖;此外,炎症反应也可导致卵母细胞质量下降、卵泡过早闭锁、排卵功能障碍[24]。Liu等[25]研究发现,PCOS患者卵泡液中IL-1β和IL-18表达水平均显著升高,TLR4、NLRP3、IL-1β、ASC、Caspase-1蛋白含量均显著增加。进一步研究显示,用PCOS患者的卵泡液处理KGN细胞后,KGN细胞中NF-κB活化标志物的磷酸化P-65蛋白水平升高,同时,NLRP3及IL-1β的mRNA水平也显著升高,除此之外,PCOS患者颗粒细胞线粒体呈碎片化且ROS含量增加,诱导了氧化应激并抑制细胞增殖。线粒体的结构和功能受损可抑制细胞增殖、影响卵泡发育、导致卵泡过早闭锁、排卵障碍。由此我们推测,PCOS患者卵泡液中的炎症因子通过NF-κB通路产生NLRP3炎症小体,后者可诱导颗粒细胞焦亡、卵巢纤维化;同时,颗粒细胞线粒体功能失调可影响卵泡发育成熟、抑制排卵和细胞增殖。抑制炎症小体激活、改善卵泡微环境,对提高PCOS患者的生育力具有十分重要的意义,可为PCOS患者的治疗提供新的研究方向。
2.NLRP3炎症小体在卵巢纤维化方面的作用:在PCOS的病理机制中,排卵障碍是导致不孕的主要原因,而卵巢纤维化可能造成了PCOS患者稀发排卵或不排卵[26]。PCOS患者卵泡数量增加、卵巢被膜增厚、结缔组织增多、纤维化相关因子表达增强,NLRP3炎症小体激活后,可在一定程度上促进卵巢组织纤维化,进而诱导排卵障碍[22]。因此,通过抑制NLRP3炎症小体的激活,可抑制卵巢组织纤维化,或许能够缓解PCOS患者排卵障碍的情况。
三、NLRP3炎症小体相关治疗
1.相关心理障碍的治疗:PCOS患者不但表现为月经失调、不孕、多毛、痤疮等特征,而且心理障碍的患病率也显著增高。越来越多的证据表明,炎症广泛参与抑郁症等心理疾病[27],心理障碍发作时,下丘脑-垂体-肾上腺轴可以合成IL-1β、IL-6和TNF-α等炎症因子[28],因此,通过抑制PCOS患者的炎症状态或许可缓解其心理障碍。Guo等[29]的一项前瞻性研究发现,吡格列酮二甲双胍复方制剂(PM)能显著改善PCOS患者焦虑和抑郁的严重程度,此外,PM还能有效降低NLRP3和Caspase-1的表达,减少IL-1β、IL-6和TNF-α等炎症因子的释放。研究认为,PM对于改善PCOS患者的炎症状态具有显著作用,PM可通过抑制NLRP3炎症小体的激活从而减轻PCOS患者的心理障碍,然而,其机制尚未阐明。阐明PM抑制NLRP3炎症小体的作用机制,对PCOS患者心理障碍的治疗具有重要意义,值得我们进一步研究。
2.相关肠道微生态失衡的中医药治疗:改善生活方式、调整月经周期等方法可以改善PCOS患者的病情,近期研究发现,中医药治疗也对PCOS患者具有重要意义。PCOS与肠道微生态的关系是当前研究的热点[30],徐雪飞等[31]研究发现,在PCOS小鼠模型中结肠组织的TLR4、NF-κB、NLRP3、Caspase-1、IL-1β等炎症相关蛋白表达显著上调;在卵巢组织内,卵泡数量增加、颗粒细胞减少、卵泡膜增厚。燮和饮的应用除了可降低模型小鼠结肠组织中炎症因子的表达外,还可减轻小鼠体重、减少卵巢组织中闭锁卵泡的数量,促进其排卵。因此,燮和饮可通过调控肠道中的TLR4/NF-κB/NLRP3通路,减轻体重、下调炎症因子表达、抑制肠道的炎症反应、改善肠道微生态环境、诱导PCOS患者排卵。上述研究表明,NLRP3炎症小体可能参与了PCOS的发病过程,抑制NLRP3炎症小体可改善PCOS患者的炎症状态并诱导排卵;除此之外,研发能够抑制NLRP3炎症小体或其通路形成的药物,可为PCOS提供新的治疗选择。
四、展望
PCOS病因复杂,至今尚未明确其发病机制,随着对PCOS不断深入的研究,炎症与PCOS之间的关系越来越受到关注。NLRP3炎症小体作为一种炎性蛋白,因其与多种疾病密切相关,近年来成为研究的热点。NLRP3炎症小体在PCOS中扮演重要作用,参与PCOS的发生发展,而针对NLRP3炎症小体的作用通路进行干预,可改善PCOS的炎症状态、减轻PCOS的症状,但其具体的作用机制尚未阐明。在今后的研究中,探究NLRP3炎症小体在PCOS中的作用调节机制,可为我们提供新的探索方向,除此之外,NLRP3炎症小体还可作为PCOS新的治疗靶点,为PCOS靶向药物的研发提供理论基础。
