乳腺癌内分泌治疗情况下的子宫内膜息肉和异常子宫出血
2022-03-21于佳乐邓姗
于佳乐,邓姗
(1.鄂尔多斯市中心医院妇产科,鄂尔多斯 017000;2.中国医学科学院 北京协和医学院 北京协和医院妇产科学系,疑难重症及罕见病国家重点实验室, 国家妇产疾病临床研究中心,北京 100730)
病例资料
刘*,46岁,未婚,有性生活,未生育。主因“左乳腺癌保乳术后3年余,发现子宫内膜息肉1月余”入院。
患者既往月经规律。2017年因左乳浸润性导管癌行左侧乳腺癌保乳切除术+左侧腋窝淋巴结清扫术;术后病理:可见一枚淋巴结转移;雌激素受体(ER)+、孕激素受体(PR)+、人类表皮生长因子受体2(HER-2)-;后续给予放疗30次+化疗6次(至2018年3月26日结束)。2017年9月开始至今每28 d给予皮下注射促性腺激素释放激素激动剂(GnRH-a,诺雷德)1针(最后一针于2021年3月24日注射),2018年5月开始加服枸橼酸托瑞米芬(商品名法乐通)治疗至今,曾短期停药但出血量多,于是继续服用,服药情况下持续闭经至今。2021年2月4日体检妇科B超示:子宫5.9 cm×6.1 cm×5.2 cm,内膜厚约0.3 cm,宫底部见高回声1.2 cm×1.1 cm×0.5 cm;多发子宫肌瘤(较大者位于右侧壁,大小约3.8 cm×3.2 cm×3.1 cm),无阴道出血、流液等不适。肿瘤标志物AFP、CA19-9、CEA、CA125、CA15-3均正常;生殖激素水平(注射GnRH-a期间):卵泡刺激素(FSH)1.41 U/L、孕酮(P)0.41 nmol/L、黄体生成素(LH)<0.2 U/L、泌乳素(PRL)28.5 ng/ml、雌二醇[E2(Ⅱ)]<55 pmol/L。
患者2000年于外院行腹腔镜下子宫肌瘤剔除术;2005年因“甲状旁腺腺瘤”行双侧甲状旁腺瘤切除术;2008年根据基因检测结果诊断为多发性内分泌腺瘤病Ⅰ型(MEN-Ⅰ),定期复查胰腺内分泌瘤和可疑垂体微腺瘤,PRL曾有轻度升高,2021年2月2日复查PRL正常。
入院后完善相关术前检查,诊断为“子宫内膜息肉、乳腺癌保乳术后(左侧)、多发性内分泌腺瘤病Ⅰ型”。考虑患者的乳腺癌病史,单纯切除息肉后不适合采用避孕药具对内膜进行长期管理,原拟同时行热球子宫内膜去除术,但宫腔镜术中探宫腔深13 cm,宫腔形态尚规则,内膜丰厚,右侧宫角处2枚息肉,最大约1.5 cm,超出热球治疗仪适应证范围,故单纯行息肉切除(图1)。术后病理符合子宫内膜息肉,另可见少许平滑肌组织,免疫组化CD138(-)。后经专业组集体讨论,患者可知情选择子宫切除术以免除日后的异常子宫出血问题。
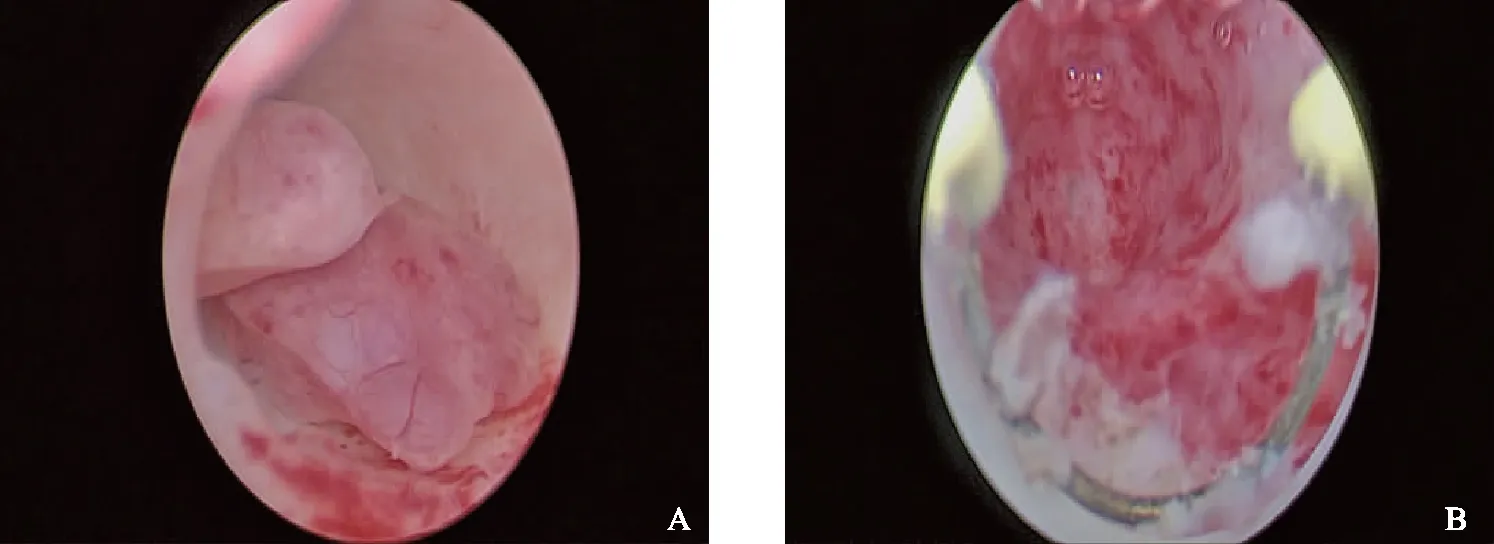
A:右侧宫角处2枚息肉;B:切除息肉后输卵管开口可见
病例警示
一、法乐通用于乳腺癌内分泌治疗的用药机制,以及对子宫内膜的影响
法乐通是枸橼酸托瑞米芬(toremifene,TOR)的商品名,与我们熟悉的克罗米芬和他莫昔芬(tamoxifen,TAM)一样,也属于非类固醇类三苯乙烯衍生物。此类衍生物属于雌激素受体调节剂(SERMs),与雌激素受体结合,可产生雌激素样或抗雌激素作用,或同时产生两种作用,主要取决于疗程长短、动物种类、性别和靶器官不同等因素。一般来说,非类固醇类三苯乙烯衍生物在人和大鼠中主要表现为抗雌激素作用,在小鼠身上则表现为雌激素样作用。TOR与雌激素竞争性地与乳腺癌细胞浆内雌激素受体(ER)相结合,阻止雌激素诱导的癌细胞DNA合成及增殖,还可通过ER-α介导与逆转乳腺癌耐药蛋白的启动子上游调控序列结合,负性调节乳腺癌耐药蛋白的表达,抑制乳腺癌耐药蛋白的功能,在体外有效逆转多药耐药的反应。除抗雌激素作用外,TOR还可能通过其它机制,如改变肿瘤基因表达、分泌生长因子、诱导细胞凋亡及影响细胞动力学周期等对抗乳腺癌[1]。
一直以来,TAM是乳腺癌内分泌治疗的标准用药。TOR是在上个世纪90年代末才被FDA批准用于ER阳性的绝经后转移性乳腺癌患者,是相对新的抗雌激素药。在最初世界范围内的Ⅲ期临床试验中,TOR对于转移性乳腺癌的疗效和安全性均与他莫昔芬相当,两种药长期使用均有低胆固醇血症(显著降低患者的总胆固醇和低密度脂蛋白胆固醇,还能显著增加高密度脂蛋白胆固醇水平)的效应。TAM的应用历史更长,证据提示其具有可保持骨密度、减少心脏事件以及轻度增加子宫内膜癌风险的特点,但TOR在这些方面的表现则需要看后期的临床证据。另外,由于TOR与TAM具有交叉耐药性,并不能做为TAM治疗失败的二线药物[2]。
2012年Cochrane数据库发表了TOR与TAM治疗晚期乳腺癌的比较性综述[3],纳入了涉及2 026例患者的7项RCT,其中TOR组1 226例、TAM组835例。两组的客观反应率、进展时间和总体生存率均无统计学差异;两组常见的不良反应包括潮热、出汗、恶心、阴道分泌物、头晕、水肿、呕吐等均无显著差异,但TOR组的头痛发生率比TAM组少(RR=0.14)。总体结论是TOR可以作为TAM的一种合理替代药品。
TOR与TAM的药代动力学特征和代谢途径不同,可能对绝经前、激素受体阳性、早期浸润性乳腺癌女性具有治疗优势,TOR组的无复发生存率显著高于TAM组,但TOR组的潮热反应更大[3]。此外,与芳香化酶抑制剂(AIs)相比,由于SERMs在骨和脂质水平上的选择性雌激素效应以及不同的副作用,TOR有时也可替代AIs。2014年有一篇关于20年使用经验的综述[4],文中指出:TOR治疗绝经后激素受体阳性乳腺癌的疗效和安全性与TAM相似;TOR对于绝经后激素受体阳性转移性乳腺癌患者的疗效和来曲唑相似;高于标准剂量的TOR可能对AIs治疗失败的患者有效,甚至对TAM治疗期间肿瘤进展的患者也有效。
马大昌等[5]的Meta分析纳入了3项随机对照试验共计3 084例患者,结果显示,TOR导致子宫肥大、子宫内膜增厚的药物剂量是TAM的40倍以上,也就是说TOR在内膜的雌激素效应明显弱于TAM。Goss等[6]也显示卵巢切除后动物使用TOR,子宫内膜癌的风险没有增加;Niwa等[7]基础研究提示,TOR可能是通过降低细胞原癌基因c-fo、ER-α、白细胞介素-1α 的表达,促使核糖核苷酸的雌二醇-17β诱导蛋白表达,进而降低ER-β、ER-α表达,减少了雌激素对子宫内膜刺激。另外,TOR无引发肝癌的风险,可能与其自身氧化机制有关[1]。
二、子宫内膜去除术用于乳腺癌患者的临床应用原则
子宫内膜去除术是通过宫腔镜手术方法破坏子宫内膜的基底层,造成子宫内膜不可逆的去除而达到治疗良性子宫内膜病变及其异常子宫出血(AUB)症状的一种手段,比传统的子宫切除术创伤性更小。
1.适应证:适用于治疗绝经前长期月经过多的女性,也可用于药物治疗有禁忌证或无效,血流动力学稳定的急性AUB。由于可能干扰后续对子宫内膜病变的评估,应在术前行子宫内膜采样,除外子宫内膜增生症或子宫内膜癌。美国妇产科医师协会(ACOG)推荐子宫内膜增生症或子宫癌患者不应当接受子宫内膜去除术[8-9]。
乳腺癌是典型的雌、孕激素依赖性肿瘤,因此所有含雌、孕激素的药物均视其为禁忌证。乳腺癌的治疗是以手术为主、放化疗和内分泌治疗为辅的综合方案。所谓内分泌治疗是采用抗雌激素制剂,如TAM、TOR等SERMs或AIs,可明显降低乳腺癌的复发率及死亡率。TAM是绝经前ER阳性乳腺癌术后患者的一线抗雌激素药物,由于TAM在子宫内膜可能存在弱雌激素效应,在口服TAM治疗的乳腺癌术后女性中,大约18%~33%的患者发生子宫内膜异常,其中子宫内膜息肉是最常见的类型,但也有部分恶变的风险,需要警惕和监测[10]。
在接受TAM治疗的乳腺癌患者中,宫腔镜下息肉切除术联合子宫内膜去除术可预防子宫内膜息肉复发。Gao等[11]对子宫内膜去除术后患者的随访研究显示:76例患者中只有4例在3年以上的随访期间表现为复发性子宫内膜息肉;宫腔镜下息肉切除加子宫内膜去除术后,可改善绝经后出血等症状;此外,息肉切除术联合子宫内膜去除术可能会减少阴道出血和异常超声检查结果,从而减少或避免侵入性操作。
2.禁忌证:妊娠、已知或怀疑有子宫内膜增生症或子宫内膜癌、希望保留生育力、活动性盆腔感染、有宫内节育器(IUD)、经子宫肌层的子宫手术史。
3.相对禁忌证:绝经后女性、有先天性子宫畸形(如双角子宫)的女性、宫腔深度超过10~12 cm的女性或重度子宫肌层变薄的女性。
