腺水螨属部分物种DNA条形码分析
2022-03-21吴萍萍印海锋宋绍萱
张 旭,吴萍萍,王 琪,印海锋,宋绍萱
(淮北师范大学 生命科学学院,安徽 淮北 235000)
0 引言
腺水螨属Lebertia Neumank,1880隶属于蜱螨亚纲Acari,真螨总目Acariformes,绒螨目Trombidiformes,前气门亚目Prostigmata,大赤螨总股Anystides,寄殖螨股Parasitengonina,水螨亚股Hydrachnidiae,腺水螨总科Lebertioidea[1].腺水螨属种类分布广泛,遍及各大地理区系的淡水水体中,是底栖节肢动物的重要组成部分.腺水螨的幼螨寄生于蚊、蠓等卫生害虫体表,影响寄主的生长发育甚至造成寄主死亡.因而腺水螨可以被用作害虫的生物防治[2].目前世界已记录腺水螨种类300余种,但由于腺水螨属种类体型微小(0.5~2 mm),形态构造复杂,传统的形态学鉴定需要对螨体解剖,操作过程繁琐,不仅耗时较长,且对鉴定者的专业水平要求较高.
DNA条形码是Herbert在2003年提出的生物分子鉴定技术,该技术是利用生物体内线粒体细胞色素氧化酶Ⅰ(Cytochrome c oxidase subunit I,COⅠ)基因序列的差异实现对物种的快速鉴定[3].该技术对鉴定者的专业背景没有特别的要求,鉴定过程简单,省时.近年来DNA条形码技术在动物物种鉴定方面得到广泛发展,特别是体型较小,形态特征构造复杂,利用常规的形态学鉴定较为困难的无脊椎动物[4].目前,国内外对于腺水螨属的研究多集中在形态分类上,而关于腺水螨属的分子鉴定技术还未曾有报道.本研究是以GenBank上获取腺水螨属的16个物种93条的COⅠ序列为研究材料,通过分子序列的分析,探究DNA条形码技术在腺水螨属鉴定中的可行性,为以后腺水螨属的快速鉴定提供理论依据.
1 材料与方法
1.1 材料来源
在GenBank数据库中,以腺水螨属和COⅠ基因为关键词搜索,为提高数据的可信度,选择已经有文献支持并公开发表序列,剔除物种信息不明的种类(仅选择包含详细的种名和属名的物种).最终下载腺水螨属16个物种93条序列(样品信息详见表1)[5-8].

表1 样品信息
1.2 序列分析
用MEGA 7.0软件对93条COⅠ序列进行比对,将冗余序列删除,计算碱基组成、变异位点、保守位点、简约信息位点;运用DAMBE 6.4.67软件对序列饱和度进行分析,横坐标为TN93模型校正距离,纵坐标为碱基替代频率,进行散点分析;基于K2P(Kimura-2-Parameter)模型计算种内、种间遗传距离;以Sperchonopsis ecphyma(Genbank登录号:MF124252)和Sperchon rostratus(Genbank登录号:MF124257)为外群选择邻接法(Neighbor-joining,NJ)构建系统发育树,采用Bootstrap值进行1 000次重复检测验证树上各节点的支持率.运用ABGD软件,在一定的遗传距离范围内对样本进行划分.将93条COⅠ序列提交至ABGD网站,种内差异先验值P为0.001到0.1,最小相对gap宽度值X(minimum relative gap width)为0.6,steps值设为20.
2 结果与分析
2.1 碱基序列特征
使用MEGA 7.0软件对93条COⅠ序列进行比对后,最终保留608 bp的同源序列,序列中没有缺失或者插入的现象.T、C、A、G的平均含量分别为34.1%、18.9%、31.8%、15.2%,C+G的含量(34.1%)小于A+T的含量(65.9%),这与节肢动物序列特征相似,有明显的碱基偏好性.特别是在第3位密码子A+T含量高达85.2%,G含量的平均值仅有3.5%,C含量的平均值与A、T相比也较低,为11.3%.保守位点、变异位点和简约信息位点的含量为387个、221个、212个,在608 bp位点中分别占63.65%、36.35%和34.87%,变异位点大多数在第3核酸位点.
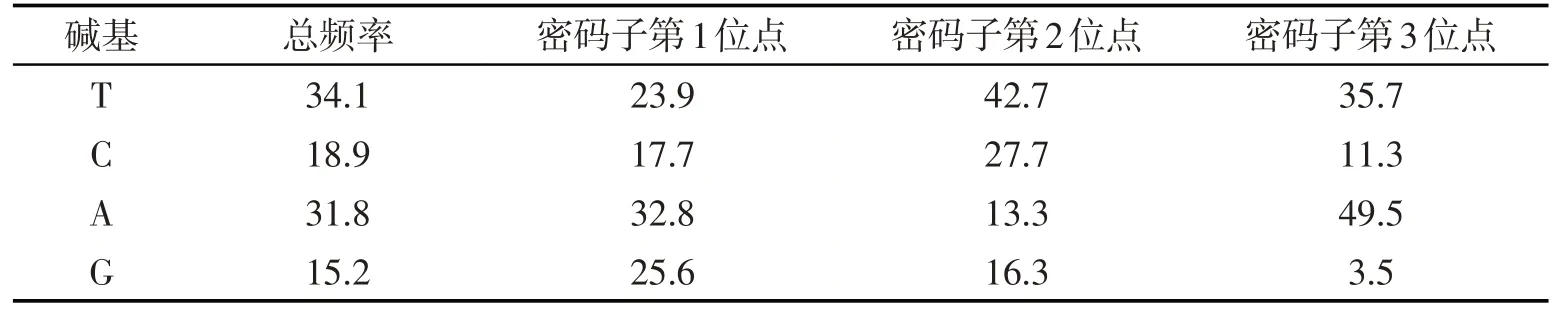
表2 16种腺水螨93条COⅠ基因序列碱基序列特征 %
2.2 碱基替换分析
应用MEGA 7.0软件进行碱基替换分析,在16种腺水螨的93条序列中,核苷酸替换多数为一致替换,为524个,转换数(S)和颠换数(V)的比值为1.1,颠换数和转换数的平均值分别为41和44.在第1、2、3位点的转换数和颠换数的比值为3.9、10.5、0.8.转换和颠换主要发生在第3位点,转换数为31个,频率总数为72.0%;颠换数为37个,频率总数为92.5%.通过DAMBE 6.4.67软件进行序列饱和度分析,饱和度分析散点图(图1)表明,遗传距离与碱基替换频率呈线性增加的关系,没有出现饱和态趋势,可以建立系统发育树.
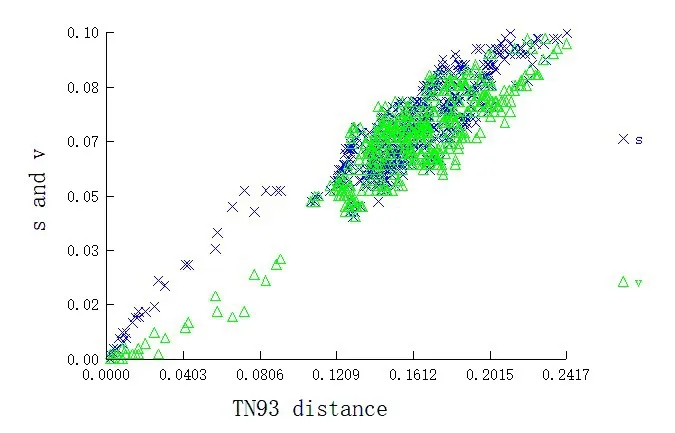
图1 基于CO I基因序列碱基替换饱和度
2.3 遗传距离分析
在MEGA 7.0软件中,基于K2P(Kimura-2-Parameter)模型计算16种腺水螨的种内、种间遗传距离,结果显示(见表3),种内遗传距离变动范围0~0.07,其中种内遗传距离大于2%的有2种,分别为L.porosa0.07和L.schechteli0.023,其余种内遗传距离均小于2%.种间遗传距离变动范围为0.025~0.218.除L.porosa和L.schechteli外,其余物种的种间平均遗传距离为0.147,种内平均遗传距离为0.003,种间平均遗传距离是种内平均遗传距离的49倍.
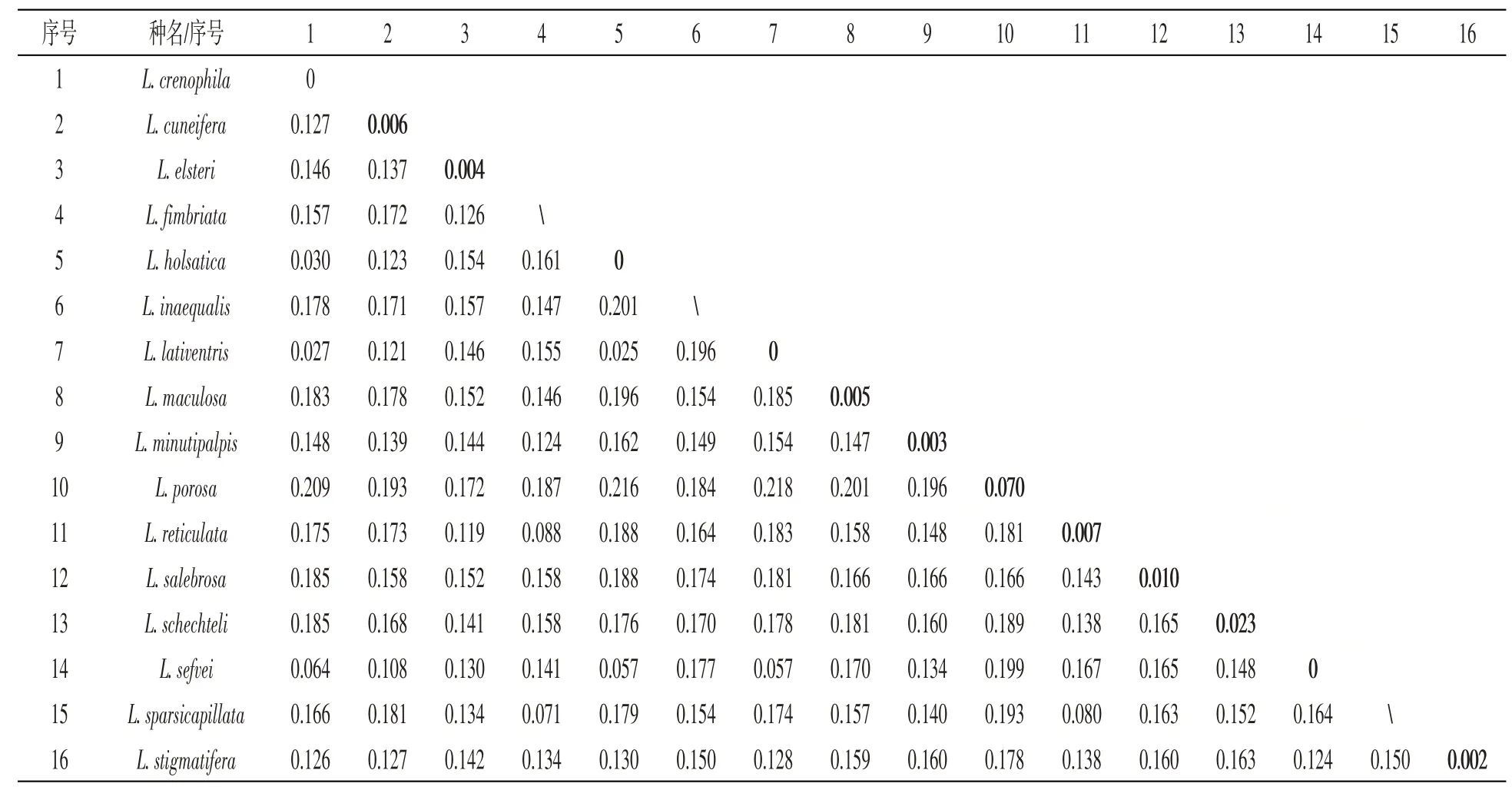
表3 基于COⅠ基因序列16种腺水螨的种内和种间的遗传距离
2.4 ABGD的评估结果
93条序列ABGD的评估结果显示,ABGD法可以明显出现条形码间隙(图2a).物种划分结果见图2b,包括初始划分和递归划分,初始划分较为稳定,遗传距离在0.001~0.100之间,被划分为13个物种,少于形态学分类结果,而递归划分结果显示,遗传距离在0.001、0.001 274、0.001 624时支持27个物种;在0.002 069、0.002 637时,支持24个物种;在0.003 360、0.004 281、0.005 456时,支持23个物种;在0.006 952时,支持22个物种;在0.008 859时,支持21个物种;在0.011 288时,支持20个物种;在0.014 384、0.018 330、0.023 357时,支持19个物种;在0.029 764、0.037 927时,支持16个物种;在0.048 329、0.061 585时,支持15个物种;在0.078 476、0.100 000时,支持13个物种.P值在0.014 384、0.018 330、0.023 357时,和邻接法系统发育树所评估的物种数量相同.
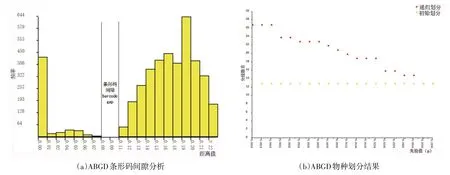
图2 基于ABGD腺水螨属部分物种分析结果
2.5 系统发育树的构建
在MEGA 7.0软件中以Sperchonopsis ecphyma和Sperchon rostratus作为外群[9],以NJ法构建系统发育树,结果显示(见图3),除L.porosa聚集为3支外,其余不同的物种均能聚为单系,例如L.schechteli的12条序列、L.maculosa的7条序列、L.salebrosa的4条序列、L.reticulata的3条序列等均以100%的高支持率聚集为一支.
ABGD所划分的物种与NJ所构建的系统发育树稍有区别(图3).ABGD除将L.porosa划分为3个组外,还将L.schechteli划分为2个组,其余划分与形态结果一致.
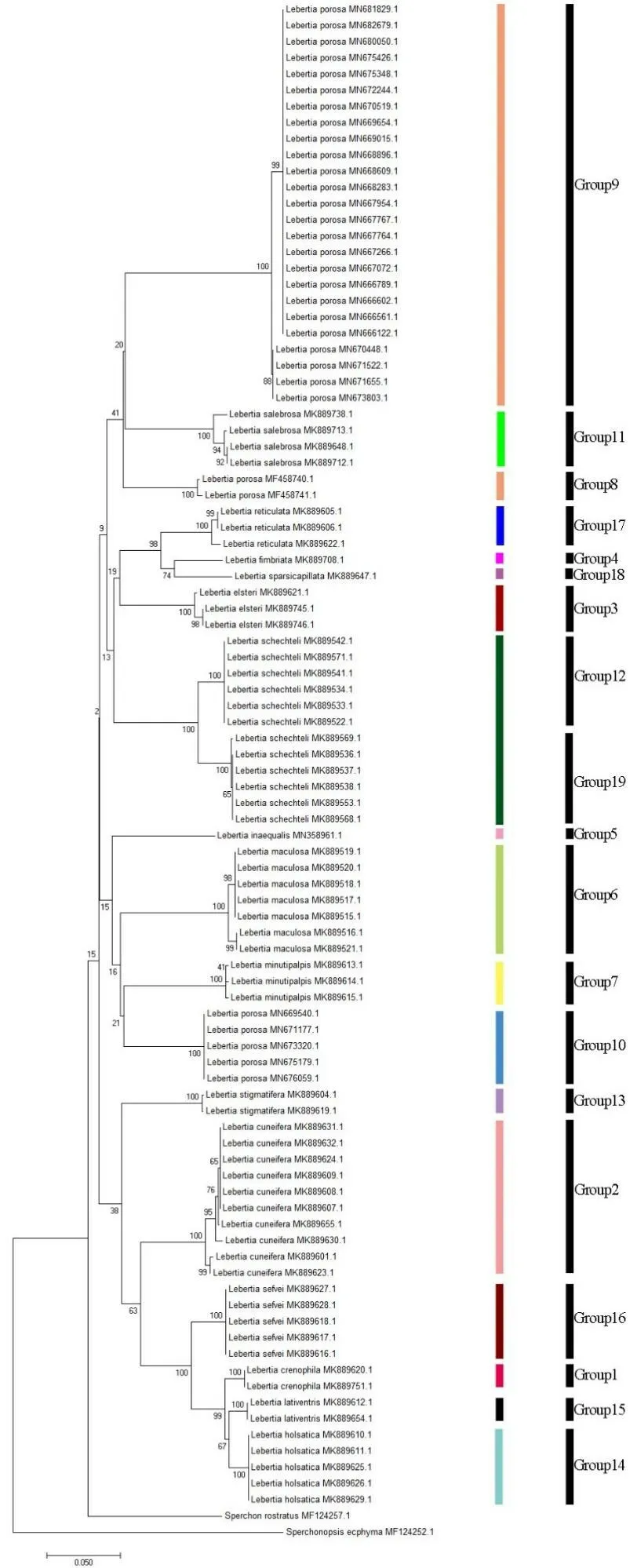
图3 NJ系统发育树和ABGD划分结果
3 讨论
水螨亚股Hydrachnidiae是蜱螨亚纲中一类体型微小,形态构造复杂的类群.近年来,随着分类人员队伍的萎缩,水螨的形态鉴定面临着更大的困难.DNA条形码技术的出现,为解决这一困难提供可能.目前,水螨类群中的Brachypodopsis、Krendowskia、Koenikea、Hygrobates、Sperchon等已经开始使用DNA条形码进行辅助鉴定,并取得较好的效果[10-13].然而,腺水螨属的DNA条形码研究未曾开展.本研究利用Genbank中下载的腺水螨93条COI基因序列进行DNA条形码的分析,探讨其在腺水螨类群中适用性.
Hebert对DNA条形码研究后曾提出,动物种内遗传差异2%的阈值和种间差异为种内差异10×的标准[3,14].本研究的16种腺水螨中,L.porosa和L.schechteli的种内遗传距离大于2%,其余物种的种内遗传距离均小于2%,仅L.porosa和L.schechteli不符合Hebert提出2%的阈值.除L.porosa和L.schechteli外,种间平均遗传距离是种内平均遗传距离的49倍,符合10×的标准.
为继续验证COI基因是否可以应用于腺水螨属的DNA条形码序列,本研究应用ABGD软件进行物种划分并构建系统发育树.ABGD对物种的划分结果显示,可以形成明显的条形码间隙,并将L.porosa划分为3个组,L.schechteli划分为2个组.系统发育树的结果显示,除L.porosa分为3个分支外,其余的物种均能以100%的高支持率聚为单独的一支.系统发育树的划分结果和ABGD对物种的划分结果基本相同.
由遗传距离、系统发育树和ABGD的分析结果来看,本研究所使用的16种腺水螨,除L.porosa和L.schechteli,其余腺水螨均能够使用COI基因片段作为DNA条形码进行区分.Pešić等[10-11]通过分子序列的研究已经证实,在Hygrobates和Brachypodopsis等水螨物种中可能存在隐存种,本研究中的L.porosa和L.schechteli遗传距离大于2%,在系统发育树中分为不同的分支,ABGD划分为不同的物种,这些均显示L.porosa和L.schechteli中可能存在隐存种.如果要进一步确定隐存种,还需要更多的形态研究和分子数据分析.
DNA条形码技术发展至今已经成为形态学鉴定的有效补充,本研究的结果也证明DNA条形码可以用于腺水螨属的物种鉴定.但本研究所涉及的物种数有限,是否能够适用于所有的腺水螨,还需要后续深入的研究.同时,也要注意在进行DNA条形码分析时不能完全脱离形态分类研究,两者相辅相成,才能促进分类学的发展[15].
