脑小血管病负荷预测轻型急性脑梗死静脉溶栓后不良预后
2022-03-21刘勇林陈仰昆
刘勇林,陈仰昆
1广东医科大学研究生院,广东 湛江 524000;2东莞市人民医院神经内科,广东 东莞523000
急性脑梗死(ACI)是最重要的致死、致残原因之一[1]。应用重组组织纤溶酶原激活剂进行静脉溶栓(IVT)仍是治疗发生在4.5 h内的ACI的有效方法[2-3]。既往研究显示,轻型ACI的比例高达54.6%[4],约30%的轻型ACI患者接受IVT治疗后预后不良[5-7]。明确与轻型ACI患者IVT后不良预后相关的因素非常重要。年龄、糖尿病状态、基线美国国立卫生研究院卒中评分(NIHSS)[8]和大动脉狭窄[9]已被报道与ACI接受IVT治疗不良预后有关。在轻型ACI中,由于NIHSS评分较低,导致预后不良的神经功能障碍的权重可能降低。因此,除了NIHSS评分外,潜在的危险因素可能在轻型ACI的预后中发挥更重要的作用。
脑小血管疾病(CSVD)在老年群体中很普遍,是脑卒中和血管性认知障碍的常见原因[10-11]。脑白质高信号(WMHs)、腔隙性脑梗死(LI)、脑微出血和血管周间隙扩大(EPVS)是CSVD负荷的神经影像学标志物[12]。既往研究表明,总体CSVD负荷是ACI不良预后的危险因子[13-16]。WMHs严重程度被认为是ACI患者接受IVT治疗后不良预后的危险因素[17-18],CBMs被认为与IVT后出血转化有关[19]。但国内有研究发现,脑白质高信号而非脑小血管病总体负担与急性缺血性卒中患者转归相关[20]。治疗时间窗内的轻型ACI仍适合IVT[21],但是否对轻型ACI进行再灌注治疗,对卒中医生来说仍是一个富有挑战性的抉择[22]。目前暂无关于CSVD负荷与轻型ACI患者IVT后预后关系的研究。本研究旨在探讨总体CSVD负荷及各CSVD影像标记与轻型ACI患者IVT后3月不良预后的关系。
1 资料与方法
1.1 一般资料
纳入2015年1月~2019年10月入住东莞市人民医院接受重组组织纤溶酶原激活剂静脉溶栓治疗的ACI患者。轻型ACI定义为入院时基线NIHSS≤7分[23]。纳入标准:年龄18岁;MR确诊的ACI;发病于4.5 h内并接受重组组织纤溶酶原激活剂治疗;发病前改良Rankin评分(mRS)≤1;基线NIHSS≤7 分;完成磁敏感成像(SWI)。排除标准:弥散加权成像未发现急性病变;IVT后桥接血管内治疗;随访失访。
研究期间,共有405名ACI患者在卒中发作4.5 h内接受重组组织纤溶酶原激活剂静脉溶栓治疗。405例患者中有220例患者被诊断为轻度ACI,在这220例患者中,有59例患者因以下原因被排除:卒中前mRS评分≥2(n=2),未完成SWI扫描(n=36),桥接血管内治疗(n=10),随访失访(n=11)。故最终纳入161 例患者。161例患者中,男性117例(72.7%),平均年龄60.8岁,3月不良预后患者29例(18.0%)。本研究样本的人口学和临床特征(表1),1例典型病例(图1)。本研究经医院伦理委员会批准(伦理号:KYKT2018-002)。所有受试者均按照《赫尔辛基宣言》获得知情同意。

图1 一例77岁男性患者的影像学表现Fig.1 Imaging finding of a 77-year-old male patient.

表1 人口学与临床特征Tab.1 Demographic and clinical characteristics of the study sample(n=161)
1.2 资料收集
临床资料主要收集人口统计学数据,包括年龄、性别、高血压史、糖尿病、吸烟、房颤和既往卒中、NIHSS评分以及实验室检查资料等。所有患者均于发病72 h内完成头颅MR(3.0 T,Skyra,Siemens Medical,Germany)检查,包括T1WI、T2WI、液体衰减反转恢复成像(FLAIR)、弥散加权成像、SWI和磁共振血管成像。
1.3 影像变量定义
影像变量由2位经验丰富且擅长神经影像的神经内科医生分别独立测量,当结果不一致时,2位医生对病例进行讨论,直至达成一致结论。
1.3.1 LI 定义为位于基底节、内囊、半卵球形或卵圆形病变,直径3~15 mm,于T2WI上信号接近于脑脊液,FLAIR上边缘为高信号[12]。
1.3.2 WMHs 根据Fazekas标准,WMHs定义为脑室周围和深部白质在T2WI和FLAIR上呈异常高信号,包括脑室旁高信号和深部白质高信号,并根据严重程度,将脑室旁高信号和深部白质高信号各分为0~3级[24]。
1.3.3 CMBs 定义为小的、圆形或椭圆形的低信号,在T2*加权梯度回波序列和SWI 上可见,但在T1WI、T2WI及FLAIR上不可见[12]。
1.3.4 EPVS 定义为小的(直径<3 mm)点状或线样病变,信号强度在所有序列中与脑脊液信号强度相似,FLAIR上无高信号边缘[12]。
1.3.5 总体CSVD负荷 根据Staals等[25]标准评估总体CSVD负荷。符合下列一项得1分:(1)深部白质高信号≥2级或脑室旁高信号3级;(2)存在至少1个LI;(3)存在至少1个CMB;(4)在基底节区的EPVS达到中-重度[26]。
1.3.6 症状性颅内动脉狭窄 磁共振血管成像评估下病灶侧颈内动脉或大脑中动脉M1段直径狭窄>70%[27]。
1.4 病例随访
对入组患者进行随访,并在发病后90 d通过面对面访谈或电话访问,评估其mRS。良好预后和不良预后分别定义为mRS≤2和≥3。
1.5 统计学分析
采用SPSS20.0软件对数据进行统计分析。符合正态分布的定量资料以均数±标准差表示,组间比较行t检验;非正态分布的变量以中位值(四分位间距)表示,组间比较行秩和检验、卡方检验或Fisher精确检验。以P<0.05为差异有统计学意义。将单变量分析中P<0.05的变量纳入二元多变量Logistic回归。
2 结果
2.1 单因素分析
选取年龄、性别、基线NIHSS、高血压病史、糖尿病病史、吸烟史、房颤、缺血性卒中史、入院时血糖、症状性颅内动脉狭窄、CSVD影像标记包括LI、WMHs、CMBs、EPVS及总体CSVD负荷纳入单因素分析,结果显示:基线NIHSS(P<0.001)、房颤(P=0.032)、症状性颅内动脉狭窄(P=0.003)、WMHs(P=0.044)和CMBs(P=0.038)与轻型ACI静脉溶栓后3月不良预后有关(P<0.05),而LI(P=0.102)、EPVS(P=0.060)及总体CSVD 负荷(P=0.114)与不良预后无相关性(P>0.05,表2)。
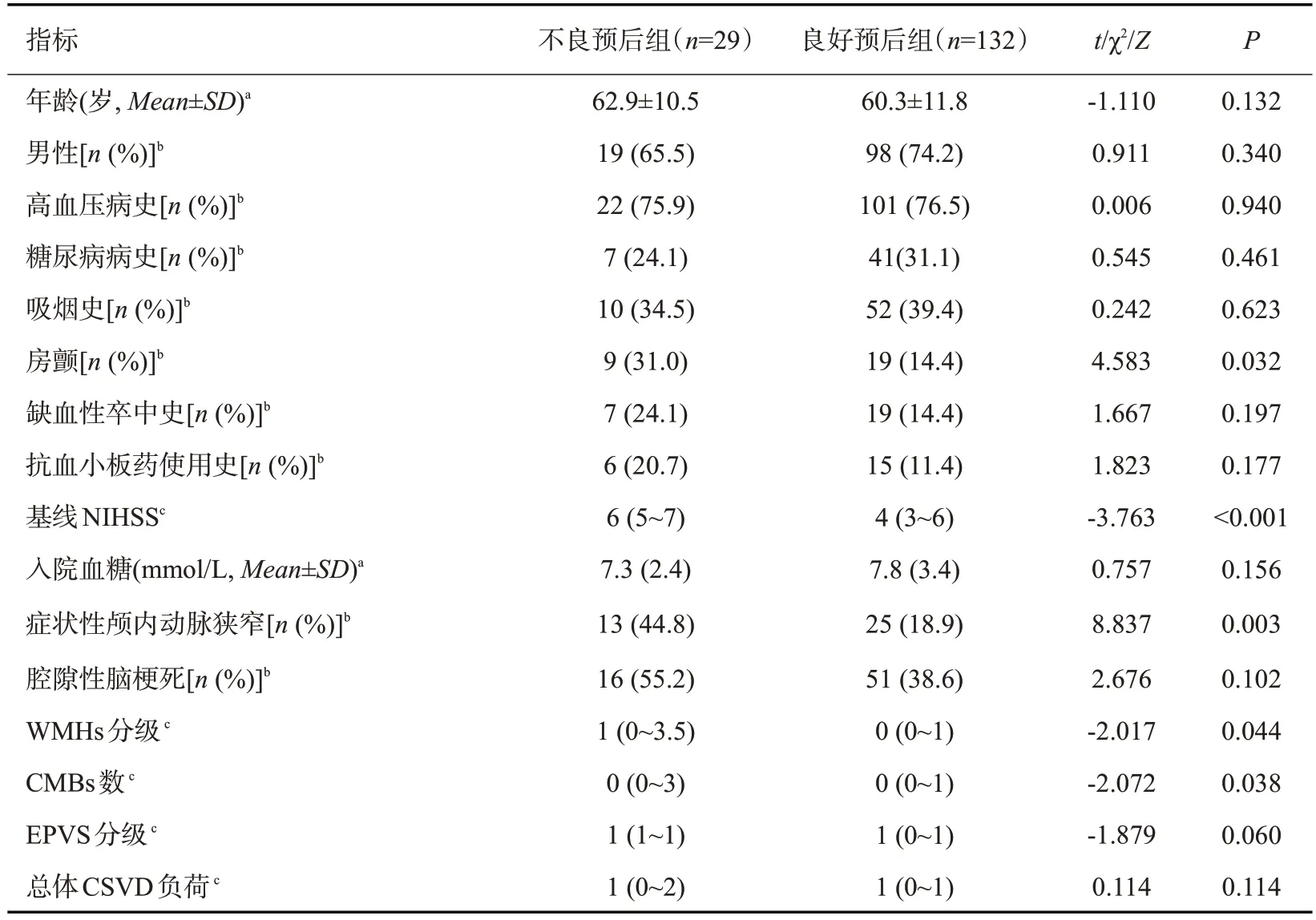
表2 轻型ACI静脉溶栓后3月不良预后危险因素的单因素分析Tab.2 Risk factors of 3-month poor outcome in univariable analysis
2.2 Logistic回归分析
将单因素分析中P<0.05的参数纳入Logistic回归方程。因WMHs和CMBs高度相关(r=0.414),故分别将WMHs及CMBs进入两个二元Logistic回归方程模型。在模型1中,基线NIHSS评分(OR=1.601,95%CI:1.203~2.130,P=0.001),症状性颅内动脉狭窄(OR=2.658,95%CI:1.013~6.978,P=0.047)和WMHs(OR=1.449,95%CI:1.033~2.031,P=0.032)与轻型ACI静脉溶栓后3月不良预后相关;在模型2中,基线NIHSS评分(OR=1.650,95%CI:1.232~2.210,P=0.001),症状性颅内动脉狭窄(OR=3.732,95%CI:1.435~9.702,P=0.007)和CMBs(OR=1.242,95%CI:1.062~1.452,P=0.007)与轻型ACI静脉溶栓后3月不良预后相关(表3)。

表3 轻型ACI静脉溶栓后3月不良预后危险因素的Logistic回归分析Tab.3 Multivariate logistic regression of predictors for 3-month poor outcome
3 讨论
目前CSVD负荷与卒中预后的关系仍有争议,一些研究表明,总体CSVD负荷及其影像表型与不良预后有关[13-17];但一项对820例经IVT治疗ACI的分析表明,CSVD影像标记的存在与3月的总体临床结局无关,但增加了有症状的颅内出血的风险[28]。本研究发现,WMHs严重程度和CMBs数目是轻型ACI静脉溶栓后3 月不良预后危险因子,而总体CSVD 负荷和LI 及EPVS与不良预后之间无显著关系。
WMHs作为一种CSVD的表型,在老年人中较为常见,60岁以上的老年人中,WMHs的检出率为50%~98%[29]。WMHs主要发生于侧脑室旁和深部白质,其发病机制与低灌注缺血和小动脉硬化有关[30]。随着动脉疾病和WMHs的严重程度的发展,微血管循环和侧支循环的自我调节能力被极大地破坏,最终损害脑组织对缺血的抵抗力,减少再灌注,并且损害血脑屏障[10,31]。IVT治疗增加ACI患者血脑屏障的破坏,增加出血转化和血管性水肿的风险[32],这提示存在WMHs,尤其是中-重度的WMHs患者接受IVT治疗,不良预后风险增加[18]。有证据表明,中度至重度WMHs可能与皮层神经元死亡、严重脱髓鞘、少突胶质细胞和星形胶质细胞减少,导致神经元和白质纤维减少,进而导致脑神经网络系统功能障碍有关[33],这将大大影响神经功能的恢复。同时,严重的WMHs可能导致主动运动减少和认知功能损害,这妨碍了ACI患者的积极康复和功能恢复[15]。
既往研究显示,高CMBs负荷与卒中复发、医院死亡和血管性痴呆的增加有关[34-36]。病理上,CMBs反映含铁血黄素的巨噬细胞在脂纤维透明质病的血管周围生成[37];同时,CMBs 的存在预示着新的CMBs 的发展[38]。超过3个CMBs的存在与血管性痴呆密切相关[36],额叶皮质下环路的CMBs是血管性认知功能损害向痴呆转化的预测因子[39]。认知障碍的存在使ACI不良预后的风险增加近2倍[40],这可能是CMBs影响ACI静脉溶栓预后的原因之一。CMBs负荷增加与预后不良有关另一原因可能与损伤了脑连接,妨碍了神经功能恢复有关[19]。本研究发现,CMBs数目与轻型ACI的不良预后有关,与既往研究结论相符[41]。
总体CSVD负荷于本研究的单因素分析中未发现与轻型ACI静脉溶栓后3月的不良预后相关,这可能与该模型的计分方式有关,因该模型没有根据LI和CMBs的数目设置不同的权重分。
综上,WMHs和CMBs是轻型ACI静脉溶栓后3月不良预后的预测因子。本研究的创新性体现在:首先,本研究探讨CSVD影像标记与轻型ACI接受IVT后3个月预后的关系;其次,针对轻型ACI患者进行研究,有助于临床医生在轻型ACI患者静脉溶栓前进行更好的临床决策,当存在较严重的WMHs或较多的CMBs前,需充分权衡静脉溶栓的利弊并做好医患沟通;第三,分别以CSVD各影像标记及总体CSVD负荷作分析,显示总体CSVD负荷与3月不良预后无显著关系,提示将来需要开发一个更合理的总体CSVD负荷计算模型以提高预测准确性。但本研究也存在一些不足之处:本研究是回顾性研究,样本量较小,且未对CMBs数目设定截点,临床实用性有待提高,其结论有待大型前瞻性研究进一步证实。