18F-FDG PET/CT在胃癌骨转移中的临床应用
2022-03-21张伟光林晓平
熊 敏,张伟光,樊 卫,林晓平
华南肿瘤学国家重点实验室//中山大学肿瘤防治中心核医学科,广东 广州510060
胃癌的发病率及死亡率高,由于缺乏早期症状,大多数胃癌患者在诊断时已处于疾病晚期,40%以上存在转移[1-2]。胃癌常见的转移器官为肝、肺,而骨转移相对少见,发生率在0.9%~20%[3],故目前有关胃癌骨转移的报道很少。但骨转移是胃癌患者的独立预后危险因素之一,严重影响着胃癌的疗效与预后[4-5]。目前常用于检测骨转移的影像学方法包括CT、MRI、骨扫描及PET/CT。18F-FDG PET/CT是一种结合了解剖及功能成像的分子影像学技术,在临床上的应用价值已得到认可,并被推荐作为骨转移诊断的影像学方法[6-9]。最大标准摄取值(SUVmax)是临床最常用的一个半定量指标,可以间接反映肿瘤细胞代谢及增殖特性。根据2018年版中国临床肿瘤学会胃癌诊疗指南,PET可作为胃癌患者治疗前全身转移检查的备选手段[10]。目前18F-FDG PET/CT定性、半定量参数在胃癌诊断上的应用研究主要集中在原发灶及其他转移病灶上,这些研究发现18F-FDG PET/CT 相关参数如原发灶SUVmax大小与原发灶病理类型、组织分化、淋巴结转移等有关[11-14],而关于18FFDG PET/CT在胃癌骨转移上的报道较少,仅有一篇系统研究比较了18F-FDG PET/CT与骨扫描对胃癌骨转移的诊断能力,结果显示18F-FDG PET/CT在初始分期中对胃癌骨转移的诊断能力优于骨扫描[15]。目前还没有单独关于18F-FDG PET/CT定性、半定量参数在胃癌骨转移中价值的研究。本研究对胃癌骨转移患者的临床特征以及18F-FDG PET/CT定性及半定量(SUVmax)指标特点进行回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料
回顾性收集2010年1月~2020年12月在治疗前于中山大学肿瘤防治中心核医学科行18F-FDG PET/CT检查的128例初诊胃癌患者资料,包括年龄、性别、肿瘤特征,同期(18F-FDG PET/CT检查前后2周内)血常规、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、血钙等指标。纳入标准:原发灶均经病理证实;入院基本资料完整;患者在本院均进行了PET/CT检查,且PET/CT检查诊断为骨转移;在PET/CT 检查前患者未进行任何相关的手术及抗肿瘤治疗。排除标准:原发灶无病理取材、病理诊断不明、病理证实为其他肿瘤或炎症改变;基本资料不完整;PET/CT诊断骨病灶为骨折或其他良性病变;在PET/CT检查前已进行过抗肿瘤治疗;同时伴有其他恶性肿瘤。128名患者中共有21名符合上述条件,根据21名患者胃癌原发灶的组织分化结果及Lauren分型对患者进行分组。其中有1名患者的组织分化结果不详,1名患者的Lauren分型结果不详。最终分组情况为:低分化组13例(65.0%,13/20),中-低分化组7例(35.0%,7/20);Lauren分型上肠型组4例(20.0%,4/20),混合型组9例(45.0%,9/20),弥漫型组7例(35.0%,7/20)。本研究获得中山大学肿瘤防治中心伦理委员会批准。
1.2 显像设备、药物与方法
显像设备为PET/CT(西门子Biograph mCT,或联影公司uEXPLORER)。18F-FDG(原子高科股份有限公司广州分公司),放化纯>99.0%。患者检查当天禁食6 h以上,血糖水平控制在11 mmol/L以下;18F-FDG注射剂量为0.1~0.15 mCi/kg(3.7~5.55 MBq/kg)。患者静脉注射18F-FDG后于暗室内安静平卧休息约60 min,排空小便后进行PET/CT显像。采集范围从颅顶到股骨中段,必要时进行延迟扫描。先进行CT扫描,利用自动管电流调制技术进行平扫,扫描电压100~140 kV。CT 扫描完成后即刻进行PET 采集,Biograph mCT 每个床位采集时间为1.7 min,采集5~7个床位;uEXPLORER 共1个床位,采集时间10 min。扫描完成后进行三维重建,将PET和CT图传至工作站,进行帧对帧图像融合。并依据患者体质量、注射剂量、代谢时间,自动计算SUV。
1.3 图像分析标准与结果判定
视觉评估:在PET图像上根据连续2个层面以上相应区域出现的肉眼可辨认的放射性浓集区,为显像阳性。诊断胃癌原发灶的PET/CT判断标准:(1)18F-FDG摄取程度高于周围正常胃壁黏膜;(2)胃壁黏膜非对称性增厚或形成软组织结节、肿块。
PET/CT图像上骨转移类型分型标准:在放射性浓集区出现以下改变:(1)溶骨性病灶:松质骨和(或)皮质骨边缘有较清楚的低密度缺损区,无硬化边;(2)成骨性病灶:松质骨内有斑点状、片状、面团状或结节状、边缘模糊的高密度灶;(3)混合性病灶:兼有上述2 种表现。根据PET/CT上溶骨性、混合性及成骨性表现将骨转移类型分为3组,其中纯溶骨性转移组6例,混合性(溶骨性/成骨性)组11例,成骨性组4例。参考Soloway分级标准[16]对骨转移数目进行分级:Ⅰ级骨转移数量≤5,Ⅱ级骨转移数量为6~20,Ⅲ级骨转移数量>20。根据Soloway分级将骨转移灶数量分为3组,其中Ⅰ级(组)6例,Ⅱ级(组)4例,Ⅲ级(组)11例。
感兴趣区(ROI)的勾画方法:选取病灶放射性计数最大层面,采用视觉法勾画局部病灶代谢增高区域作为ROI。工作站自动计算ROI 的病灶面积、SUVmax。18FFDG PET/CT图像由2名核医学科医师共同阅读,诊断前详细了解病史及临床体检结果,然后在横断面逐层观察病灶的部位、大小及代谢情况,诊断时综合考虑PET图像、CT图像及临床资料,意见不一时协商解决。
1.4 统计学分析
采用SPSS 22.0统计软件对数据进行统计分析,对计量资料进行正态性和方差齐性检验,服从近似正态分布的数据以均数±标准差表示,组间比较行两独立样本t检验;不服从近似正态分布的数据以中位数(四分位数间距)表示,组间比较行Mann-WhitneyU检验或Kruskal-Wallis检验;计数资料以n(%)表示,组间比较行卡方检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本情况
128例初诊胃癌患者中PET/CT诊断有骨转移者21例,骨转移发生率约16.4%。21例胃癌骨转移患者中男性9例,女性12例,中位年龄57.0(28.0,81.0)岁。病理组织分型腺癌20例(3例伴有部分印戒细胞),低粘附性癌伴有部分印戒细胞1例。21例患者中,PET/CT显示脊柱转移19例,肩胛骨、肋骨、锁骨、胸骨转移18例,骨盆转移17例,四肢骨转移14例,颅骨转移9例,其中3例伴有骨髓浸润(2例为混合性,1例为成骨性),2例伴有软组织肿块形成。21例胃癌骨转移患者临床及肿瘤特征(表1)。
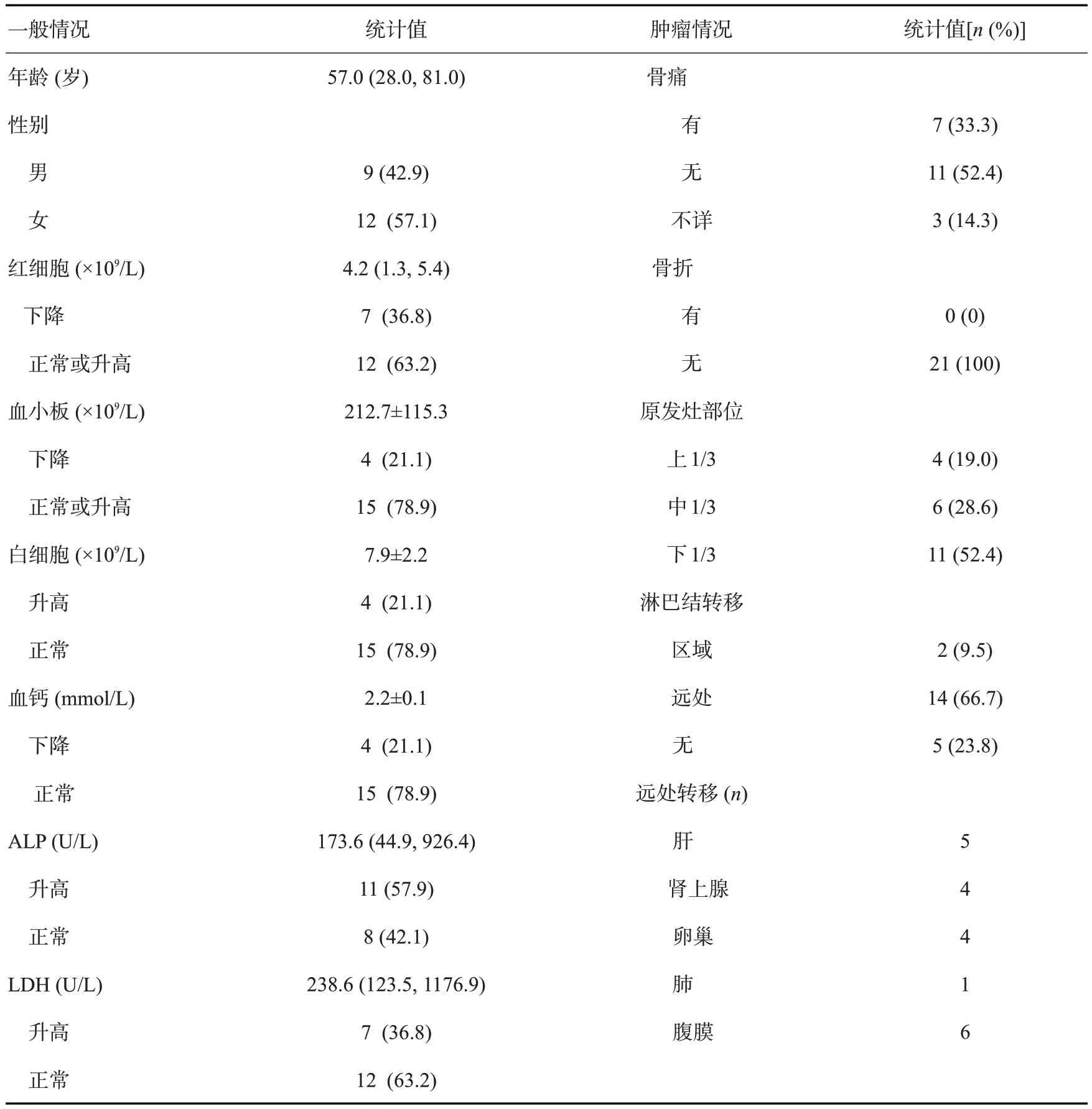
表1 21例胃癌骨转移患者临床及肿瘤特征Tab.1 Clinical and tumor characteristics of 21 cases gastric cancer patients with bone metastasis
2.2 骨转移类型与临床、病理特征及半定量参数间关系
本组胃癌骨转移患者参照骨转移类型共分为3组,其中溶骨性转移6名,混合性转移11名,成骨性转移4名。LDH 水平在不同骨转移类型组间存在差异(χ2=6.823,P=0.047),混合性骨转移中LDH升高6例,相对于溶骨性和成骨性转移LDH升高更常见。胃癌伴成骨性骨转移(图1)。
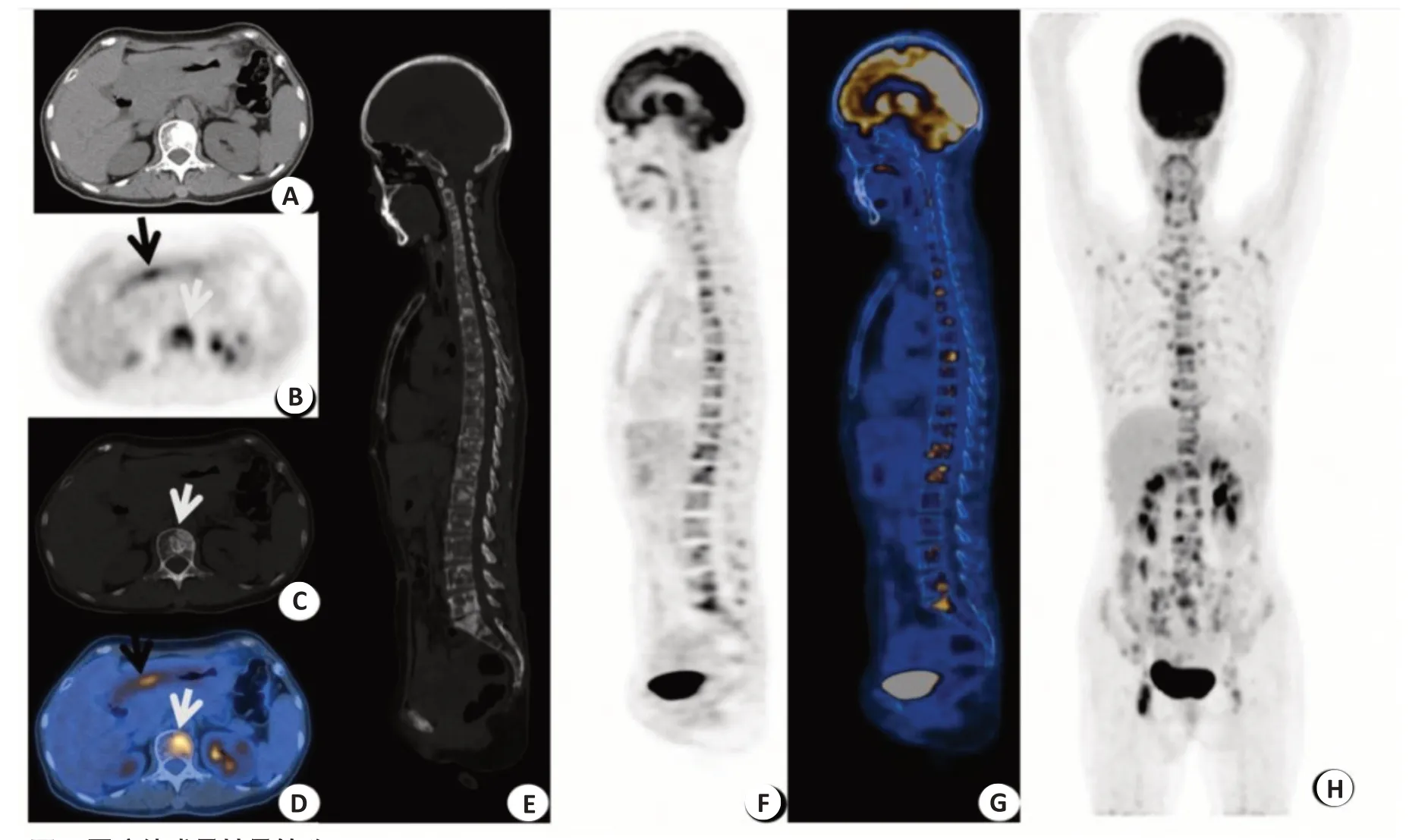
图1 胃癌伴成骨性骨转移Fig.1 Gastric cancer with osteogenic metastasis.
2.3 骨转移灶SUVmax与临床、病理特征间关系
21例患者骨转移灶SUVmax为11.3±6.0。根据原发灶组织分化程度将患者分为低分化组(n=13)和中-低分化组(n=7)。低分化组骨转移灶平均SUVmax(12.1±7.1)高于中-低分化组(9.8±3.8),但差异无统计学意义(t=0.803,P=0.433)。在Lauren分型上,弥漫型及混合型较肠型多见,弥漫型组骨转移灶中位SUVmax[12.2(5.3,32.1)]及混合型组中位SUVmax[10.8(7.2,17.2)]高于肠型组中位[6.7(3.7,7.3)](H=6.326,P=0.034)。骨转移灶SUVmax大小在性别上存在差异(Z=-1.990,P=0.049),女性组骨转移灶中位SUVmax高于男性组[11.6(7.3,32.1)vs7.2(3.7,17.1)]。Soloway分级越高,即骨转移灶数目越多,骨转移灶中位SUVmax越高(H=6.070,P=0.041);Ⅰ级为7.0(5.3,10.8),Ⅱ级为9.8(7.3,17.2),Ⅲ级为12.2(3.7,32.1)。我们进一步分析了性别与Soloway分级间关系,发现Soloway 分级在性别上存在差异(χ2=6.832,P=0.033),女性患者Soloway分级普遍高于男性。
21例患者骨转移灶中位SUVmax为10.0(3.7,32.1),按骨转移灶中位SUVmax=10.0将患者分为两组。在年龄上,低龄(<中位年龄57.0岁)组骨转移灶SUVmax多高于10.0,而高龄(>57.0岁)组则多低于10.0(χ2=5.838,P=0.03)。在性别上,男性组骨转移灶SUVmax多低于10.0,而女性组则多高于10.0(χ2=5.743,P=0.03)。
2.4 原发灶SUVmax与临床、病理特征间关系
21例患者原发灶中位SUVmax为4.6(2.8,34.9)。低龄组原发灶中位SUVmax为3.4(2.8,4.7),高龄组原发灶中位SUVmax为8.5(3.3,34.9)(Z=-3.310,P=0.001)。低分化组原发灶中位SUVmax为4.1(2.9,34.9),低于中低分化组的6.8(2.8,16.4);肠型组原发灶中位SUVmax为8.5(3.0,10.4),高于弥漫型组的4.1(2.9,8.5)及混合型组的4.7(2.8,34.9);Soloway 分级越高(骨转移数目越多),原发灶中位SUVmax越低,Soloway 分级Ⅰ级原发灶中位SUVmax为12.2(3.0,34.9),Ⅱ级为5.5(3.5,6.8),Ⅲ级为3.6(2.8,10.4),但上述差异均无统计学意义(Z=-1.545,H=2.204,H=4.121,P>0.05)。
同样地,按原发灶中位SUVmax将患者分为两组。在年龄上,低龄组原发灶SUVmax多低于4.6,而高龄组原发灶SUVmax多高于4.6(χ2=10.831,P=0.002)。21例胃癌骨转移患者临床、病理特征在定性、半定量参数间的差异(表2)。
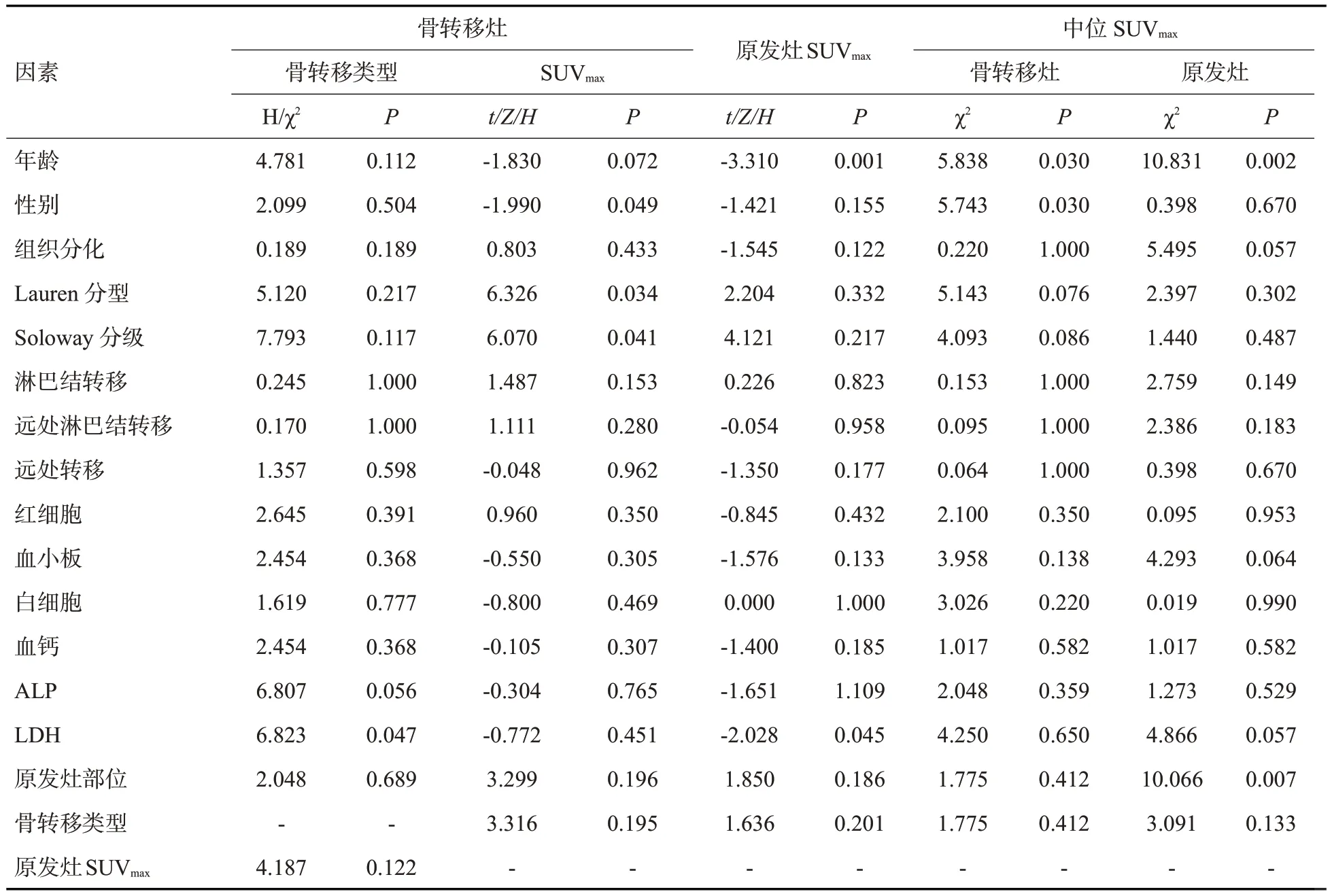
表2 21例胃癌骨转移患者临床、病理特征在定性、半定量参数间差异Tab.2 Differences in clinical and pathological characteristics between qualitative and semiquantitative parameters in 21 cases gastric cancer patients with bone metastasis.
3 讨论
在临床上,骨转移常见于乳腺癌、肺癌、前列腺癌、肾癌等其他肿瘤,而胃癌发生骨转移较少见。我们对11年间在本中心行PET/CT检查的初诊胃癌患者进行了回顾性分析,在128例患者中发生骨转移21例,发生率约16.4%。有研究表明,胃癌发生骨转移的部位以脊柱、肋骨、骨盆等中轴骨为主,以溶骨性和多发骨转移为主[3]。我们的结果与既往研究结果相一致。既往报道中,胃癌骨转移更常见于年轻患者[17];而我们发现,患者年龄与原发灶及骨转移灶SUVmax大小有关,低龄组原发灶SUVmax较低而骨转移灶SUVmax较高,高龄组原发灶SUVmax较高而骨转移灶SUVmax较低。这或许与不同年龄组在炎症/生理摄取上存在差异有关,高龄患者胃部炎症发生率较高,这会影响原发灶SUVmax的大小;低龄患者骨髓造血功能较高龄者好,骨髓生理摄取较高,这或许是导致低龄组骨转移灶SUVmax较高的原因。
相关研究认为,胃癌患者出现骨转移时常伴ALP升高[17-18]。本研究19例患者同期血清ALP结果显示11例高于正常。ALP在骨骼中可以作为反映成骨细胞活性的敏感指标,在肿瘤患者中可以作为骨转移重要的诊断依据。因此,当胃癌患者血清ALP升高时,要警惕骨转移的可能性。除此之外,我们发现本组骨转移患者LDH水平较高,并且LDH升高更常见于混合性转移患者。LDH、ALP水平升高是胃癌骨转移患者预后不良的因素[19]。在淋巴瘤中,LDH水平已作为疾病危险分层因素之一[20],可反映肿瘤负荷和癌细胞侵袭性,在疗效评估、预后预测中具有较高应用价值。目前,还未发现有关LDH水平与胃癌或其他肿瘤骨转移危险分层、疗效评估及预后预测的相关研究。
本研究21例患者中,PET/CT显示有3例患者伴有广泛骨髓浸润(2例为混合性,1例为成骨性),表现为骨髓腔弥漫性摄取增高,而骨质形态及密度改变不明显。从解剖影像如CT上看,由于骨质改变不明显,很难发现异常;MRI虽可根据骨髓信号改变提示骨髓异常,但其难以用于全身成像评估全身浸润情况;骨扫描对显示成骨性转移具有一定优势,但对溶骨性及骨质改变轻微病变的检出率不高。18F-FDG PET/CT集解剖影像及代谢影像于一身,在没有解剖改变之前就可以无创且直观依据病变内异常的葡萄糖代谢信息来显示骨髓受侵情况,间接反映肿瘤负荷和肿瘤细胞的增殖和生长能力等生物学特征;且一次扫描可了解全身情况,能够清晰显示浸润范围,从而早期、全面、精确地评估患者全身状态。另外,根据18F-FDG的摄取情况,还可为临床活检指导最佳穿刺部位,提高穿刺准确性。相关研究也证实了18F-FDG PET/CT在诊断恶性肿瘤骨髓浸润上的优势[21]。
肿瘤不同的组织病理类型及肿瘤细胞的分化程度在一定程度上会影响肿瘤的生物学行为及患者预后。有研究发现腺癌是骨转移患者中最常见的组织病理学亚型[22],有研究发现胃癌骨转移多见于具有组织学侵袭性的低分化腺癌患者[23],也有学者认为胃癌骨转移见于伴周围大量淋巴结转移的患者[18]。本研究中,发生骨转移最常见的病理类型是腺癌,以低分化和中-低分化为主,伴淋巴结转移患者16例(76.2%),与以上研究结论相符。1965年,Lauren根据胃癌的组织形态结构和生物学特征,将胃癌分为肠型、弥漫型及混合型。肠型胃癌一般具有明显的腺管结构,分化较好;弥漫型胃癌包括许多低分化腺癌和印戒细胞癌,癌细胞分化较差,呈弥漫性生长。一项对8231名胃癌患者的回顾性研究发现,肠型胃癌更常转移至肝脏和肺,而弥漫型胃癌则更常转移至腹膜及骨[24]。Lauren分型不仅反映肿瘤的生物学行为,用于指导治疗,还与患者预后有极大关系,其中肠型胃癌预后较好,而混合型胃癌的预后最差。既往研究认为,胃癌原发灶SUVmax大小会随着肿瘤分化程度的增加而增加[13-14,25]。我们的发现与上述研究结果一致,低分化组原发灶中位SUVmax低于中低分化组,肠型组原发灶中位SUVmax高于弥漫型及混合型组,但差异无统计学意义,这可能与本研究样本量较小有关。与原发灶情况不同的是,本组患者骨转移灶SUVmax在低分化组中平均SUVmax高于中-低分化组(P>0.05),弥漫型和混合型组中骨转移灶中位SUVmax明显高于肠型组(P<0.05),与以上研究结果有所差异。越来越多研究表明,癌细胞在转移的不同阶段其三大营养物质代谢会发生不同程度的变化,以适应新环境[26]。或许正是这些变化影响到原发灶与转移灶肿瘤细胞对18F-FDG 的摄取。有研究利用CT影像组学预测胃癌Lauren分型的可行性,结果表明放射组学特征结合临床特征的预测模型有助于提高对胃癌Lauren分型的预测价值[27]。解剖影像与代谢特征结合的PET/CT可提供更多有关肿瘤生物学行为的信息,在本研究中不同分化及组织类型的胃癌患者间病灶代谢存在差异,或许在未来可利用PET/CT预测胃癌原发灶及转移灶分化程度及组织学类型,并预测患者预后,为临床治疗提供更多有用信息。
值得注意的是,现已有研究将PET/MRI用于肿瘤骨转移(特别是骨髓浸润)的评估,以减少检查带来的电离辐射和提供额外的病灶信息。此外,另一种新兴显像剂——成纤维细胞活化蛋白抑制剂(FAPI)在胃癌的应用中也得到关注。研究发现,不管是在PET/CT还是PET/MRI上,FAPI在显示胃癌原发灶及转移灶(包括骨)方面都优于FDG[28-29]。但FDG目前仍是临床应用最广泛的肿瘤核医学分子显像剂,其容易制备,显像技术及图像评估标准成熟,在肿瘤诊断上仍有应用价值。
本研究也存在一些局限:本研究为回顾性研究,且纳入研究的样本量较小;由于样本量较小,未能分析、对比不同成像方式对骨转移的诊断能力及分析患者预后。未来仍需开展大样本、多中心、前瞻性研究探索18FFDG PET/CT在胃癌骨转移上的应用。
综上,18F-FDG PET/CT能够全面评估胃癌骨转移情况。胃癌骨转移预后差,早期、及时诊断对临床来说十分重要。胃癌骨转移常发生于中轴骨,以溶骨性及多灶转移多见,常伴有LDH、ALP的升高;LDH升高更常见于混合性转移患者。胃癌骨转移患者的临床特征在18F-FDG PET/CT定性及半定量指标间存在一定差异,女性患者Soloway分级普遍较男性高,而Soloway分级越高,其骨转移灶SUVmax越高;Lauren分型中,弥漫型及混合型骨转移灶SUVmax高于肠型。另外,有必要对PET/MR在恶性肿瘤骨转移上的应用及FAPI在胃癌中的应用进行更多探索和研究。
