磁共振NODDI技术在帕金森认知障碍患者海马微观结构的应用
2022-03-21热米拉玉山
肖 宁,热米拉·玉山,陆 鹏,姜 磊,王 红
新疆医科大学第二附属医院影像中心,新疆 乌鲁木齐830000
帕金森病(PD)临床表现除震颤、运动迟缓、肢体僵硬等运动症状外,还有认知异常、睡眠障碍、感觉障碍等非运动症状,非运动症状可出现在帕金森病患者病程的任何阶段,亦可发生在运动症状发作之前[1]。PD中的轻度认知障碍是PD痴呆的一个明显的危险因素,也是一个更恶性的疾病过程[2]。帕金森病罹患认知障碍的概率很高,这严重影响了患者的生存和生活质量,因此早期发现并及时给出相应的临床治疗对患者来说尤为重要。既往研究表明,海马结构和功能改变与越来越多的疾病有关,包括神经系统疾病中的认知功能障碍(CI)[3-5];神经影像学研究的综合证据表明,除了众所周知的纹状体多巴胺丢失,海马突触可塑性受损可能导致早期帕金森病患者的认知和情感障碍[6]。海马区的结构MRI可能有助于确定哪些患者应该接受早期治疗,以延缓痴呆的临床发病[7]。
近年来,扩散磁共振成像技术已广泛应用于PD的辅助诊断中,运用神经突方向离散度与密度成像(NODDI)技术研究帕金森认知障碍海马结构的研究相对较少,且多基于整个神经系统来研究。本研究应用该技术来量化分析PD患者海马微观结构的变化,并探讨其与认知的相关性,进而为PD的早期诊断及尽早发现PD患者出现认知异常提供更加准确的神经影像学参考,为临床干预治疗提供更全面的资料。
1 资料与方法
1.1 一般资料
收集2019年11月~2021年5月于我院神经内科就诊的帕金森病患者36例,其中男性20例,女性16例,年龄47~79(61.64±6.97)岁。随机选取同时期年龄性别与病例组相匹配且于我院行头部MRI检查的健康志愿者20例作为对照组(NC),其中男性12例,女性8例,年龄49~69(60.95±6.35)岁。病例组纳入标准:由我院神经内科专家依据《帕金森治疗指南(2018年版)》诊断标准做出帕金森病诊断;经常规MRI扫描未发现脑梗死、脑水肿、脑出血等器质性脑部病变;患者可配合检查。排除标准:有幽闭恐惧症、心脏起搏器植入等MRI检查禁忌证者;有意识障碍或精神疾病史者;合并有其他脑内疾病者。本研究通过医学伦理委员会审查批准,且受试者均知情同意。
对PD患者进行蒙特利尔认知评分(MoCA),其中16例MoCA评分<26分为帕金森认知障碍组(PD-CI),20 例MoCA 评分≥26 分为帕金森认知正常组(PDCN)。PD-CI、PD-CN、NC 组3 组受试者的性别(P=0.715)和年龄(P=0.921)差异均无统计学意义,3组间的MoCA评分差异有统计学意义(P<0.001,表1)。

表1 3组受试者一般情况及MoCA量表评分分析Tab.1 General situation of three groups of subjects and score analysis of MoCA scale
1.2 检查方法
所有MR图像均用32通道高分辨率头颅线圈,由飞利浦3.0T MRI扫描获得。应用扩散加权-自旋回波-回波平面成像(DW-SE-EPI)序列采集图像,施加32个各向同性扩散梯度方向。每一个方向上,弥散加权像通过两个b值(1000、2000 s/m²)接收。具体扫描参数如下:TR 4000 ms,TE 80 ms,FOV 200 mm×232 mm×119 mm,矩阵大小128×128,层厚2.43 mm,间隔5 mm,总扫描时长9 min。
1.3 数据处理
将MR扫描的原始图像传入后处理工作台,将弥散峰度成像序列的图像通过Spin及dcm2nigui软件分离图像、转换格式,然后使用NODDI Matlab R2013a 软件执行图像分析得到细胞内体积分数(Vic)图、方向离散度指数(ODI)图和各向同性水分子体积分数(Viso)图。
1.4 感兴趣区(ROI)的分析
ROI由2名对被检者病情不知情的放射科主治医师共同选取测量,在双侧海马显示最清晰、面积最大的层面,勾画大小相同、双侧位置对称的ROI,为了避免扫描伪影的影响,双侧海马分别选取海马头、体、尾3个ROI并取其平均值作为最终的测量值。
1.5 统计学分析
采用SPSS26.0软件对数据进行统计分析。满足正态分布的计量资料以均数±标准差表示,3组均数间的比较先进行方差齐性检验,方差齐者行单因素方差分析,方差不齐者行秩和检验。计数资料的比较行卡方检验。将PD-CI组和PD-CN组间差异有统计学意义的NODDI参数指标测量值与MoCA量表评分做相关性分析,符合正态分布行Pearson相关分析,不符合正态分布行Spearman相关分析,得到相关系数r。以P<0.05为差异有统计学意义。
2 结果
2.1 NODDI参数值及3组间的相互比较结果
3组受试者双侧海马的ODI、Vic、Viso平均值(表2)。与NC组相比,PD-CI组双侧海马的ODI值、Vic值降低(P<0.001),PD-CN组双侧海马的ODI值、Vic值亦有不同程度的降低(P<0.05);与PD-CN 组相比,PDCI 组双侧海马的ODI值、Vic值降低,差异有统计学意义(P<0.05);3组间双侧海马的Viso值差异无统计学意义(表3)。

表2 PD组与对照组海马各参数指标的均值Tab.2 Mean values of parameters of hippocampus between PD group and control group(Mean±SD)
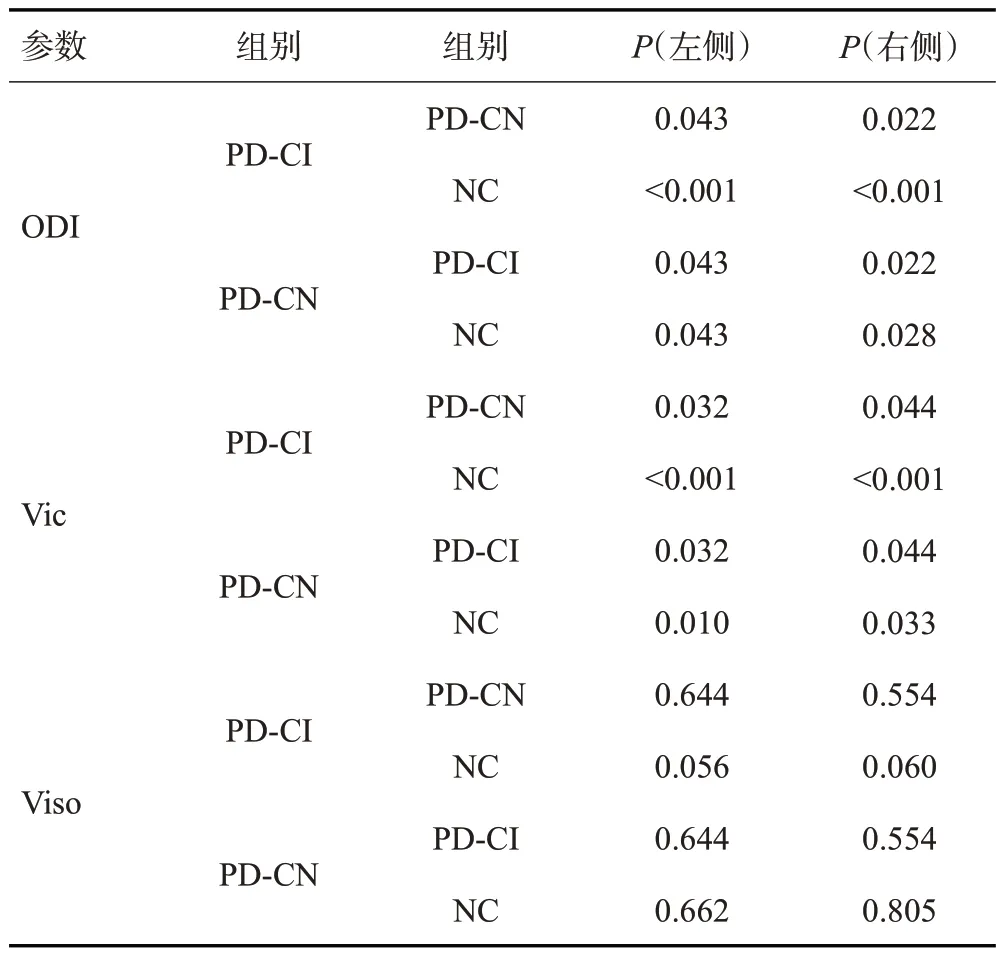
表3 双侧海马各参数指标的组间比较Tab.3 Comparison of parameters of bilateral hippocampus between groups
2.2 相关性分析结果
将PD-CI 组双侧海马的ODI 值和Vic 值分别与MoCA评分进行Pearson相关分析,结果显示左侧海马的ODI值和Vic值及右侧海马的ODI值与MoCA评分呈正相关,其中左侧海马ODI值与MoCA评分的相关性最强(r=0.617,P<0.05,表4,图1)。

表4 PD-CI组ODI值和Vic值与MoCA量表评分的相关性分析Tab.4 Correlation analysis of ODI value,Vic value and MoCA scale score in PD-CI group
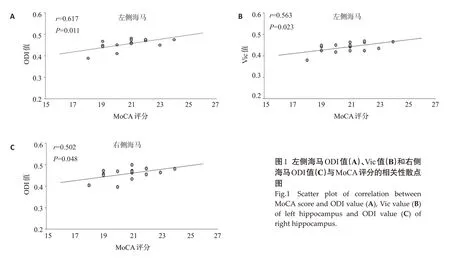
图1 左侧海马ODI值(A)、Vic值(B)和右侧海马ODI值(C)与MoCA评分的相关性散点图Fig.1 Scatter plot of correlation between MoCA score and ODI value (A),Vic value (B)of left hippocampus and ODI value (C) of right hippocampus.
2.3 后处理图像
双侧海马感兴趣区常规序列T1WI图、T2WI图、T2-FLAIR图(图2A~C),双侧海马ODI图(图2D)、双侧海马Vic图(图2E)、双侧海马Viso图(图2F)。
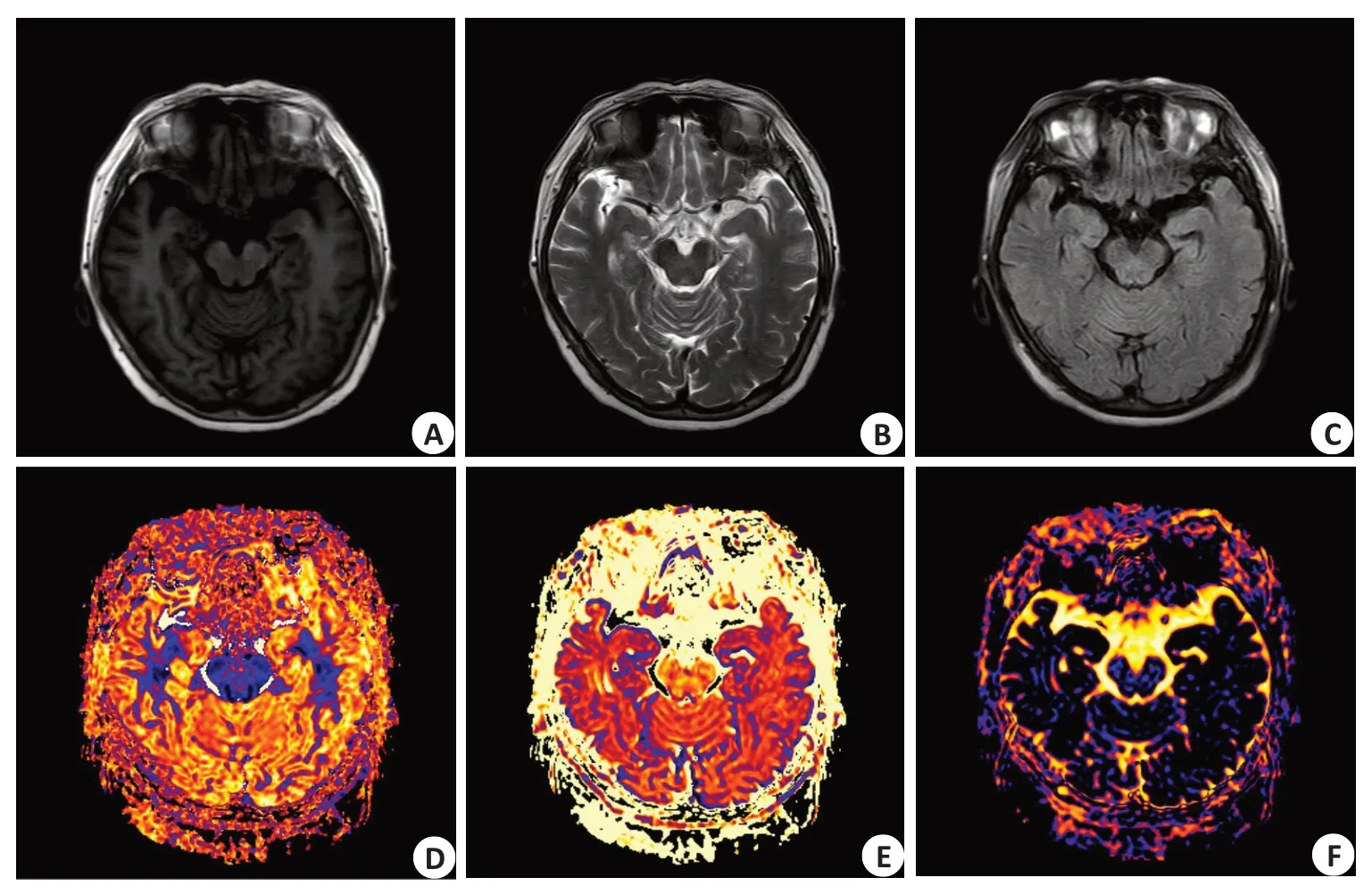
图2 女,63岁,PD患者,左上肢不自主抖动8年Fig.2 A 63-year-old female PD patient,the left upper limb has been shaking involuntarily for 8 years.
3 讨论
NODDI可用于探测神经元(轴突和树突)微观结构,在临床应用中将这些指标映射到整个大脑,为理解大脑发育和各种疾病提供了新的机会;虽然扩散张量成像(DTI)在研究白质的微观结构特性及其对行为的影响方面有着非常重要的作用,其参数指标部分各向异性(FA)值的变化可能是由髓鞘化、轴突直径、膜透性或轴突填充密度的变化引起的[8-9],但DTI仅能评估脑白质的结构,对灰质微观结构的敏感度差,不能捕捉到特定体素中复杂的微观结构细节。而NODDI同时包含了高斯各向同性及高斯各向异性模型,因而将扩散成像应用从脑白质扩展到了脑灰质的微观结构[10]。NODDI能够单独分析神经突密度和纤维方向离散度,而这两种因素又是影响FA值的主要因素,因此NODDI不仅能够解决DTI的局限性,并且还提供了对与疾病或发育引起的变化相关的微结构细节和潜在机制的更全面的分析。
NODDI 是在多室(细胞内、细胞外和脑脊液)扩散模型的基础上发展起来的,它的主要参数指标NDI代表基于细胞内扩散的轴突和树突密度;ODI可量化细胞内神经元离散度,反映了结构变化的复杂组合,包括轴索丢失、树突修剪和组织重组;Viso代表体素内像脑脊液一样自由扩散的水分子体积分数[11]。PD患者在中晚期大多会出现不同程度的认知功能障碍,有些患者亦在早期即可表现出认知功能受损的症状。海马参与了人体的记忆和认知等功能,海马体积越小,在记忆、语言、空间工作、记忆和执行功能测试方面的表现就越差[12-13],所以本研究利用NODDI技术来探索PD患者海马微观结构的改变。有学者通过运用DTI检测PD中海马体的FA值的变化,得出PD患者中海马FA值较正常组下降,因此推断出利用DTI检测海马体的FA值具有研究PDCI的前景[14]。Vic和ODI是NODDI的两个指数,它们分别反映了白质中轴突的堆积密度和轴突的空间组织,是FA的两个分离面[15],因此NODDI技术可以探测出FA值变化的具体原因。
笔者通过测量3组受试者双侧海马的ODI值和Vic值,得出PD-CI组双侧海马的ODI值和Vic值均明显低于NC组(P<0.001),PD-CN组的ODI值和Vic值也低于NC组(P<0.05),但是降低的程度不及PD-CI组;通过PD-CI组与PD-CN组的比较来看,PD-CI组的海马ODI值和Vic 值较PD-CN 组低,差异有统计学意义(P<0.05),表明轴突变薄和神经变性,这与既往研究[15]结果一致。由此说明,PD患者的海马存在不同程度的改变,而有认知障碍的PD患者海马微观结构的改变会更加显著。通过NODDI指标与MoCA评分相关性的研究得出,左侧海马的ODI值和Vic值及右侧海马ODI值与MoCA评分均呈正相关,且左侧海马的ODI值与MoCA评分的相关性最强,可能是由于海马萎缩,树突结构复杂性降低,从而导致ODI降低,这与既往研究[16]结果相符的,其研究表明PD患者认知功能下降的早期与左侧海马和丘脑灰质萎缩密切相关。而另有研究表明,帕金森病转化为痴呆,右侧丘脑和海马体积丢失表现出独特的进展[17],笔者认为这可能与帕金森病通常出现不对称的临床症状有关。本研究的结果支持了轴突丢失及树突长度和树突棘减少是PD中与认知相关的海马微结构变化的主要因素的观点。既往有研究表明,海马α-突触核蛋白的异常聚集与认知障碍及其严重程度有关[18-19],PD组轴突密度降低是由于α-突触核蛋白沉积和多种神经递质缺乏所致,PD-CI 组的轴突密度比PD-CN 组低。此外,本文通过测量PD组与对照组海马的各个指标值,量化分析了各指标值的变化,且分别分析了其与认知评分的相关性,找到了相关性最强的指标,ODI值可以作为评价PD患者认知功能相关微结构变化的有用指标,有望提示临床哪些PD患者很可能出现了认知异常或认知障碍有加重的趋势,进而给予相应的干预治疗,延缓症状的进展。
本研究亦存在一定的局限性:首先这是一项横断面研究,样本量相对较小,多中心纵向研究与更大的样本量仍然是需要的;其次是海马的结构还细分为海马头、海马体和海马尾,本研究中测量的是海马的平均值,并没有细分这些结构,在今后的研究中可以对其分别进行研究和分析;最后,尽管近年来以临床上可行的数据获取为明确目标的生物物理模型显著增加[20],但NODDI本质上只是一个模型,需要积累更多的实验和研究来提高其评估脑组织改变的准确性。
综上所述,NODDI参数作为PD患者海马微结构改变的影像学生物标记物在认知障碍的研究中具有潜在的潜力,可以为临床综合诊断提供较为可靠的神经影像学参考。