miR-124诱导糖尿病性白内障患者晶状体上皮细胞凋亡的作用及机制
2022-03-21陈祎祎彭建军
陈祎祎,彭建军
(武汉科技大学附属普仁医院眼科,武汉 430081)
白内障是世界上致盲率居首位眼病,同时也是糖尿病的常见并发症,是造成糖尿病患者视力下降以及失明的重要原因[1-2]。白内障的主要病理过程包括晶状体上皮细胞(LEC)受到活性氧或紫外线等氧化应激损伤,随后LEC功能失调并发生细胞凋亡,继而晶状体内环境的平衡被破坏,最终导致晶状体混浊[3]。近年来随着高通量测序技术和生物信息学的发展,大量研究[4-5]表明miRNA参与调控LEC细胞的细胞功能,并参与白内障的发生发展。本研究基于生物信息学分析与细胞试验,探讨晶状体上皮细胞高表达的miR-124在糖尿病性白内障发病进程中的作用及机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂
人LEC细胞系(HLE-B3,丰晖生物科技有限公司),90%高糖DMEM+10%FBS(美国Gibco公司),引物序列(上海生工科技公司),miR-124 inhibitor、dsControl、dsBcl-2-640(上海吉玛制药技术有限公司),转染试剂盒(Lipofectamine 2000,美国Invitrogen公司),mirVan miRNA分离试剂(美国Ambion公司),miRNeasy Mini试剂盒(德国Qiagen公司),miRCURY Hy3/Hy5 Power 标记试剂盒(丹麦Exiqon公司)。
1.1.2 标本来源
根据分层抽样法选取糖尿病性白内障眼10例(男5例、女5例)与健康捐献眼(健康对照眼,尸眼)4例晶状体前囊膜,排除黄斑变性、玻璃体积血或继发于视网膜脉络膜病变的黄斑水肿、高度近视以及高血压、心肺肝肾功能障碍、恶性肿瘤或其他脑部疾病者。另外健康眼捐献者同时排除糖尿病或内眼手术史。所有自愿参与本试验的志愿者或家属均已签署书面知情同意书,全部试验流程遵守《赫尔辛基宣言》的原则进行。
1.2 方法
1.2.1 RNA提取、文库制备、测序
使用mirVan miRNA分离试剂分离标本总RNA,随后使用miRNeasy Mini试剂盒进行纯化,将分离出的RNA通过Nanodrop光谱仪(美国Thermo Fisher Scientific公司)进行量化。提纯后的RNA用干冰冷冻,保存在-80 ℃。使用miRCURY Hy3/Hy5 Power标记试剂盒制备miRNA标记,将纯化后的RNA逆转录为互补DNA(cDNA),并进行PCR扩增。构建NEBNext Ultra RNA定向文库,使用Illumina HiSeq4000平台进行测序[6]:1)将总RNA(1 g)溶于Nebnext第一链合成反应缓冲液中,剪切成200~500个核苷酸片段,利用这些片段生成双链cDNA;2)对cDNA进行末端修复,并用Illumina特异性适配器连接;3)用200 bp碱基对文库进行大小筛选,选择合适的片段进行PCR扩增;4)用Phusion High-Fidelity DNA聚合酶进行扩增,用QIAquick Nucleotide Removal试剂盒进行纯化。用Illumina hiseq 4000系统基于2×50碱基配对末端读长测序对RNA文库进行测序。Fastx-toolkit软件(ver.0.0.13,http://hannonlab.cshl.edu/fastx_toolkit)被用来从原始数据中去除3′引物。此外,质量分数<20的碱基被淘汰。如果一个序列中30%碱基被剔除,整个序列就会被丢弃,不再进行进一步的分析。对2组样本表达miRNA作归一化处理后,归一化每千个碱基的转录每百万映射读取reads(TPM)[7]=(miRNA表达量/样品总表达量)×106。
1.2.2 生物信息学分析
依次使用cutadapt软件、DCC软件(v0.4.4)、STAR(v2.51 b)、miRBase数据库和miRWalk数据库对所测得的miRNA进行注释。随后使用edgeR软件(v3.16.5)对数据进行归一化,筛选差异表达miRNA。使用F检验比较糖尿病性白内障眼和健康对照眼的miRNA丰度差异。在fold-change≥2.0,且P值<0.05的条件下筛选出显著差异表达的miRNAs。
1.2.3 细胞培养、转染及分组
LEC细胞使用90%高糖DMEM+10%FBS+双抗培养基在37 ℃、5% CO2环境下培养。dsRNA转染前1 d,将细胞以50%~60%的密度接种在不含抗生素的培养基中。根据Lipofectamine 2000(Invitrogen)说明书进行dsRNA转染或miRNA inhibitor质粒转染。
分组:设置空白对照组、dsControl(与所有已知人类序列缺乏显著同源性的对照dsRNA)转染组、miR-124 inhibitor组(转染miR-124 inhibitor)、dsBcl-2-640(与预测的miR-124在Bcl-2启动子的靶位点完全互补的另一个dsRNA分子)转染组、miR-124 inhibitor+dsBcl-2-640共转染组。
1.2.4 qRT-PCR
使用RNeasy micro kit(QIAGEN)提取总RNA,并用SuperScriptII试剂盒(Invitrogen)合成cDNA。使用qPCR SYBR Green Master Mix(Applied Biosystems)在CFX 96实时PCR系统(TaKaRa)上进行qRT-PCR,并以GAPDH作为内参,使用2-ΔΔCT法计算相对表达量。miR-124引物:5′-GCCCTGGCAGTGTCTTAG-3′;5′-CAGTGCGTGTCGTGGAG T-3′。Bcl-2引物:5′-CCTTGTACCTGACCATGTCAACA-3′;5′-CCTGGGAGGCATAGA-CCATGTA-3′。GAPDH引物:5′-GGCCTCCAAGGAGTAAGACC-3′;5′-AGGGGAGATTCAGTGTGGTG-3′。
1.2.5 Western Blot
使用RIPA裂解缓冲液(Thermo Fisher Scientific)从LEC细胞提取总蛋白。通过BCA蛋白质测定试剂盒(CoWin Biotechnology)检测蛋白质浓度。使用40 μg总蛋白进行10% SDS-PAGE电泳,随后将总蛋白转移至PVDF膜(Millipore)。然后将PVDF膜用5%牛奶封闭4 h,随后使用TBST清洗5 min×3次,最后将PVDF膜与一抗4 ℃过夜孵育。次日,将PVDF膜用TBST清洗5 min×3次,并与二抗常温孵育2 h。孵育完成后,再次将PVDF膜用TBST清洗5 min×3次,并使用ECL发光液(Millipore)进行检测,并计算各蛋白的表达量。
1.2.6 凋亡检测
将上述各组细胞培养在35.5 mmol·L-1高糖环境中48 h,使用Annexin V/FITC和PI细胞凋亡检测试剂盒(Invitrogen)和流式细胞术测定细胞凋亡。将转染的LEC细胞用胰蛋白酶消化、收获、洗涤并用100 μL结合缓冲液重悬,使细胞最终浓度为1×106个·L-1。然后将细胞用5 μL的Annexin V/FITC染色,然后用1 μL的PI染色,并在室温下避光孵育15 min。通过FACSCalibur流式细胞仪(FACScalibur)分析细胞凋亡率。
1.2.7 统计学方法
统计分析采用SPSS17.0软件进行,数据以均数±标准差表示,采用非配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 miR-124在糖尿病性白内障患者晶状体前囊膜中高表达
高通量测序结果显示,在糖尿病性白内障眼和健康对照眼晶状体前囊膜标本中共检测到37 767种miRNAs。其中2组有1275个差异表达的miRNAs(变化倍数≥2,P<0.05)。在差异表达的miRNAs中,糖尿病性白内障组有627个上调,648个明显下调,其中糖尿病性白内障眼和健康对照眼miR-124丰度值(TPM)分别为281 208和64 669(变化倍数:2.26,P<0.05),是上调最为显著的miRNAs之一,见图1。
2.2 miR-124与Bcl-2表达在糖尿病性白内障患者晶状体前囊膜中呈负相关
凋亡在白内障发病过程中起重要作用,因此本试验通过qRT-PCR检测了miR-124与Bcl-2这一凋亡抑制蛋白的相关性。结果显示,miR-124与Bcl-2相对表达量分别为(0.537±0.068)和(1.621±0.424),两者表达呈负相关(r=-0.872 9,P=0.023 7),见图2。

图2 qRT-PCR法检测miR-124与Bcl-2表达相关性
2.3 miR-124可与Bcl-2启动子序列中相对于转录起始位点的核苷酸-645处结合
本试验使用RegRNA软件(http://regrna.mbc.nctu.edu.tw)搜索miR-124与Bcl-2的mRNA、靶基因以及调控序列中的互补结合位点。结果显示miR-124与Bcl-2启动子中相对于转录起始位点的核苷酸-645处序列高度互补,见图3。

A:Bcl-2启动子、CpG岛以及miR-124预测结合位点的示意图;B:结合位点位于相对于转录起始位点的核苷酸-645处;粗体部分表示启动子DNA有义链中的靶位点;红色部分为miR-124中与靶位点互补的碱基(包括摆动配对)。
2.4 miR-124通过与Bcl-2启动子序列结合进而下调Bcl-2的表达
为进一步验证miR-124可与Bcl-2启动子序列结合进而下调Bcl-2的表达,本试验合成了与预测的miR-124在Bcl-2启动子的靶位点完全互补的另一个dsRNA分子(dsBcl-2-640)。此外还设计并合成了一种与所有已知人类序列缺乏显著同源性的对照dsRNA(dsControl),见图4A—B。
试验分别将这2种dsRNA转染到LEC中,并在72 h后分析了Bcl-2蛋白的表达。Western Blot结果显示,与空白对照组相比,dsBcl-2-640组LEC细胞Bcl-2蛋白表达被沉默[(0.22±0.03)比(0.41±0.04),P<0.05],而下调miR-124表达则可显著提高高糖培养条件下LEC中Bcl-2的表达[(0.91±0.09)比(0.41±0.04),P<0.05]。此外dsControl组与空白对照组相比,Bcl-2蛋白表达差异无统计学意义[(0.44±0.03)比(0.41±0.04),P>0.05]。值得注意的是,miR-124 inhibitor和dsBcl-2-640对LEC进行共转染时,并没有进一步增加Bcl-2蛋白的表达[(0.37±0.03)比(0.41±0.04),P=0.76],这意味着2种dsRNA分子对Bcl-2启动子的靶位点彼此呈竞争性结合,也就是说二者实际上都靶向相同的位点。见图4C—D。

A:miR-124的序列和结构,红色序列对应于与目标位点互补的碱基;B:dsBcl-2-640的序列和结构;C:使用50 nmol·L-1的dsRNA转染LEC细胞72 h,利用Western Blot,以GAPDH为内参评估Bcl-2的表达量;D:转染LEC细胞后,Western Blot的定量分析;*P<0.05与空白对照组相比。
2.5 miR-124通过与Bcl-2启动子序列结合进而促进LEC细胞凋亡
将各组细胞培养在高糖环境中48 h,利用流式细胞术检测LEC细胞凋亡率。结果显示,与空白对照组相比,miR-124 inhibitor组LEC细胞凋亡率显著降低[(11.33±1.86)%比(25.81±2.33)%,P<0.05],dsBcl-2-640组LEC细胞凋亡率显著增加[(32.30±4.54)%比(25.81±2.33)%,P<0.05]。然而miR-124 inhibitor和dsBcl-2-640对LEC进行共转染时,并没有进一步影响LEC细胞凋亡率[(23.20±4.30)%比(25.81±2.33)%,P>0.05)]。此外dsControl组与空白对照组相比差异亦无统计学意义[(24.80±3.59)%比(25.81±2.33)%,P>0.05)],见图5。说明干扰Bcl-2表达后会逆转miR-124 inhibitor抗凋亡作用,这也提示了2种dsRNA分子实际上都靶向相同的位点。

图5 流式细胞术检测各组LEC细胞凋亡率
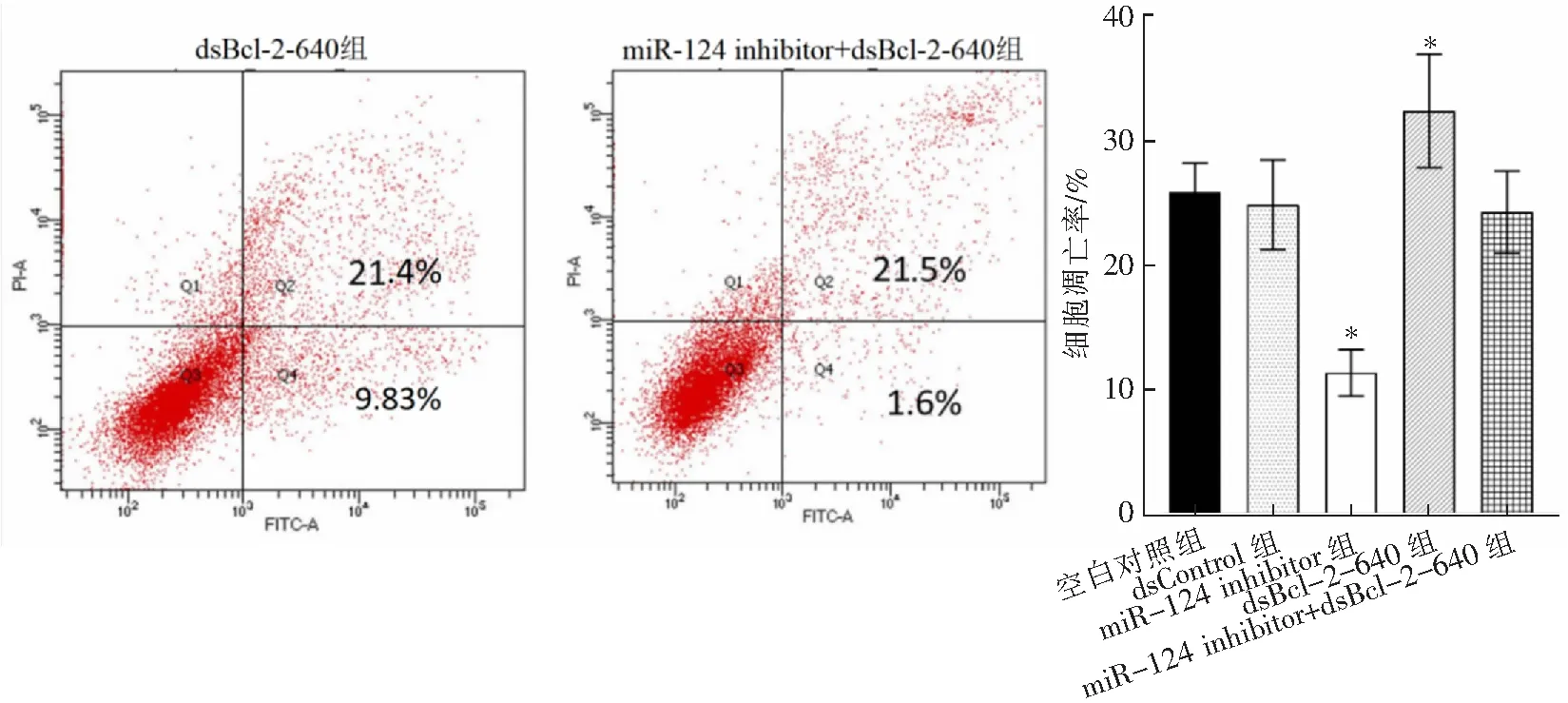
*P<0.05与空白对照相比。
3 讨论
miRNA是一类由内源基因编码的长度约为19~25个核苷酸的非编码单链RNA分子,具有与靶基因的3’端非翻译区结合从而抑制mRNA翻译或促进mRNA降解的能力[5]。随着下一代测序技术和生物信息学的发展,miRNA已成为国内外研究的热点。而miRNA在白内障发病机制中的作用也受到了越来越多的关注,其中尤其以miRNA对靶基因的负调控最为多见。如MiR-30a可以抑制晶状体上皮细胞中BECN1的表达[8]、miR-34a可以抑制晶状体上皮细胞中E2F3的表达[9]、miR-204可以抑制晶状体上皮细胞中TRPM3的表达[10]。随后PLACE等[11]发现并证实了miRNA不仅可以抑制靶基因的表达,而且也可以通过与靶基因的启动子序列结合从而上调靶基因的表达。
miRNA具有物种间保守性的同时,也表现出组织和细胞表达的特异性[12]。在本研究中,通过高通量测序,发现miR-124在糖尿病性白内障患者晶状体前囊膜中表达上调。据既往研究[13-18]报道,miR-124的主要功能与凋亡有关,但其效应机制存在组织特异性。如:在心肌梗死的发病机制中,miR-124通过靶向SphK1促进心肌细胞的凋亡[13];在冠状动脉粥样硬化的发病机制中,miR-124可下调小鼠MEKK3表达,抑制p38MAPK信号通路表达,进而促进巨噬细胞凋亡[14]。此外,miR-124还可通过抑制PI3K/AKT信号通路,促进活性氧(ROS)的产生,最终诱导脑血管内皮细胞凋亡[15]。CHE等[16]的研究显示miR-124还可通过激活Wnt/β-catenin信号通路抑制大鼠神经元凋亡。SHAO等[17]的研究也表明了miR-124对大鼠神经元凋亡有保护作用。陈艳文[18]的研究结果表明miR-124在中青年及老年白内障患者晶状体中高表达,然而目前尚无研究阐明miR-124对LEC凋亡的影响,因此本试验以miR-124为出发点探讨其在糖尿病性白内障发病过程中的作用。
通过qRT-PCR的相关性分析,本研究发现miR-124与Bcl-2这一凋亡抑制蛋白的表达有较强的负相关性。这提示了miR-124可能是通过调控Bcl-2启动子序列从而下调了Bcl-2表达。于是,本研究对Bcl-2启动子序列与miR-124的序列进行了比对,发现二者存在高度互补区。进一步细胞转染试验的Western Blot结果显示,在LEC细胞中下调miR-124可显著上调Bcl-2的表达。这证实了miR-124具有抑制Bcl-2表达的作用。在此基础上,本研究进一步利用高糖环境诱导LEC细胞凋亡,经流式细胞术结果显示,下调miR-124表达可以显著降低LEC细胞在氧化应激条件下的凋亡率,而dsBcl-2-640则可进一步上调LEC细胞在高糖环境中的凋亡,说明dsBcl-2-640与miR-124 inhibitor生物学作用相反。这也证明了miR-124可通过靶向Bcl-2启动子中相对于转录起始位点的核苷酸-645处序列参与抑制糖尿病性白内障患者LEC细胞凋亡。既往针对miR-124功能的研究[19-20]揭示了其针对不同的细胞类型即可促进凋亡也可抑制凋亡,因此尽管本研究揭示了miR-124抑制LEC细胞凋亡的一个途径,但并未排除miR-124通过其他途径发挥对LEC细胞凋亡调控作用的可能[21],也不排除miR-124是通过多条途径保持LEC细胞凋亡动态平衡的一个调控分子的可能性[22]。
本研究表明在糖尿病性白内障发生时,下调miR-124可能起到延缓糖尿病性白内障病情发展的作用,其作用机制之一可能与减弱对Bcl-2表达的影响有关,因此miR-124/Bcl-2轴有望成为糖尿病性白内障预防和治疗的潜在靶点。研究补充了人们对miR-124在糖尿病性白内障发病机制中作用的认识。
