方格星虫实时荧光定量PCR内参基因的选择与验证
2022-03-20彭冰冰宾东超周于娜杨志会蔡小辉彭银辉
彭冰冰,宾东超,周于娜,杨志会,蔡小辉,彭银辉
( 1.北部湾大学 海洋学院,广西北部湾海洋生物多样性养护重点实验室,广西 钦州 536011; 2.北海市渔业技术推广站,广西 北海 536000; 3.邢台市农业农村局,河北 邢台 054000 )
方格星虫(Sipunculusnudus),也称光裸方格星虫,又名“海人参”,属星虫动物门、方格星虫科、方格星虫属,广泛分布在滩涂或浅海区域,广西北部湾海域自然资源最丰富[1]。方格星虫营养丰富、味道鲜美,含丰富的蛋白质、多种氨基酸以及多种微量元素,具有抗疲劳、抗氧化、抗病毒、降血压、祛湿、清肺补虚等医药价值,素有“海洋冬虫夏草”的美誉[2-4]。
实时荧光定量PCR(qRT-PCR)是一种核酸定量技术,可以实现对初始模板的定量分析,具有定量准确、灵敏度高、特异性强等优点,在分子生物学研究领域的基因表达分析中发挥着重要作用[5]。但是在用实时荧光定量PCR技术对某一目的基因的不同样品的表达量进行数据处理和分析时,会受到起始RNA质量和数量、反转录效率、扩增效率以及不同细胞和组织间的差异等变量的影响[6]。因此要选择表达水平相对稳定的内参基因对目的基因的表达量进行参考和校正,确保结果的可信度[7]。同一组织的内参基因的表达基本没有差别,但是不同种类、不同试验条件的内参基因表达量并不一致,用不同内参基因校正会得到不一样的结果,所以选择合适的内参基因是试验的必要前提。
通过查阅相关文献并结合前期获得的方格星虫发育转录组数据库,共筛选出肌动蛋白家族(Actin1)、微管蛋白家族(α-Tub1)、核糖体蛋白(RPL13-b)、延伸因子1-α(EF1-α2)、H3-b(组蛋白)、甘油醛-3-磷酸脱氢酶(GAPDH1)6个方格星虫生命活动所必需的基因作为候选内参基因。肌动蛋白是一种细胞骨架蛋白,对细胞分裂、细胞运动以及细胞骨架的维持有重要作用,在多种植物的不同发育时期的花瓣和不同组织中均表现出较好的稳定性[8];α-Tub1基因是控制表达维持细胞骨架的基本组分蛋白基因[9],一些研究者指出,其为表达较为稳定的内参基因[10];核糖体蛋白是真核生物核糖体中表达丰富的一类蛋白,在蛋白合成、核糖体装配以及细胞的增殖和分化中起重要作用,RPL13-b基因作为稳定的内参基因用于多个物种实时荧光定量PCR中[11];延伸因子1-α是在mRNA翻译时促进肽链延伸的蛋白因子,具有保守性和稳定性[12];H3-b基因参与染色质的组装,协调折叠、包装DNA,通过调节基因的表达调控细胞的分裂、凋亡以及DNA的修复等细胞生命过程,在进化过程中高度保守[13];甘油醛-3-磷酸脱氢酶是糖酵解反应中的一种反应酶,具有修复DNA、促进细胞凋亡、调节组蛋白等多种作用[14],有较好的稳定性[15]。应用实时荧光定量PCR对方格星虫组织中的内参基因的表达量进行检测,筛选出相对稳定表达的内参基因并验证,结果将为方格星虫目的基因的定量分析提供参考。
1 材料与方法
1.1 材料
本试验所用方格星虫个体采自北部湾福成海域。使用盐酸普洛卡因(0.25%~0.5%)浸泡方格星虫5~10 min用于麻醉[16]。使用1 mL一次性注射器抽取方格星虫体腔液于装有CAD抗凝剂的离心管中,12 000 r/min离心5 min(离心机型号:sigma 2-16KP),获取血淋巴细胞,-80 ℃保存备用。使用剪刀剖取方格星虫虫体的体壁肌肉、吻、肾管、脑、肠道、收吻肌、食道,立即投入到液氮中,并转移至-80 ℃冰箱保存待用。
1.2 方法
1.2.1 总RNA提取
将方格星虫组织转移至500 μL Trizol中,按照TransZol Up说明书(Invitrogen,USA)提取各方格星虫组织的RNA。取2 μL RNA样品用核酸蛋白测定仪测定浓度和纯度,1%琼脂糖凝胶进行电泳检测完整性。
1.2.2 cDNA合成
按照北京全式金生物技术有限公司的TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix 说明书将提取到的方格星虫组织的RNA合成为cDNA。反应体系(20 μL):2×TS Reaction Mix 10 μL,500 ng total RNA, Random Primer 1 μL,EasyScript®RT/RI Enzyme Mix 1 μL, gDNA Remover 1 μL。扩增程序为:42 ℃反应59 min;85 ℃ 5 s,使EasyScript®RT/RI Enzyme和gDNA Remover失活;4 ℃保存。合成的cDNA于-20 ℃保存备用,用于实时荧光定量PCR分析。
1.2.3 基因引物选择和实时荧光定量PCR扩增
方格星虫6个候选内参基因(EF1-α2、α-Tub1、RPL13-b、Actin1、H3-b和GAPDH1)和免疫球蛋白(IgGFc-binding protein)基因序列为本课题组构建的方格星虫肌肉组织转录组数据,根据在线软件Primer3设计(表1),并于江苏东玄基因科技有限公司合成。实时荧光定量PCR检测内参基因特异性,以方格星虫脑组织的cDNA为模板,反应体系(12.5 μL):cDNA 0.5 μL,引物F和R各0.5 μL,r Taq 6 μL,超纯水5 μL。反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 30 s,35个循环;72 ℃ 10 min,16 ℃ 保存。反应完成后,取5 μL的扩增产物用1%琼脂糖凝胶电泳进行检验。

表1 本试验所用的引物序列Tab.1 Primer sequences used in this study
1.2.4 实时荧光定量PCR扩增
参照北京全式金生物技术有限公司的TransScript®Green qPCR SuperMix试剂盒说明书,QuantStudioTM 6 Flex Real-Time PCR System仪器上进行反应。反应体系(10 μL): cDNA 0.5 μL,引物F和R各0.4 μL,Passive Reference Day 0.2 μL,Nuclease-free water 3.5 μL。反应程序:95 ℃ 30 s;95 ℃ 5 s,56 ℃ 15 s,72 ℃ 10 s,40个循环;95 ℃ 5 s,70 ℃ 1 min,95 ℃ 15 s。每个反应设置3个平行。
1.3 数据分析
利用QuantStudioTM 6 Flex Real-Time PCR System软件获取引物熔解曲线和Ct值。统计各组平均值,减去每组中最小Ct值,得到ΔCt,并利用公式2-ΔCt得到Q值。应用geNorm、NormFinder和BestKeeper软件筛选出最稳定的内参基因并进行内参基因验证试验。
2 结 果
2.1 琼脂糖凝胶电泳结果
6个候选内参基因扩增产物的琼脂糖凝胶电泳结果见图1,每个候选内参基因的引物均扩增出了单一正确的产物,无可见的引物二聚体,说明引物的特异性良好。
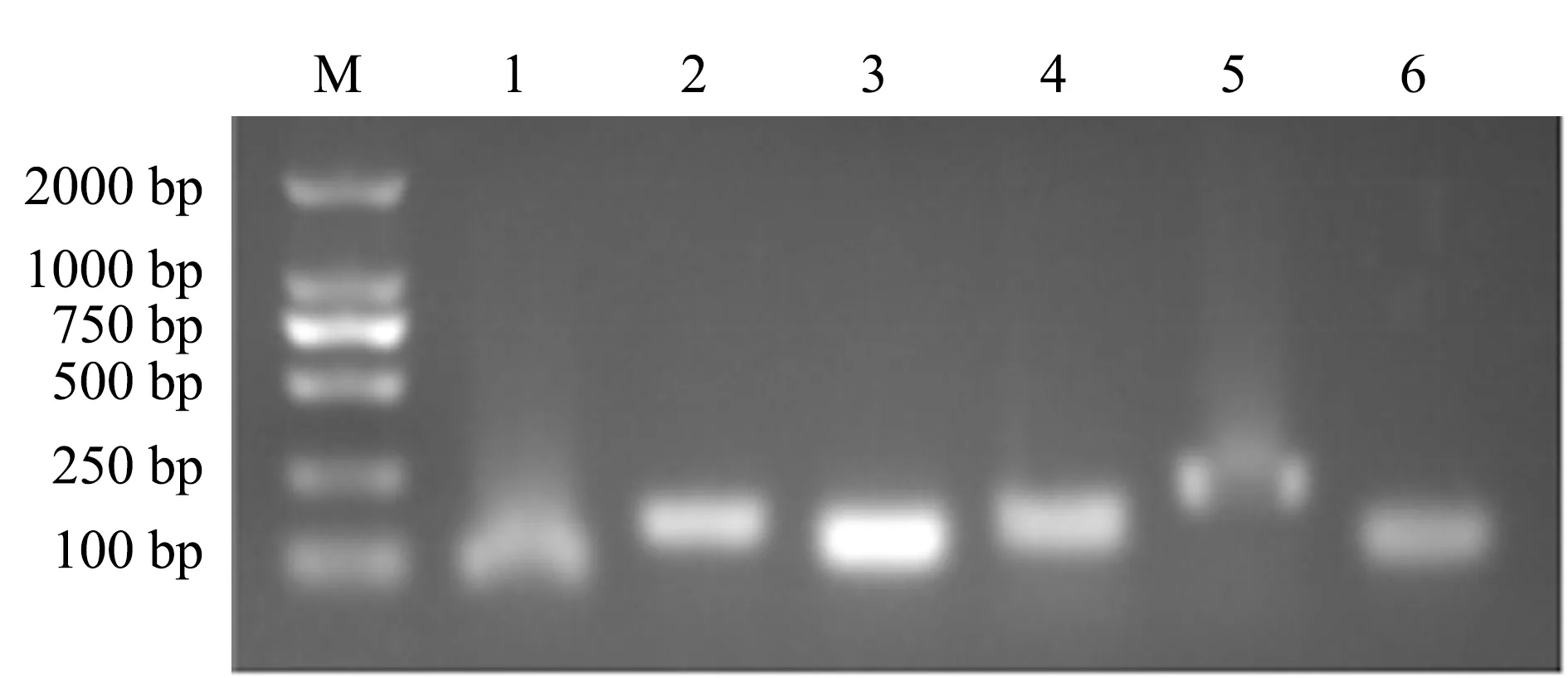
图1 候选内参基因扩增产物电泳结果Fig.1 Amplification products electrophoresis of candidate internal reference genesM.DNA maker; 1—6.Actin1, EF1-α2,H3-b,RPL13-b,GAPDH1 and α-Tub1.
2.2 熔解曲线
6个候选内参基因的熔解曲线见图2,均为单一的信号峰,说明6个候选内参基因扩增后未产生引物二聚体和非特异性条带。

图2 内参基因的熔解曲线Fig.2 Melt curves of internal reference genesa—f.Actin1, EF1-α2, H3-b, RPL13-b, GAPDH1 and α-Tub1; RFU.relative fluorescence unit.
2.3 内参基因的表达稳定分析
使用geNorm软件评估6个候选内参基因表达稳定性(M),基因的表达稳定值越小,表明稳定性越高。根据geNorm软件计算的表达稳定值排列顺序为:α-Tub1>Actin1>GAPDH1>EF1-α2>RPL13-b=H3-b(图3),候选内参基因稳定性顺序为:RPL13-b=H3-b>EF1-α2>GAPDH1>Actin1>α-Tub1,说明表达最稳定的基因是RPL13-b和H3-b。

图3 内参基因的表达稳定值Fig.3 The expression stability of internal reference gene
利用geNorm程序分析内参基因的配对差异值Vn/n+1,结果显示V2/3值最小,为0.267,大于程序推荐值0.15(图4),因此需要3个内参基因才能达到校正的目的。
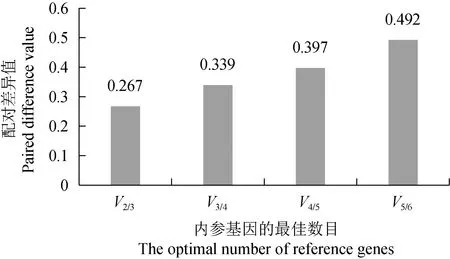
图4 内参基因的配对差异值Fig.4 The pairing differences of internal reference genes
进一步使用NormFinder软件对6个内参基因的表达稳定性进行分析,表达稳定值越小基因表达就越稳定。表达稳定值的顺序为:α-Tub1>Actin1>H3-b>GAPDH1>EF1-α2>RPL13-b。结果表明,候选内参基因稳定性顺序为:RPL13-b>EF1-α2>GAPDH1>H3-b1>Actin1>α-Tub1,RPL13-b的表达稳定值最小(表2),是表达最稳定的基因。

表2 内参基因的表达稳定值Tab.2 The expression stability of the internal reference genes
使用BestKeeper软件评估6个候选内参基因表达稳定性,变异系数越小表示稳定性越高,根据BestKeeper软件计算的变异系数排列顺序为:α-Tub1>Actin1>GAPDH1>EF1-α2>H3-b>RPL13-b(表3),则候选内参基因稳定性顺序为:RPL13-b>H3-b>EF1-α2>GAPDH1>Actin1>α-Tub1。结果表明,RPL13-b的变异系数最小,是表达最稳定的基因。

表3 内参基因的变异系数Tab.3 Coefficient of variation in internal reference genes
2.4 内参基因稳定性的验证
为验证内参基因的稳定性,在方格星虫组织试验体系中分别选择稳定性排名最高和最低的内参基因RPL13-b和α-Tub1,对免疫球蛋白基因的表达水平进行分析。采用稳定性好的内参基因RPL13-b对实时荧光定量PCR数据进行校准时,免疫球蛋白基因在吻中表达量最高,在其他组织中表达量较低(图5)。但是采用最不稳定的内参基因α-Tub1对实时荧光定量PCR数据校准时,免疫球蛋白基因表达水平在收吻肌中表达量最高,血淋巴细胞和吻中次之,其他组织均较低。因此,使用不同内参基因标准化免疫球蛋白基因的表达会呈现不同模式。
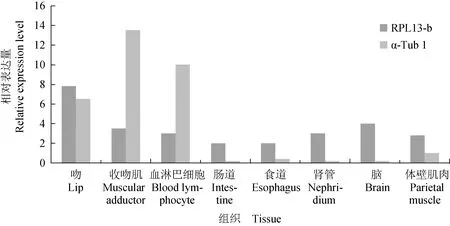
图5 不同内参基因校准后的目的基因IgGFc-binding protein在方格星虫组织中的相对表达量Fig.5 Relative expression level of target gene IgGFc-binding protein in peanut worm S. nudus after calibration with different internal reference genes
3 讨 论
3.1 实时荧光定量PCR及内参基因的特性
实时荧光定量PCR是一种灵敏度高、特异性强、重现性好的常用的基因表达分析方法[17-18],但是容易受到试验中多种变量的影响,需要选定合适的内参基因作为校正,内参基因即内部参照基因,它们在各组织和细胞中的表达相对恒定,在检测基因的表达水平变化时常以其作为参照物。但是在所有试验条件下普遍适用的内参基因基本不存在[19],董晓丽等[20]在小鼠研究中发现,同一个体不同组织中基因的表达稳定性会不同;鲍相渤等[21]在虾夷扇贝(Patinopectenyessoensis)的相关研究中发现,在不同处理条件下基因的表达稳定性存在差异;王忠伟等[22]在籽鹅的相关研究中发现,不同发育时期基因的表达稳定性也会不一样;因此对内参基因进行评估和筛选是保证试验结果准确性的必要前提[23]。然而,有关方格星虫内参基因的研究非常少,张家炜等[24]分别对方格星虫不同发育时期卵细胞和全组织的内参基因进行分析筛选,分别得出了18S rRNA和GAPDH基因为最优内参基因的结论。
3.2 方格星虫内参基因的筛选
本试验利用实时荧光定量PCR对Actin1、α-Tub1、RPL13-b、EF1-α2、H3-b、GAPDH1共6个候选内参基因在方格星虫不同组织中的表达情况进行分析,并利用相关统计软件GeNorm、NormFinder、BestKeeper[25]对这6个候选内参基因进行稳定性分析。结果显示,RPL13-b基因的表达稳定性最高,这与在尖裸鲤(Oxygymnocyprisstewartii)[26]和鳜(Sinipercachuatsi)[27]中的研究结果一致,筛选出RPL13基因为适宜内参基因。而费越越等[28]发现,在健康异育银鲫(Carassiusauratusgibelio)的不同组织中,EF1-α2基因表达最为稳定;吴萍等[29]在鳜的研究中发现,18S rRNA和GAPDH基因的表达最稳定;张家炜等[30]在方格星虫全组织中筛选出TATA结合蛋白TBP(1)基因为实时荧光定量PCR的最适单内参基因。这可能是选择不同物种和不同内参基因导致的结果。
3.3 内参基因的稳定性分析
geNorm与NormFinder软件的算法相似[31],都是通过比较平均表达稳定值的大小来进行候选内参基因的稳定性评价,表达稳定值越小表示越稳定。geNorm可以引入1个新的内参基因的配对差异值V,根据配对差异分析Vn/n+1来确定最合适的内参基因数量。当Vn/n+1<0.15时,最适内参基因数为n;当Vn/n+1>0.15时,最适内参基因数为n+1[32]。本试验中,V2/3=0.267>0.15,故需要3个内参基因做校正,分别是RPL13-b、H3-b、EF1-α2。BestKeeper软件直接导入Ct计算标准差和变异系数,比较标准差和变异系数的大小。标准差和变异系数越小,内参基因的稳定性越高。不同软件计算的稳定性分析不完全一致[33],但综合来说,RPL13-b内参基因的表达稳定性高。为了进一步验证所筛选内参基因的稳定性,使用最稳定的内参基因RPL13-b和最不稳定的内参基因α-Tub1,对免疫球蛋白基因的表达水平进行分析,结果表明使用不同内参基因标准化免疫球蛋白基因的表达呈现不同模式。
4 结 论
本试验利用实时荧光定量PCR对方格星虫Actin1、α-Tub1、RPL13-b、EF1-α2、H3-b、GAPDH1共6个候选内参基因在不同组织中的表达情况进行分析,利用统计软件GeNorm、NormFinder、BestKeeper分析了候选内参基因稳定性,并使用最稳定的内参基因RPL13-b和最不稳定的内参基因α-Tub1,对免疫球蛋白基因的表达水平进行分析,结果表明,RPL13-b基因在方格星虫各组织中的表达最稳定,可作为方格星虫的最适单内参基因。
