2019新型冠状病毒核酸检测体系性能验证
2022-03-19龚纯全傅后榜张恒超支林俊
吴 剑 龚纯全 傅后榜 龚 虹 张恒超 支林俊 徐 媛 刘 宇
福建省邵武市立医院检验科,福建省邵武市 354000
自2019年12月以来,2019-nCoV所造成的疫情已对全球公共卫生安全造成了巨大的威胁,给全世界的政治、经济带来了巨大压力。在2019-nCoV所导致的冠状病毒病(COVID-19)疫情阻击战中,新冠病毒核酸检测成了疫情排查的重要手段。在国家卫健委发布的多版新冠病毒肺炎诊疗指南中均将实时荧光RT-PCR 检测新型冠状病毒核酸阳性作为诊断COVID-19的“金标准”[1]。依据国务院应对新型冠状病毒肺炎疫情联防联控机制医疗救治组发布的《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》中“实验室质量控制与管理”对性能验证的要求[2],为评估本实验室的新冠核酸检测体系是否能在质量上满足临床的需要,参照CNAS-GL02《医学实验室质量和能力认可准则》(ISO15189:2007)对医学实验室检测系统性能评价的相关要求,结合CNAS-GL039《分子诊断检验程序验证指南》对本实验室采用的新冠核酸检测体系进行性能验证实验。
1 材料与方法
1.1 样本来源 阳性样本:2019-nCoV核酸检测试剂盒内阳性对照品(四川迈克生物股份有限公司,批号:0121101,-20℃保存);第三方新型冠状病毒核酸检测弱阳性质控品(北京康彻斯坦生物科技有限公司,批号:202012008,浓度:1 000copies/ml,-20℃保存];新型冠状病毒核糖核酸基因组标准物质[中国计量科学研究院,编号:GBW(E)091098,批次编号:2001,定值日期:2020年2月27日,-70℃保存]。阴性样本:健康人阴性标本。所有样本均一次冻融。
1.2 试剂与仪器 采样管(灭活型,康康医疗器械,规格DVSI-3.0-1,批号:210124),内含RNA保存液。核酸提取试剂盒(重庆中元汇吉生物技术有限公司,批号:5101143),2019-nCoV核酸检测试剂盒(四川迈克生物股份有限公司,批号:0121101),全自动核酸提取仪(山东博科BK-HS32),实时荧光定量PCR分析仪(罗氏LightCycler480II)。
1.3 方法
1.3.1 检验原理。磁珠法提取出新冠病毒核酸后,利用针对2019-nCoV(ORF1ab/E/N基因)设计的特异性引物和荧光探针,应用实时荧光定量PCR技术,通过监测荧光信号的变化实现对新冠病毒核酸的定性检测。
1.3.2 反应体系。qRT-PCR反应液17μl与qRT-PCR酶混合液3μl共同组成qRT-PCR混合液,加入已提取出的待测核酸或处理好的质控品20μl,形成终体积为40μl的样本,以含有内参检测基因的RNA假病毒为内对照,FAM通道采集ORF1ab基因荧光信号,ROX通道采集E基因荧光信号,CY5通道采集N基因荧光信号,VIC通道采集内对照荧光信号。结果判断:根据试剂说明书中所说明的扩增曲线及循环阈值(Ct值)进行判读。
1.3.3 阴阳性符合率验证。阳性符合率:20例添加新型冠状病毒核糖核酸基因组标准物质的临床样本作为真实临床阳性样本的替代,其中10例配制为接近1.5倍最低检测限浓度水平(750copies/ml,编号P1~P10),另10例配制为接近4倍最低检测限浓度水平(2 000copies/ml,编号P11~P20);阴性符合率:20例阴性样本为健康人阴性样本。根据检测结果与临床判断是否一致,计算阳性、阴性符合率,若≥95%,则该检测体系的阴阳性符合率能达到要求。
1.3.4 精密度验证。批内精密度:同一天内分别同时分析试剂盒内阳性对照与第三方弱阳性质控品,每个样本重复检测20次,收集实验数据进行统计分析,以变异系数(CV)≤5%为合格标准;批间精密度:每天分析试剂盒内阳性对照与第三方弱阳性质控品,每个样本重复检测4次,连续测定5d,收集实验数据进行统计分析,以变异系数(CV)≤5%为合格标准。
1.3.5 最低检测限验证。将新型冠状病毒核糖核酸基因组标准物质用采样管内RNA保存液稀释至2019-nCoV核酸检测试剂盒厂家声明的最低检测限浓度(500copies/ml),每个基因使用检测体系重复提取、扩增10次,≥95%样本检测呈阳性,则最低检测限验证通过。
1.3.6 交叉反应验证。考虑核酸序列具有同源性,将易引起相同或相似临床症状的其他病原体及人基因组DNA,包括:人冠状病毒 HCoV-229E(1.0×104~1.0×105copies/ml)、人冠状病毒 HCoV-OC43(1.0×104~1.0×105copies/ml)、人冠状病毒 HCoV-HKU1(1.0×104~1.0×105copies/ml)、人冠状病毒 HCoV-NL63(1.0×104~1.0×105copies/ml)、人冠状病毒 MERS-Cov(1.0×104~1.0×105copies/ml)、EB病毒(1.0×104~1.0×105copies/ml)、甲型流感病毒(5.4×106copies/ml)、乙型流感病毒(2.5×106copies/ml)、人副流感病毒Ⅰ型(2.4×106copies/ml)、人巨细胞病毒(1.8×103IU/ml)、肺炎支原体(1.0×106~1.0×107copies/ml)、腺病毒Ⅰ型(1.0×104~1.0×105copies/ml)、人基因组DNA定量标准物质(3.59×104copies/μl),对以上样本利用本核酸检测体系提取、扩增,进行交叉反应验证,结果如为阴性,表明本检测体系与上述样本无交叉反应。

2 结果
2.1 阴阳性符合率 阳性样本的ORF1ab基因、N基因与E基因的Ct值均<37,判断为阳性结果,阳性符合率100%(见图1);阴性样本未出扩增曲线及Ct值,阴性符合率100%。

图1 阳性样本ORF1ab基因、N基因与E基因的Ct值
2.2 精密度 阳性对照与弱阳性质控品ORF1ab基因、N基因与E基因的批内精密度(见表1)CV≤5%,批间精密度(见表2)CV≤5%,该检测体系精密度符合要求。
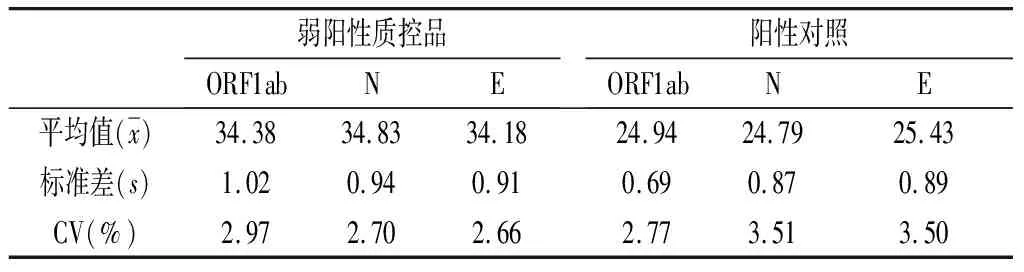
表1 弱阳性质控品与阳性对照ORF1ab基因、N基因与E基因批内精密度
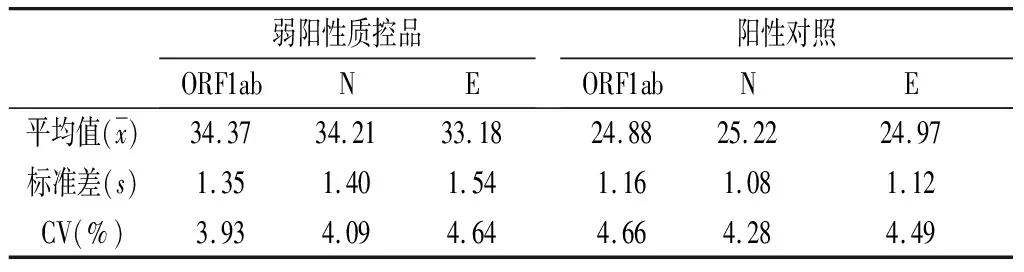
表2 弱阳性质控品与阳性对照ORF1ab基因、N基因与E基因批间精密度
2.3 最低检测限 新型冠状病毒核糖核酸基因组标准物质稀释至2019-nCoV核酸检测试剂盒厂家声明的最低检测限浓度(500copies/ml)的每个基因重复提取、扩增10次,每次均出现了扩增曲线,Ct值均<37,判断为阳性,检出率100%,厂家申明的最低检出限得到验证(见表3、图2~4)。
图2 标准物质稀释至500copies/ml,ORF1ab基因扩增曲线

表3 标准物质稀释至500copies/ml,ORF1ab基因、N基因与E基因扩增结果
2.4 交叉反应 对人类冠状病毒(HKU1、OC43、NL63和229E)、MERS冠状病毒、甲型流感病毒、乙型流感病毒、人副流感病毒Ⅰ型、腺病毒Ⅰ型、EB病毒、人巨细胞病毒、肺炎支原体及人基因组DNA进行检测,结果均为阴性,本检测体系对上述样本无交叉反应,特异性好(见表4)。
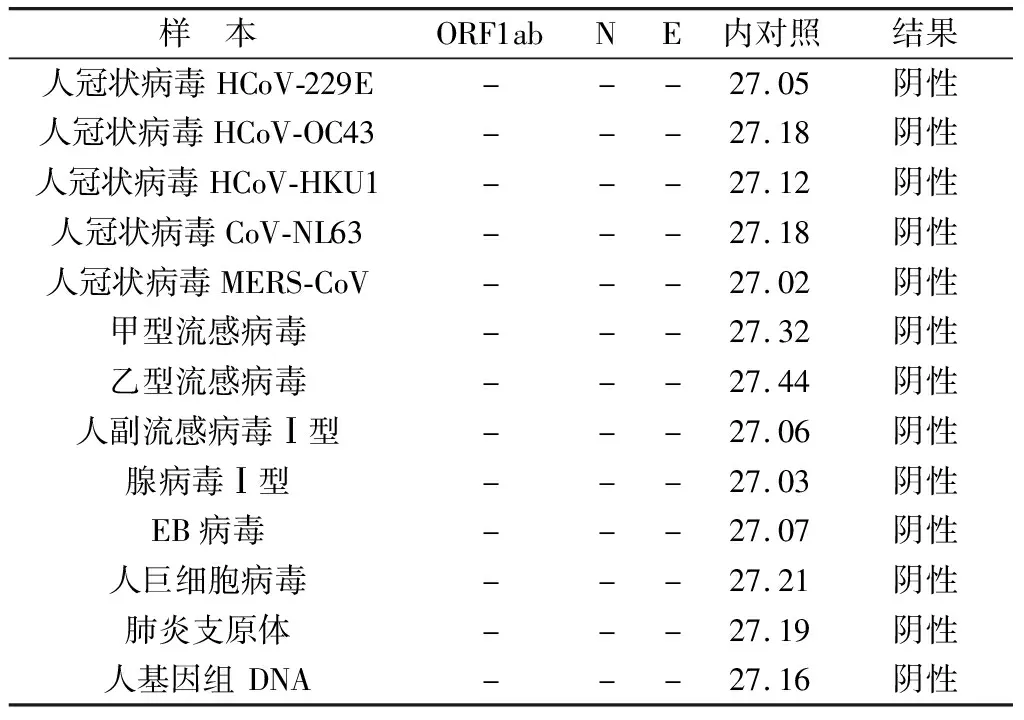
表4 交叉反应验证结果
3 讨论
2019-nCoV属于冠状病毒科,β冠状病毒属,直径为60~140nm[3]的单股正链RNA病毒。2019-nCoV经呼吸道飞沫、接触或气溶胶[4]等传播途径入侵机体后与细胞表面ACE2受体结合而进入宿主细胞,复制增殖,从而导致以发热、咳嗽、呼吸困难与乏力为主要表现的临床症状[5-8],约20%的患者会进展为多器官功能障碍[7,9-10]。
核酸检测作为COVID-19疫情排查的工作重点之一,质量保证尤为重要。有研究表明[11]不同的新冠核酸检测试剂对样本的检测能力存在差异。新冠核酸检测所包含的试剂仪器有采样管、核酸提取试剂、核酸扩增试剂及相应的仪器,其中任何一个环节出现问题,均会影响新冠核酸检测的结果。采样管中的病毒保存液分为灭活型与非灭活型,灭活型主要是在病毒保存液中添加胍盐,有研究标明[12]胍盐灭活导致的假阴性更少,但另有研究表明,胍盐的浓度是否合适,对提取效果的影响非常大[13]。核酸提取在新冠核酸检测中的作用不可轻视,是检测结果精密度的重要保证[14]。用于新冠核酸提取的方法主要有磁珠分离法、离心柱法与一步法,目前实验室最常用的核酸提取方法是磁珠分离法,但据中国海洋大学的研究人员研究表明:不同的磁珠对标本的亲和性不同[15],因此,不同的提取试剂根据其标本、磁珠、试剂用量及洗涤次数的不同,提取效能是有差异的。目前各医疗机构新冠核酸扩增主要运用反转录PCR扩增(RT-PCR)与等温扩增两种技术,两种方法各具优势:RT-PCR技术成熟度最高,应用最为广泛,而等温扩增不需要反复升降温就可实现核酸的扩增,可以达到快速检测的目的。综上所述,在核酸采样、提取与检测过程中的每一步,都会影响到检测质量,因此,选择配套仪器试剂时,性能验证是非常重要的一环。
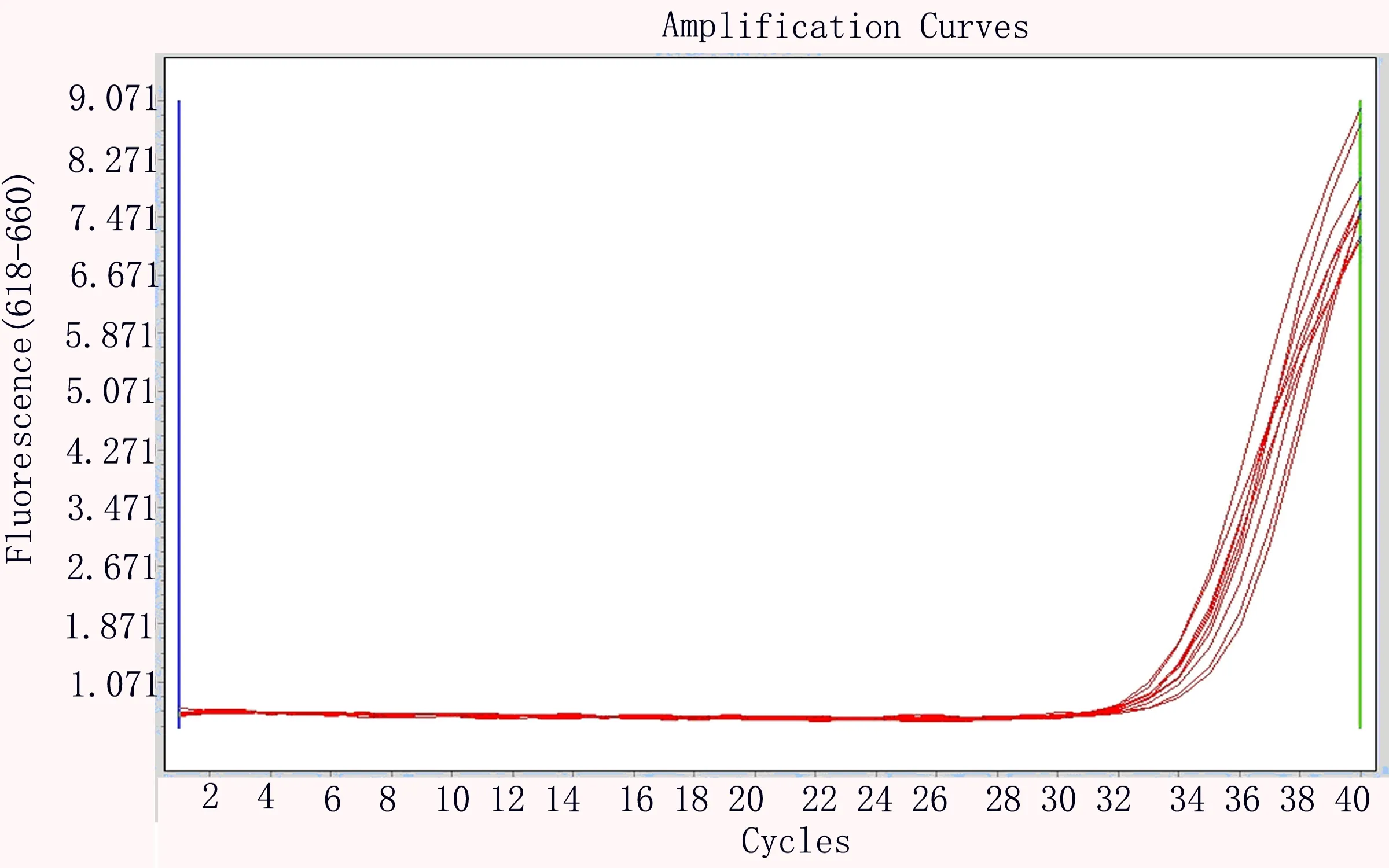
图3 标准物质稀释至500copies/ml,N基因扩增曲线
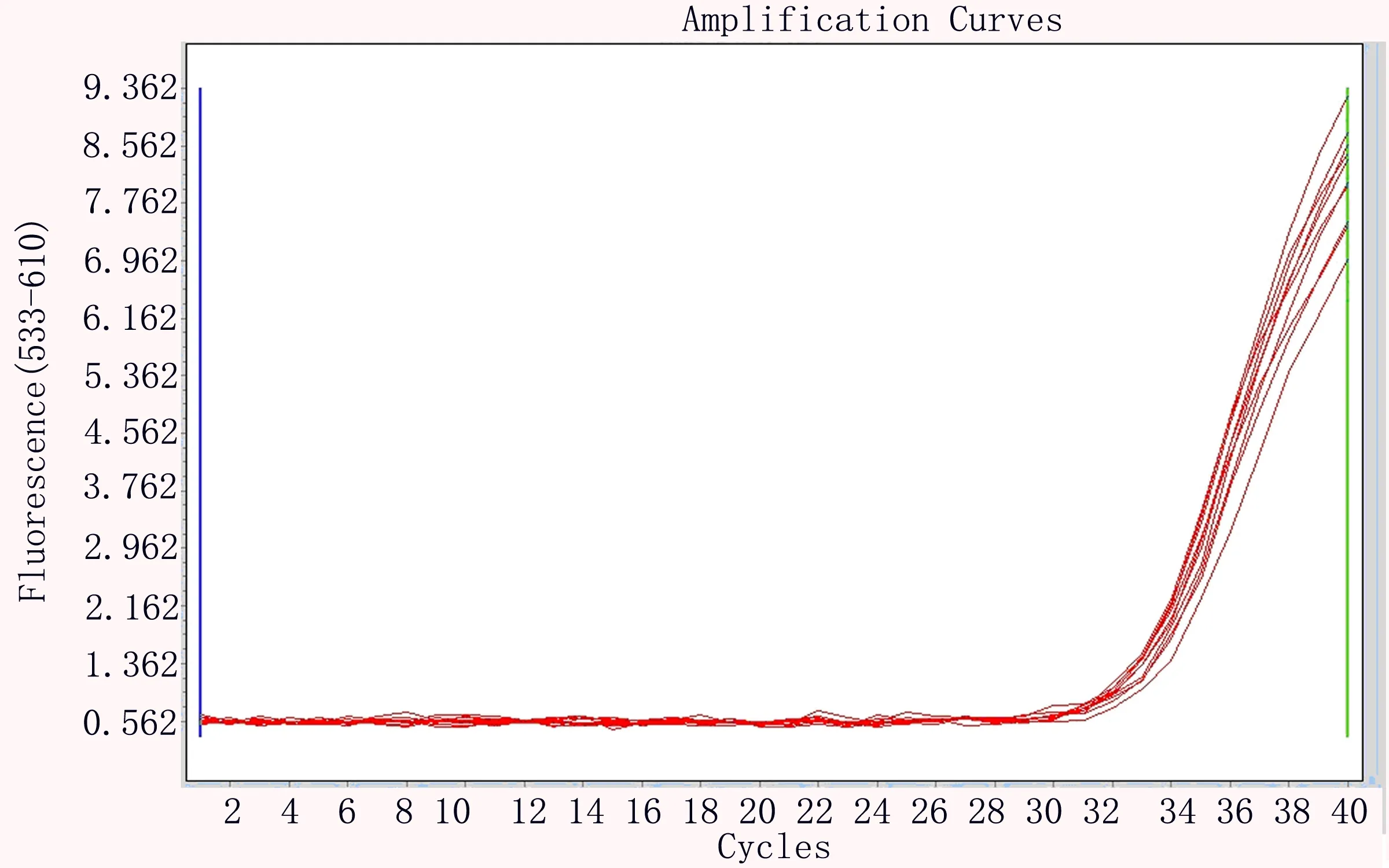
图4 标准物质稀释至500copies/ml,E基因扩增曲线
经本次性能验证发现,本实验室采用的康康医疗器械生产的采样管、重庆中元汇吉生物技术有限公司生产的核酸提取试剂(磁珠法),四川迈克生物股份有限公司生产的2019-nCoV核酸检测试剂盒与山东博科生产的全自动核酸提取仪(BK-HS32)及罗氏公司的实时荧光定量PCR分析仪(LightCycler480II)在2019-nCoV核酸检测配套使用时,阴阳性符合率一致,重复性好,最低检测限与厂家声明一致,与能引起相同或相似临床症状的其他病原体及人基因组DNA不产生交叉反应,特异性好,能够在质量上保证临床新冠核酸检测的需要,可为其他实验室选择检测体系配套方案提供参考依据。但本研究仅对检测体系的一个批号进行验证,并且本实验室自开展新冠核酸检测以来并未发现阳性病例,未采用真实阳性临床样本进行性能验证,故后续还应对不同批号做性能测试,且与多家实验室进行结果比对。
