类风湿关节炎滑膜中PGC-1β的表达水平及其临床意义
2022-03-19吴东霞李修玲
宋 良 吴东霞 李修玲
湖南省怀化市第一人民医院风湿免疫科 418000
类风湿关节炎(Rheumatoid arthritis,RA)是以侵蚀性关节炎为主要症状的自身免疫病,其病理基础是滑膜炎,而滑膜炎是骨及软骨发生侵蚀破坏的重要因素[1]。过氧化物酶体增殖物激活受体γ辅激活因子(Peroxisome proliferator-activated receptor γ coactivator,PGC)-1β是种多功能的转录调节因子,参与了多个生物学过程,例如线粒体的合成、炎症反应及细胞分化等[2]。有基础研究[3]发现,PGC-1β能够诱导小鼠单核巨噬细胞向破骨细胞分化及活化;也有临床研究[4]显示,相比于骨关节炎患者,PGC-1β在RA患者中的表达水平明显增高。目前,关于RA患者滑膜中PGC-1β表达水平上调的临床意义方面的研究报道很少见。基于此,笔者通过探讨RA患者滑膜组织中PGC-1β表达水平与疾病活动情况及影像学关节破坏情况的相关性,以期为临床提供参考依据。
1 资料与方法
1.1 一般资料 连续性纳入2020年1—12月在我院住院治疗的90例RA患者,男40例,女50例,年龄38~68(52.17±4.22)岁,病程12~115(64.58±10.70)个月,78例(86.67%)患者类风湿因子(RF)阳性,血沉(ESR)为(45.22±3.53)mm/h,C反应蛋白(CRP)为(21.25±2.35)mg/L,基于CRP的28个关节疾病活动度评分(DAS28-CRP)为(5.89±0.69)分,改良Sharp评分(mTSS)为(21.53±4.30)分,关节间隙狭窄评分为(9.44±1.50)分,关节侵蚀评分为(13.28±2.37)分。本研究经过医学伦理审查,患者均知情同意。
1.2 纳入及排除标准 (1)纳入标准:①RA的诊断符合《2018中国类风湿关节炎诊疗指南》[5];②患者年龄≥18岁;③临床资料完整;④患者的诊疗依从性较好;⑤近1个月未使用激素或抗风湿药物。(2)排除标准:①伴有严重心血管、呼吸、血液及肝肾系统等疾病;②伴有感染、恶性肿瘤、代谢性疾病等;③意识障碍或精神异常者;④妊娠期及哺乳期人群。
1.3 免疫组化法检测滑膜组织中PGC-1β的表达 行滑膜活检术,取膝关节滑膜组织,经过固定、脱水及包埋后连续切片,然后进行HE染色及免疫组化染色。采用免疫组化检测滑膜组织中PGC-1β阳性细胞占滑膜总细胞数的比例,包括滑膜衬里层及衬里下层PGC-1β阳性细胞比例。
1.4 疾病活动指标与影像学关节破坏指标的测量 (1)疾病活动指标:ESR、CRP、DAS28-CRP评分;采用血沉仪检测患者的ESR水平;采用酶联免疫吸附试验测定患者的血清ESR水平;DAS28-CRP评分是评估RA患者疾病活动度的常用方法,RA缓解期:DAS28-CRP评分<2.6分,RA低度活动期:2.6分≤DAS28-CRP评分<3.2分,RA中度活动期:3.2分≤DAS28-CRP评分≤5.1分,RA高度活动期DAS28-CRP评分>5.1分。(2)影像学关节破坏指标:对患者双手进行X线检查,以手及腕部的27个部位作为评分点,进行mTSS评分、关节间隙狭窄评分、关节侵蚀评分;关节侵蚀评分:骨侵蚀为0分,广泛骨侵蚀和丢失为5分,介于两者之间为2~4分;关节间隙狭窄:无狭窄为0分,局部狭窄1分,弥漫狭窄但面积<50%为2分,弥漫狭窄、面积>50%为3分,强直为4分;mTSS评分为关节间隙狭窄评分与关节侵蚀评分之和。

2 结果
2.1 滑膜中PGC-1β的表达情况 RA患者滑膜组织中PGC-1β阳性细胞比例为(83.57±6.33)%,其中滑膜衬里层的PGC-1β阳性细胞比例为(77.90±4.15)%,滑膜衬里下层PGC-1β阳性细胞比例为(86.75±8.40)%。见图1。
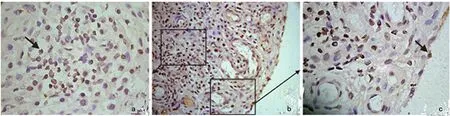
图1 PGC-1β在RA患者滑膜衬里层及衬里下层细胞中的表达情况
2.2 PGC-1β表达水平与疾病活动指标及影像学关节破坏指标的相关性 RA患者滑膜组织中PGC-1β表达水平与ESR、CRP、mTSS评分、关节间隙狭窄评分及关节侵蚀评分呈明显正相关(P<0.05),与DAS28-CRP评分无明显相关性(P>0.05)。见表1。
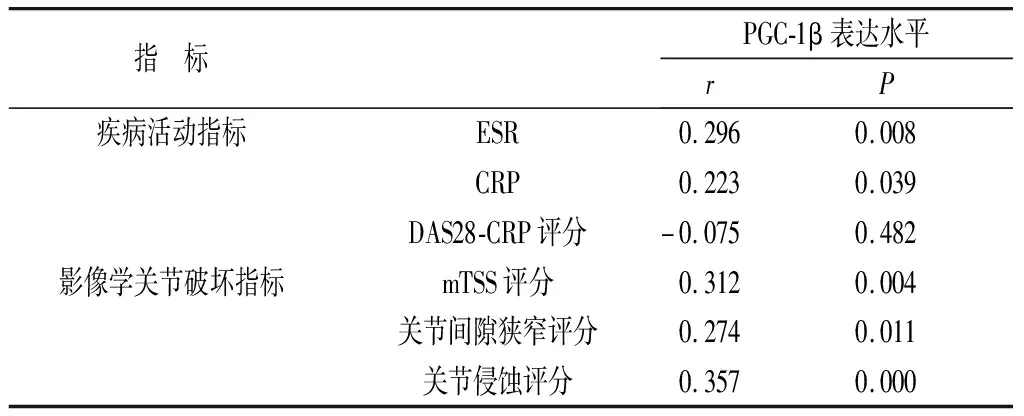
表1 RA患者滑膜组织中PGC-1β表达水平与疾病活动指标及影像学关节破坏指标的相关性
3 讨论
慢性滑膜炎是RA的主要病理特征,滑膜衬里层及衬里下层出现炎症细胞浸润是主要病理表现。早期的研究[6]发现,RA患者滑膜组织中单核—巨噬细胞在炎症反应及关节软骨破坏的病理生理过程中扮演者重要的角色。RA滑膜组织中的单核—巨噬细胞不仅能够分泌肿瘤坏死因子-α、白介素-6等促炎因子,还可分泌炎性趋化因子,导致炎症反应的发生。除此之外,在巨噬细胞集落刺激因子及NF-κB受体活化因子的共同作用下,单核—巨噬细胞能够融合成为破骨细胞,在促炎细胞因子的作用下增加骨吸收能力,导致骨关节发生破坏[7]。有研究[8]显示RA患者滑膜组织中CD68+巨噬细胞数量与疾病活动情况呈正相关。但是目前关于RA患者滑膜组织中单核—巨噬细胞向破骨细胞进行分化的具体机制还不清楚。
PGC-1β是一种共激活转录因子,在细胞因子信号转导中起到核心作用。有研究[9]显示,下调RA成纤维样滑膜细胞中PGC-1β的表达能够通过对NF-κB等信号通路的磷酸化水平进行抑制,从而对炎症因子的产生进行抑制,提示PGC-1β有可能作为调控RA炎症的新靶点。本文发现,PGC-1β在RA患者滑膜滑衬里层及衬里下层均有不同程度的表达,而滑膜组织中PGC-1β表达水平与ESR、CRP呈明显正相关,提示PGC-1β可能参与了RA炎症反应过程,并且具有重要作用。动物实验[10]显示,条件敲除造血细胞PGC-1β的小鼠股骨骨量明显增高,提示PGC-1β可能参与了骨吸收的调控过程;体外实验[11]还显示,小鼠骨髓细胞转铁蛋白的缺失能够对巨噬细胞的增殖进行刺激,增高 PGC-1β的表达,从而促进破骨细胞的形成。本文结果显示,RA患者滑膜组织中PGC-1β表达水平与mTSS评分、关节间隙狭窄评分及关节侵蚀评分呈明显正相关,提示PGC-1β可能在RA患者关节骨破坏的过程中扮演着重要的角色。
综上所述,RA患者滑膜组织中PGC-1β与全身炎症反应及关节破坏存在密切关系,可能参与了全身炎症反应及关节破坏过程,但是具体机制还需进行深入研究。
