高效液相色谱法测定饲料中替米考星含量
2022-03-19秦丽波张梦丽周兰兰
牛 蓉, 秦丽波 , 张梦丽, 周兰兰
(1.河南宏信检测技术有限公司农产食品检测中心,河南南阳 473000;2.牧原食品股份有限公司品控部,河南南阳 473000)
替米考星是一种较新的以泰乐菌素为前体的半合成大环内酯类畜禽专用抗生素, 其分子式为C46H80N2O13,相对分子质量为869.15,白色粉末状,由顺式和反式异构体组成, 比例为85:15 (余军军,2021;Zhang,2021)。替米考星主要作用与其他大环内酯类药物相同, 对革兰氏阳性菌有明显的活性, 对部分革兰氏阴性菌及支原体也有一定的活性,主要用于由敏感菌引起的感染性疾病,特别是畜禽呼吸道感染疾病(Wang,2021)。 替米考星的靶组织为肺脏,可在肺部明显蓄积,其饲料药物添加剂仅批准用于猪,休药期为7 d,可促进猪群生长发育,提高饲料利用率。但是由于抗生素在养殖行业的滥用,抗生素残留、环境污染、细菌耐药性等问题接踵而来, 随着人类对食品安全及环境卫生的要求不断提高, 减抗禁抗势在必行(由大鹏,2021;李朝云,2020)。2019 年7 月10 日,中华人民共和国农业农村部发布194 号公告:2020 年7 月1 日起, 饲料生产企业停止生产含有促生长类药物饲料添加剂(中药类除外)的商品饲料(刘宏伟,2019;蔺春文,2019),这标志着我国饲料行业将全面进入“禁抗”时代。 这就要求尽快建立完善对应的有关饲料中的抗生素质量检测的标准。
目前关于替米考星的检测方法主要集中在牛肉、猪肉、羊肉、鸡肉、蜂蜜、鱼类、牛奶等动物源性食品上 (姚禅媛,2018;Zhao,2017;Jank,2015;杨迪,2014;Le,2013;Spisso,2010),《GB 31650-2019食品安全国家标准食品中兽药最大残留限量》中公布了替米考星在不同动物靶组织中的残留限量。 替米考星的残留通常在牛肾脏、肝脏和注射部位中含量最高(Horie,2013)。猪和羊在投喂了替米考星后,大部分药经粪便排出,而原形药多聚集于肝和肾内,肌肉等部位的残留物浓度较小,整体处于正常水平(Granelli,2008)。 而对于禽类来说,肝中含有最高残留浓度,肾脏次之,残留最低的是肌肉、脂肪、皮肤(焦润,2021;Leroy,1994)。
关于饲料中替米考星的测定方法仅有农业部发布的《农业部783 号公告-4-2006 饲料中替米考星的测定 高效液相色谱法》, 该法前处理较为简单,但上机检测时间过长。闫小峰等(2010)报道的饲料中替米考星检测方法上机时间较短, 但前处理操作步骤较为复杂,整体检测耗时长。本文旨在建立一套操作简单、重复性好、准确度高的饲料中替米考星含量的高效液相色谱检测方法, 为饲料中替米考星的质量检测提供理论依据。
1 材料与方法
1.1 材料与试剂 替米考星标准品, 含量80.70%,德国Dr.Ehrenstorfer 公司;甲醇、乙腈为色谱级,美国天地有限公司;二丁胺、磷酸、四氢呋喃、甲酸均为分析级,国药集团化学技术有限公司。
1.2 仪器与设备 Waters E2695-2489 高效液相色谱仪,美国沃特世公司;HU20500B 超声波清洗器,深圳市朗杰超声电器有限公司;隔膜真空泵,天津市津腾实验设备有限公司;MS105DU 电子天平,梅特勒-托利多国际贸易(上海)有限公司;MVM-200 多管混匀仪,南京祥中生物科技有限公司;DD5000 离心机,四川蜀科仪器有限公司。
1.3 标准溶液配制 替米考星标准储备溶液:1 mg/mL。称取标准品10 mg(相当于替米考星),用乙腈溶解并定容至10 mL,溶液浓度为1 mg/mL,置于-18 ℃冰箱避光保存,保存期12 个月。标准曲线的制备:分别准确吸取10、20、50、100、200、500 μL标准储备液于不同1.5 mL 离心管中, 用水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)定容至1.0 mL,配制成10、20、50、100、200、500 μg/mL 标准系列溶液,过滤后待测。
1.4 试剂配制 1 mol/L 磷酸二丁胺缓冲液(DBAP):在700 mL 水中加入168 mL 二丁胺,然后缓慢加入70 mL 磷酸,边加边搅拌,振荡使二丁胺溶解, 冷却至室温, 用磷酸调节pH 至2.5±0.1,转移至1000 mL 容量瓶中,加水至1000 mL,备用。
水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V): 取805 mL 水、115 mL 乙腈、25 mL 1 mol/L 磷酸二丁胺缓冲液(DBAP)、55 mL 四氢呋喃,混匀,有机滤膜过滤,备用。
1.5 实验方法
1.5.1 样品制备 取有代表性的样品至少500 g,用四分法缩减至200 g, 粉碎通过1 mm 孔径筛,混匀,贮存磨口瓶中备用。
1.5.2 样品提取 平行做2 份实验。 称取试样约5 g(精确至0.01 g)于50 mL 离心管中,准确加入水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)20 mL,涡旋混合30 s,振荡10 min,超声10 min,于4000 r/min 离心5 min,取上清液过微孔滤膜,供高效液相色谱仪分析。
1.5.3 色谱条件 色谱柱:C18 色谱柱,250 mm×4.6 mm;柱温:室温;检测波长:290 nm;流动相:水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V);流速:1.0 mL/min;进样量:10 μL。
2 结果与分析
2.1 前处理优化
2.1.1 提取溶液的优化 替米考星属于无色弱碱性化合物,分子量较高,易溶于酸性水溶液和极性溶剂,如甲醇、乙腈、乙酸乙酯等。农业部783 号公告-4-2006 中饲料中替米考星的测定采用的是乙腈-磷酸二丁胺缓冲液-磷酸缓冲液(200:25:25,V:V:V),闫小峰等(2010)采用乙腈和磷酸二氢钾缓冲液先后提取。 本研究分别选取乙腈-磷酸二丁胺缓冲液-磷酸缓冲液(200:25:25,V:V:V)、水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)、甲醇、乙腈为提取液,取空白饲料,加标为200 mg/kg,分别用以上4 种不同提取液提取,每种提取方式设置3 个重复,结果显示当提取液为乙腈-磷酸二丁胺缓冲液-磷酸缓冲液(200:25:25,V:V:V)和水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)时,平均回收率较高, 接近100%(表1), 由于水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)与本研究中流动相一致,为简化实验过程,减少试剂配制,本研究最终选择水-乙腈-磷酸二丁胺溶液-四氢呋喃 (805:115:25:55,V:V:V:V)为提取液。

表1 不同提取溶剂对替米考星提取率影响
2.1.2 提取次数的优化 本研究考察了提取次数对提取效果的影响。 称取空白饲料样品5 g,加标量为200 mg/kg,选水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)为提取液,考察提取1 次(20 mL)、2 次(10、10 mL)、3 次(7、7、6 mL)对提取效果的影响,每组3 个重复,对比其平均回收率。 结果显示,提取1 次(20 mL)时即可达到提取效果,增加提取次数并未提高回收率(表2),且会延长整体前处理时间,综合提取效果及时间成本考虑,最终选择提取1 次(20 mL)。
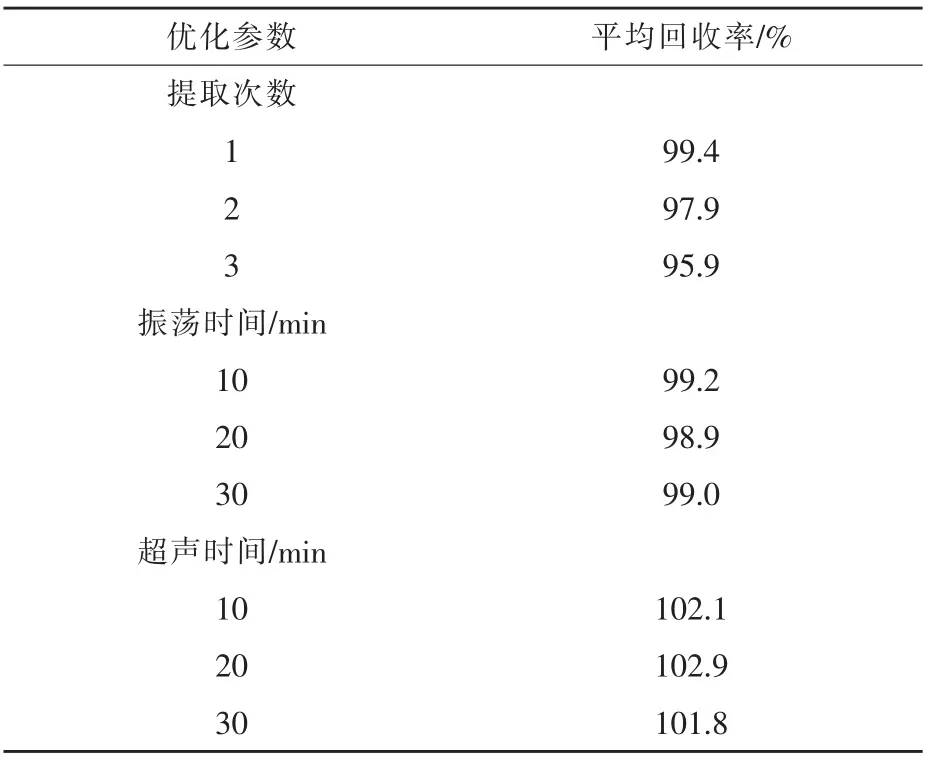
表2 提取次数、振荡时间及超声时间对替米考星提取率影响
2.1.3 振荡及超声时间的优化 振荡法为常用提取方式之一,一般选取振荡时间为20 ~30 min。 超声波提取是通过空化作用使分子运动加快,同时将超声波的能量传递给样品,使组分拖脱附和溶解加快(李俊锁,2002)。 本研究考察振荡时间及超声时间对提取效果的影响,称取空白饲料样品5 g,加标量为200 mg/kg,加入20 mL 水-乙腈-磷酸二丁胺溶液-四氢呋喃(805:115:25:55,V:V:V:V)提取,分别考察振荡10、20、30 min, 超声10、20、30 min对提取效果的影响,每组3 个重复。 结果显示振荡10 min,超声10 min 即可达到提取效果,延长振荡及超声时间并未提高回收率(见表2),因此本文选择振荡10 min,超声10 min 为最优条件。
2.2 仪器条件优化
2.2.1 检测波长的优化 农业部783 号公告-4-2006 及中华人民共和国兽药典(2020 年版)中替米考星的检测波长均为280 nm, 为验证280 nm是否为最佳检测波长,本研究测定了50 μg/mL 替米考星标准溶液在250 ~350 nm 的响应值,发现在290 nm 波长下, 响应最大 (图1), 因此选择290 nm 为最佳波长。

图1 替米考星标准溶液(50 μg/mL)在不同波长下的响应值
2.2.2 色谱柱及柱温的选择 实验选择了ZORBAX Extend-C18 (4.6 mm×150 mm,5 μm) 及ZORBAX Extend-C18(4.6 mm×250 mm,5 μm)两种不同长度的色谱柱,对替米考星进行分析,发现在使用长度为150 mm 色谱柱时, 替米考星出峰时间为5.124 min(反式)和5.744 min(顺式),使用长度为250 mm 色谱柱时, 替米考星出峰时间为5.309 min(反式)和6.065 min(顺式)(图2),即使用长度为150 mm 色谱柱并未明显提前替米考星出峰时间,用长度为250 mm 色谱柱时,替米考星顺式峰及反式峰分离效果较好, 因此本研究选择使用ZORBAX Extend-C18(4.6 mm×250 mm,5 μm)色谱柱。
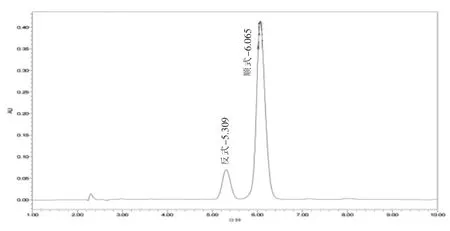
图2 替米考星标准溶液色谱图(250 mm)
化合物在色谱柱上的行为是吸附解析动态分配平衡的过程, 柱温的变化对化合物的保留时间及分离效果有一定的影响。因此选取20、25、30 ℃三种不同柱温分析50 μg/mL 替米考星标准溶液。发现替米考星在3 种温度下均能够很好的分离,温度为20 ℃时保留时间最长,30 ℃时保留时间最短,但时间无较大差异,因此对柱温不做要求,在室温条件下即可。
2.3 线性范围、 检出限及定量限 配制10、20、50、100、200、500 μg/mL 不同质量浓度的替米考星标准溶液,按照本实验色谱条件进行分析测定。用替米考星顺式及反式异构体峰面积之和(Y)和质量浓度(X)作标准曲线,结果显示回收方程具有良好的线性关系,为Y=32927X-59269,相关系数R2=0.9991。 以空白饲料为基质进行加标,加标范围为0.1 ~50 mg/kg,按3 倍信噪比(S/N=3)和10 倍信噪比(S/N=10)计算方法的检出限和定量限,结果显示替米考星的检出限为5 mg/kg,定量限为10 mg/kg。
2.4 回收率及精密度 以空白饲料的基质进行加标,分别添加不同浓度的替米考星标准溶液,使得加标水平分别为20、50、100、200、500 mg/kg,每个加标水平做6 个平行样品, 在本实验分析条件下测定, 结果显示该方法平均回收率为92.0% ~101.2%, 相对标准偏差为1.02% ~5.17%(表3),满足饲料中替米考星检测分析要求。
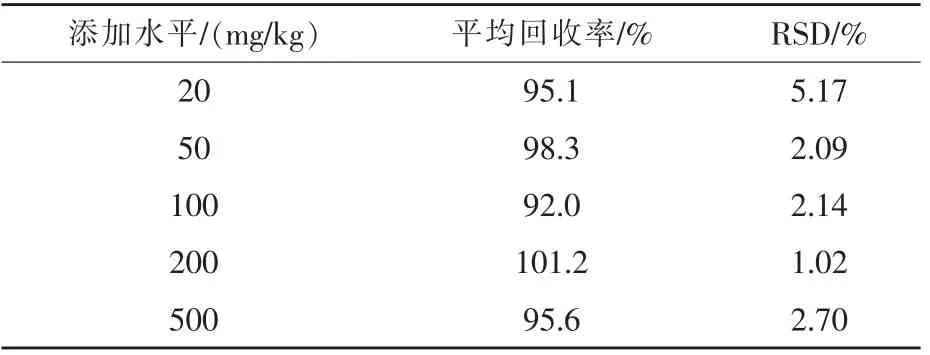
表3 替米考星的平均回收率及精密度(n=6)
2.5 稳定性 将加标浓度为200 mg/kg 的饲料样品按照本实验条件进行处理,将处理后的样品溶液分别在0、24、48、74 h 时上机测定, 对比替米考星的峰面积及RSD(表4)。 结果显示,该样品在室温条件下放置72 h 内,替米考星含量无明显变化。
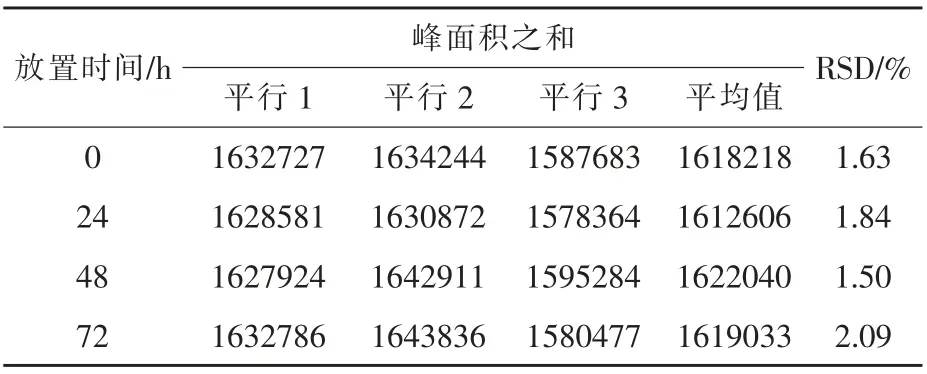
表4 稳定性测定结果(n=3)
3 结论
本研究建立了饲料中替米考星的高效液相色谱测定方法,相较于农业部783 号公告-4-2006,本实验将提取液与流动相进行了统一, 规定了样品称样量,减少了提取液的体积,优化了液相色谱洗脱程序及检测波长。通过以上各参数的优化,本实验条件可明显节约试剂成本、 人工成本及时间成本,且实验重复性好,准确率及稳定性高,适用于大批量饲料中替米考星含量的测定。
