蛹虫草废弃米基发酵工艺初探
2022-03-19李欣南田晓玲马新宇赵晓云韩镌竹
李欣南 , 叶 齐, 田晓玲, 马新宇, 赵晓云, 韩镌竹
(1.辽宁省检验检测认证中心辽宁省农产品及兽药饲料产品检验检测院,辽宁沈阳 110016;2.沈阳药科大学生命科学与生物制药学院,辽宁沈阳 110016;3.沈阳市第四十三中学,辽宁沈阳 110036)
随着蛹虫草培育技术的成熟与发展,其产量也随之不断增大,据调查,平均每个生产厂家蛹虫草的产量可达2000 kg/月,而栽培蛹虫草剩余的废弃米基多达6000 kg 以上 (肖千明,2017)。然而, 这些废弃米基都作为废弃的原料被扔掉,不仅造成环境的污染,也造成了能源的浪费。 蛹虫草废弃米基是在蛹虫草采摘后所剩的蛹虫草的基础培养基(文庭池等,2017;韦强等,2009),富含大量的氨基酸、多糖、虫草素等营养物质,可利用价值很高 (王建芳等,2005; 韦会平等,2004), 因此对其开发利用有可观的经济效益和社会效益(汪晶晶等,2016)。
当前,人民生活水平日益提高,人类对肉类、蛋类等食物需求不断提高, 促使相关产业迅速发展, 同时造成饲养畜类禽类的饲料不同程度上的短缺(刘艳新等,2017;乔枫等,2013)。 因此,将生产蛹虫草剩余的废弃米基作为一种基础培养基用于发酵生产,开发新型饲料,不仅可以减少对环境的污染也可避免资源的浪费(阮萍等,2017)。 因此,本试验以蛹虫草废弃米基为发酵培养基,利用酵母菌作为发酵菌株,以蛋白质、虫草素等营养指标为参考,确定发酵工艺,为开发出以废弃米基为原料的新型饲料产品提供理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源 酿酒酵母、 嗜酸乳杆菌均由辽宁省检验检测认证中心提供。
1.1.2 培养基 蛹虫草废弃米基由沈阳虫林密宝北虫草食品科技有限公司提供; 酵母浸出粉胨葡萄糖培养基(YPD)、乳酸细菌培养基(MRS)购自青岛高科园海博生物科技有限公司。
1.1.3 试剂及仪器设备 尿素、氯化钠等试剂购自国药集团; 虫草素标准品购自上海安谱科技公司; 甲醇 (色谱纯) 购自默克股份有限公司;ESJ182-4 电子天平 (沈阳龙腾电子有限公司);FW 80 高速粉碎机 (天津市泰斯特仪器有限公司);三洋高压灭菌锅(MLS-3750-3780);电热鼓风干燥箱YLA-6000 (上海实验仪器有限公司);恒温培养箱(Memmert 260 INplus);近红外光谱仪(Foss NIRS DS 2500);高效液相色谱仪Agilent 1100(美国安捷伦科技有限公司)。
1.2 方法
1.2.1 发酵基础培养基的制备 10%半固体废弃米基(以下称为10%固体米基),废弃米基与水的混合比例为1:10(m/m),经121 ℃高压灭菌15 min,冷却备用, 其余比例半固体培养基均按照料水质量比配制,灭菌方法同上。
1.2.2 平板计数 采用平板涂布法, 将样品用0.85%的生理盐水按1:10 依次稀释至适宜浓度,选取3 个稀释浓度, 分别吸取菌悬液0.1 mL 于事先准备好的培养基上(酵母菌使用YPD,嗜酸乳杆菌使用MRS, 混合菌使用两种平板分别计数), 用一次性无菌涂布棒将菌悬液在培养基表面涂布均匀,放置培养箱内(酵母菌28 ℃,嗜酸乳杆菌30 ℃,混合菌29 ℃),培养72 h 计数(龚军辉等,2018)。
1.2.3 卫生指标的测定 霉菌总数按国标GB/T 13092 饲料中霉菌总数测定方法; 大肠菌群按国标GB/T 18869 饲料中大肠菌群的测定方法。
1.2.4 营养指标 按国标GB/T 18868 饲料中水分、粗蛋白质、粗纤维、粗脂肪、赖氨酸、蛋氨酸快速测定方法近红外光谱法; 沙门氏菌按照国标GB/T 13091 饲料中沙门氏菌的检测方法 (汤旭等,2013)。
1.2.5 虫草素的测定 采用高效液相色谱法进行测定,以甲醇:水=85:15 等度洗脱,流速为1 mL/min,柱温为35 ℃。 取虫草素标准品, 分别配制1、5、10、20、50、100 μg/mL 浓度的标准品溶液,测定标准品的峰面积,并以标准品的浓度为横坐标,峰面积为纵坐标绘制标准曲线。
空白米基及样品的含量测定:称取6 份发酵样品以及1 份空白米基,每份0.5 g,分别置于100 mL锥形瓶中, 加入80 mL 水,85 ℃水浴加热3 h,30 min混匀一次,取出冷却后转移到100 mL 容量瓶中,定容至刻度线,摇匀;取1 mL 样品溶液离心后过0.22 μm 微孔滤膜,用于高效液相分析;每次进样10 μL,在260 nm 波长紫外灯下检测,每份样品重复测定3 次(李娟等,2012)。
1.2.6 正交试验 通过正交试验对二次发酵的主要影响因素发酵时间、米基添加量、接种量以及适当添加尿素等(汪伦记等,2012;焦静等,2012;杨丽英等,2008)进行筛选,找出显著性高的影响因素。 试验对米基添加量、接种量、发酵时间进行3因素3 水平L9(34)正交试验设计,以粗蛋白质含量为检测指标进行试验研究。 因素水平见表1。

表1 正交试验因素与水平
根据正交试验设计法得到3 因素3 水平L9(34)正交试验设计表(表2)。 根据设计试验,每个试验号做3 组平行处理,共27 组试验。
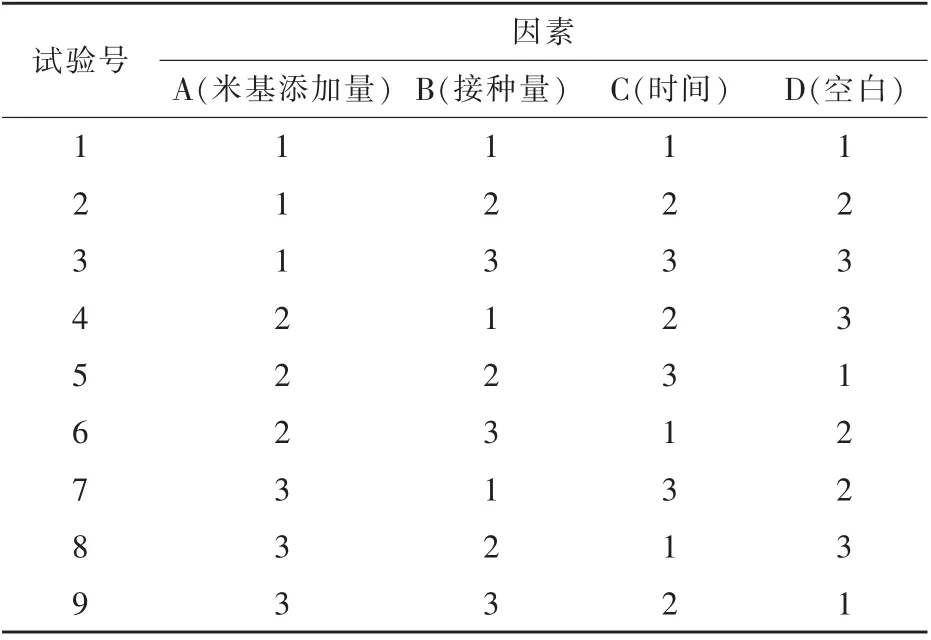
表2 L9(34)正交试验设计
2 结果与分析
2.1 发酵菌种的确定 使用10%半固体米基分别接种1%(m/m) 酵母菌、 嗜酸乳杆菌或混合菌(酵母菌:嗜酸乳杆菌=1:1),培养24 h 后进行菌落计数。 对照组则采用生理盐水稀释至适宜浓度后进行菌落计数。 通过比较试验组和对照组菌体生长状况, 筛选出适用于此种培养基的最佳发酵菌种(江成英等,2018)。一次发酵试验的菌落计数结果见表3,从表中可以看出,三种发酵菌种方案中, 只有酵母菌在米基培养基中较对照组的菌落总数有所提高, 且废弃米基发酵前pH 为4.9,符合酵母菌发酵适宜pH 范围, 因此选择酵母菌作为最终的发酵菌种。

表3 发酵菌种菌落总数计数结果
2.2 一次发酵主要影响因素的确定 主要考察了添加量分别为7.5%、10%、12.5%(m/m) 的半固体米基,接种量为1%(m/m)发酵培养24 h 对菌落总数的影响。结果如表4 所示。三个米基添加量发酵得到的菌种菌落计数均有提高,10%米基添加量的培养基干湿度适中, 营养成分足够且有一定流动性,菌落计数最高,适用于酵母菌发酵,因此米基选用10%添加浓度。

表4 一次发酵米基添加量对菌落总数的影响
确定好米基最适添加量后, 考察发酵时间对菌落总数的影响。 从第10 小时开始,每隔2 h 观察菌落生长状况,保证菌种正常生长繁殖。选用在菌丝生长出前1 h 作为一次发酵的最适时间,经过试验得出最佳一次发酵时间为20 h。
2.3 二次发酵主要影响因素的确定 正交试验结果如表5 所示, 并由表7 和表8 的极差分析和方差分析可知,当因素为B(接种量)时极差最大,FB 值大于F 0.05(2,2),且水平在k2时出现最大值。 因此各影响因素中对粗蛋白质含量影响最显著的是因素B(接种量),最佳接种量为6%;其次影响显著的因素是时间; 米基添加量对粗蛋白质含量影响最小,以12.5%米基添加量为最佳。
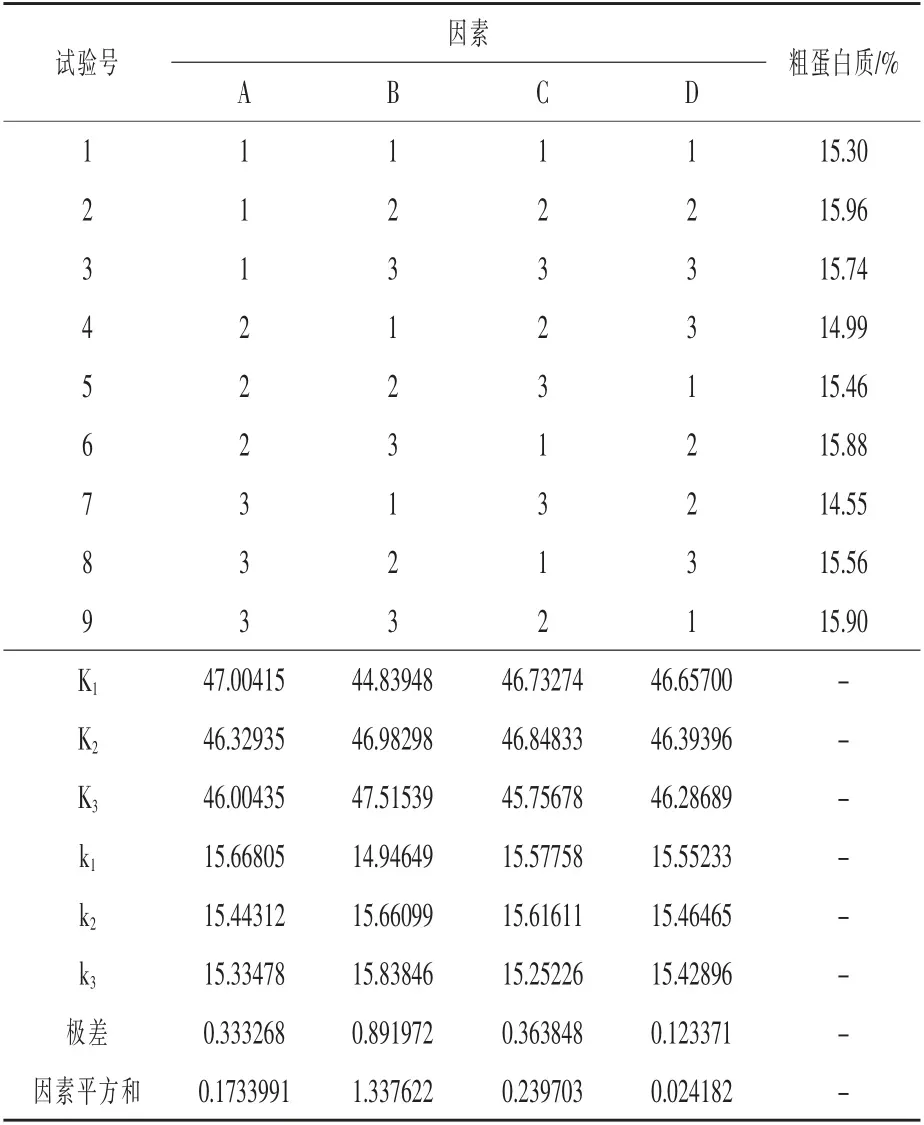
表5 L9(34)正交试验结果与极差分析

表6 L9(34)正交试验方差分析
2.4 二次发酵单因素考察
2.4.1 米基添加量及发酵时间的确定 利用废弃米基和水配制成米基占总体积7.5%、10%、12.5%的废弃米基培养基,经121 ℃高压灭菌15 min 作为二次发酵的培养基, 一次发酵得到的菌液作为二次发酵的母液, 以6%接种量接入到二次发酵培养基中, 放入28 ~30 ℃恒温箱中分别发酵培养24、48、72 h 后,于烘箱中60 ℃烘干,冷却后粉碎,测定各项指标。 以粗蛋白质含量作为指标,结果如图1 所示。从图中可以看出,在米基添加量为12.5%,发酵时间为48 h 时,粗蛋白质含量最高。因此二次发酵的米基添加量和时间初步确定为12.5%米基添加量,发酵48 h。
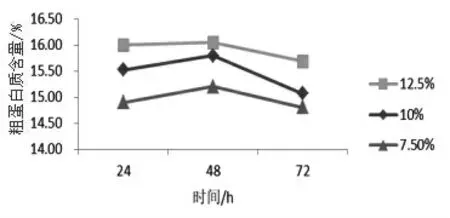
图1 二次发酵米基添加量和时间对发酵的影响
2.4.2 接种量对发酵结果的影响 通过正交试验结果可知接种量对于发酵的影响最显著。 在一次发酵前期试验的基础上, 进行二次发酵接种量的确定,选取接种量为2%、4%、6%、8%、12%这5 个梯度进行试验, 并通过测定粗蛋白质含量确定最佳的接种量。试验结果如图2 所示。从图中可以看出,接种量为6%时粗蛋白质含量达到最大,随后便随接种量增大逐渐降低。因此,确定二次发酵接种量6%为最佳。

图2 接种量对发酵结果的影响
2.4.3 添加尿素对发酵结果的影响 作为畜禽饲料, 粗蛋白质含量是一项重要的指标(李劲松等,2018),而外加氮源不仅能影响菌种的生长发育,还能够有效提高粗蛋白质含量,因此发酵过程中尿素的添加量也是一项重要因素。本试验在前期试验基础上, 分别在二次发酵培养基中添加0.1%、0.5%、1%、2%、4%尿素(m/m),发酵48 h 后,粗蛋白质含量如图3 所示。粗蛋白质含量随着尿素添加量的增加而增大,但过大的尿素浓度会影响菌种的正常发育,因此综合考虑,尿素添加量为2%。

图3 尿素添加量对发酵结果的影响
2.5 发酵产物营养与卫生指标检测 根据试验最终得出废弃米基发酵工艺的最佳发酵条件,发酵3 批次,每批次3 组平行对照,每组发酵量约500 g,经60 ℃烘干,得到粗制品进行营养成分测定,结果见表7。经过酵母菌发酵后,粗蛋白质含量增加25.61%,Ca 含量增加2.51%,P 含量增加1.61%,粗脂肪含量增加23.42%,食盐含量增加23.4%。这说明废弃米基中的营养成分有不同程度的增加, 发酵过程对于提升废弃米基的营养价值有一定的作用, 可为进一步研究米基二次发酵条件提供参考。 试验对9 批次粗制品中霉菌总数、大肠菌群和沙门氏菌进行了检测,结果均为阴性。
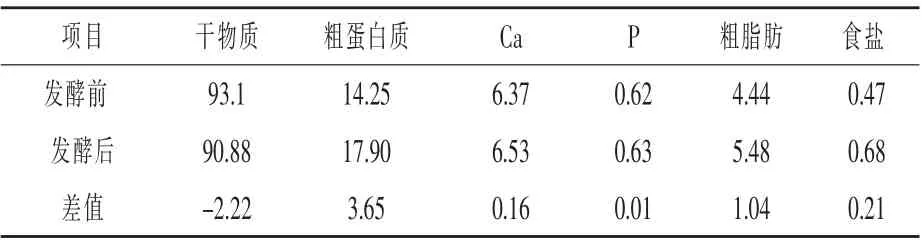
表7 废弃米基发酵前后营养成分含量%
2.6 发酵产物中虫草素的含量测定 依据标准品分析的测定结果, 测得虫草素浓度与峰面积的标准曲线方程为:y=36.819x-15.265(r2=0.9996),在1 ~20 μg/mL 内线性关系良好,虫草素标准品HPLC 图见图4-B。 发酵产物以及空白米基HPLC图见图4-C、图4-A。 6 份样品虫草素含量测定结果见表8,与发酵前米基中虫草素含量相比,经发酵后蛹虫草废弃米基中保留了虫草素, 并且发酵过程对虫草素没有影响, 这对废弃米基作为一种新型发酵饲料具有极大价值。
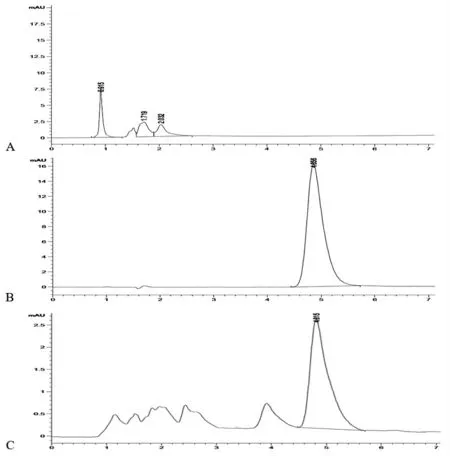
图4 发酵产物中虫草素含量测定

表8 发酵产物虫草素的含量测定结果(n=3)
3 讨论
本试验通过对废弃米基的二次发酵, 优化确定了一套废弃米基发酵的最适条件:以酿酒酵母为发酵菌种,一次发酵米基添加量为10%(m/m),接入1% (m/m)酵母菌,30 ℃发酵20 h;二次发酵米基添加量为12.5%(m/m),接入6%(m/m)一次发酵酵母混合物,2%尿素添加量,30 ℃发酵48 h。发酵过程中应注意卫生问题,并随时排查杂菌污染。
发酵过程中最关键的就是发酵菌种的选择,优良的菌种能保证发酵饲料产品的质量, 且最大量地提高饲料中的菌体蛋白。 发酵菌种应该具有以下特性:(1)有较强的环境适应性,能在以原料为培养基的环境中正常生长;(2)繁殖速度快,产蛋白效率高;(3)自身及代谢产物无毒无致病性。 其次,在生产中接种量也很关键,接种量过小,发酵菌种发育缓慢,接种量过大,易导致发酵菌种生长过快,营养物质过快消耗,影响菌种正常发育。 因此确定最佳的接种量是发酵试验成功的重要一步。
有报道称,将发酵后的米基饲料添加到日粮中,可一定程度地提高蛋鸡日粮营养物质含量,满足蛋鸡每日所需的营养物质 (李劲松等,2018;吴良柱等,2009)。 本试验通过对废弃米基进行发酵,发现废弃米基中的粗蛋白质、无机物Ca、P 等营养物质的含量均有所提高, 且保留了蛹虫草废弃米基中特有的虫草素, 发酵产物颜色棕黄色,具有酒香味,气味和色泽均较发酵前有所改善。 蛹虫草废弃米基作为目前一种产量大,利用率低的生物资源,如果能够对其深入研究,对于开发天然、绿色、抗病的新型饲料,减少抗生素的滥用(邵建忠等,2017)及环境污染等,具有重要意义。
