草鱼原癌基因c-fos的原核表达载体构建及蛋白表达纯化
2022-03-18邱倩
邱 倩
(陇东学院 岐伯医学院,甘肃 庆阳 745000)
原癌基因c-fos是一种可被第二信使所诱导的即刻早期基因(Imdeiately Ealry Genes,IEGs),高度保守地存在于人类、豚鼠和鸟类细胞核DNA中[1-3]。目前已经发现有十几种即刻早期基因,除c-fos外还有如c-jun、c-myc等,而c-fos和c-jun可被外源性刺激激活,在细胞代谢活动中发挥重要作用[4]。c-fos原癌基因及其表达产物c-Fos蛋白,一方面参与细胞的正常生长分化过程,同时在细胞内的信息传递和能量代谢等生命过程中也同样起着不可或缺的重要作用[5,6]。一般情况下原癌基因c-fos处于相对静止状态,表达水平较低,当细胞受到外界缺氧、机械、光线等异常刺激后最先被激活,转录形成2.2kb的成熟mRNA,进而编码翻译成55kDa的核内磷酸化蛋白质,即c-Fos蛋白,可以在细胞内大量和持续性地积聚发挥转染能力,或当机体处于正常的胚胎发育的某一时期可大量表达,使得原始细胞分化为具有特异结构和功能的细胞从而发挥作用[2,6],在程序性细胞死亡等病理性过程中发挥重要作用。
抗体是浆细胞分泌产生的对抗原有特异结合能力的免疫球蛋白(Ig),在机体的免疫系统中具有重要的作用。大多数抗原是由大分子蛋白质组成的,具有多种不同的表位,当一种异源抗原(大分子抗原、抗原偶联物)经多种途径进入动物机体发生免疫反应时,可刺激动物机体合成并分泌具有多种表位的抗体,而针对多种不同抗原决定簇的抗体组成的混合物就是多克隆抗体(Polyclonal antibody,PcAb),简称多抗。与单克隆抗体相比,多克隆抗体由于可识别多个抗原表位,引起沉淀反应,制备周期短,成本低、效果好[7]的原因,作为研究工具,已广泛应用于自然科学研究和医疗诊断领域,并发挥不可或缺的重要作用。目前,使用原核表达蛋白免疫小鼠或者兔子以获取多克隆抗体是一种最常用的抗体制备方式。c-Fos蛋白多克隆抗体可与细胞发生异常后产生的c-Fos蛋白结合,可作为对细胞异常反应所导致的c-fos异常表达的重要指示,在相关研究中发挥重要作用。
目前,市面上有关草鱼(Ctenopharyngodonidella)原癌基因蛋白的检测抗体种类较少,尚未见c-Fos蛋白的抗体,本研究通过选取c-Fos蛋白抗原系数较高的一段多肽的核酸片段进行克隆,构建原核表达载体,并利用原核表达系统即大肠杆菌表达,纯化得到了c-Fos蛋白,可用于进一步免疫新西兰大白兔,以得到c-Fos蛋白的多克隆抗体,这为后期草鱼c-Fos蛋白的亚细胞定位及抗凋亡等功能的研究奠定了基础。
1 材料与方法
1.1 主要试剂和材料
本研究所用的草鱼来源于甘肃省兰州市雁滩区花鸟鱼市场;pMD19-T simple vector试剂盒购自TaKaRa(宝生物中国,北京)公司;原核克隆、表达系统大肠杆菌(Escherichiacoli,简写E.coli)DH5α、Rosetta,质粒pET-28a由兰州大学生命科学学院动物学研究所张迎梅教授实验室提供。限制性内切酶BamHⅠ和XhoⅠ,T4连接酶购自NEB(New England Biolabs,北京)公司;RNA提取试剂盒RNAiso Plus、Taq DNA聚合酶、RNA反转录试剂盒、质粒小量抽提试剂盒、琼脂糖凝胶回收试剂盒均购自TaKaRa(宝生物,大连)公司;蛋白分离His-镍柱Ni-NTA His·Bind购自Merck(默克,中国)公司;c-fos基因扩增的特异性引物由金唯智生物科技(北京)有限公司合成;其它用到的试剂均购自国内试剂公司,为国产化学分析纯级别。
1.2 方法
1.2.1 引物设计
根据美国国立生物技术信息中心(National Center for Biotechnology Information Search database,NCBI)网站GenBank中公布的草鱼c-fos基因的mRNA序列(No.AF380155),通过生物综合性序列分析软件DNA star分析获得目标基因c-fos表达蛋白序列亲水性最佳的一个片段,即其抗原系数较高的区域,作为目标基因扩增片段,利用引物设计软件Primer Premier 5设计出可扩增该编码区的一对特异性引物,扩增目的基因可得到长度为883bp的c-fos基因片段,以备下一步的原核克隆[8,9]。
1.2.2 总RNA提取
取草鱼新鲜的肝脏组织,用锡纸和分析天平准确称取2g置于陶瓷研钵中,加入适量液氮快速反复研磨,直至肝脏组织完全被研磨成细粉状,选用TaKaRa公司的RNA提取试剂盒RNAiso Plus在超净工作台中无菌环境下提取草鱼总RNA,具体操作步骤参考RNAiso Plus试剂盒说明书进行。提取完成后利用浓度为1.2%琼脂糖凝胶电泳检测总RNA完整性,并利用Nanodrop 2000型超微量紫外分光光度计测定总RNA浓度和纯度,以确保可用于下一步的扩增。
1.2.3 RT-PCR及c-fos基因片段的克隆
以草鱼总RNA为模板,利用TaKaRa公司的PrimeScript® RT reagent Kit试剂盒将草鱼总RNA反转录成总DNA,并将此总DNA作为模板进行c-fos基因的扩增。具体扩增反应条件是:94℃预变性5min;94℃变性30s;55℃退火30s;72℃延伸1min;共25个循环;72℃延伸10min;4℃,forever[8,10]。扩增所得的核酸产物用浓度为1.2%的琼脂糖凝胶电泳分离检测,在紫外线透照下切取目标条带,并按照凝胶回收试剂盒说明书回收扩增所得目的片段。利用T4连接酶将回收片段连接到pMD19-T simple载体上,并将重组载体转化感受态E.coli DH5α,利用蓝白斑阳性克隆筛选原理挑取阳性克隆的白色菌斑进行菌落PCR检测目标基因的克隆情况[11],检测到目标条带后,取适当量菌液按照TaKaRa公司的质粒小量抽提试剂盒说明提取质粒,用BamHⅠ和XhoⅠ两个限制性内切酶双酶切鉴定[8,9]。初步酶切鉴定正确后,将适量含有重组克隆载体的DH5α菌液送往上海美吉生物医药科技有限公司进行载体序列的测定。
1.2.4 重组表达载体的构建
将核酸序列测定正确的重组克隆载体命名为pMD19-T/c-fos,用限制性内切酶BamHⅠ和XhoⅠ对pMD19-T/c-fos重组克隆载体和原核表达载体pET-28a进行双酶切以备重组表达载体的构建,琼脂糖凝胶电泳分离并回收酶切所得的c-fos核酸片段和pET-28a大片段。用T4连接酶将两部分核酸片段在16℃水浴锅中连接过夜,E.coliRosetta,并经菌落PCR鉴定目标片段与原核表达载体是否连接及感受态菌的转化是否成功,最后通过筛选将构建成功的表达载体命名为pET-28a/c-fos。
1.2.5 c-Fos融合蛋白的诱导与表达
取转化成功有表达载体pET-28a/c-fos的E.coliRosetta菌液接种培养基,培养到适当浓度后,在不同温度,不同诱导时间和不同浓度诱导剂异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactoside,IPTG)作用下诱导c-Fos融合蛋白的表达。利用摸索所得的最佳温度、时间和诱导剂浓度条件小量培养Rosetta菌,诱导c-Fos融合蛋白的表达。最后取诱导后的菌液,提取其总蛋白,并用聚丙烯酰胺凝胶电泳(SDS-PAGE)检测目标蛋白的表达情况。
1.2.6 c-Fos融合蛋白的大量表达和纯化定量[8,9]
以小量诱导的最佳温度将菌株扩大至1~2L培养,当培养至菌液的OD600≈0.8时加入IPTG至终浓度为0.5mM,并按最优诱导时间培养以诱导目的蛋白的表达。培养结束后,在4℃条件下8000rpm离心菌液10min,弃掉上清培养基收集沉淀,按49∶1(培养物:结合缓冲液)的浓度加入结合缓冲液重新将沉淀混悬;接着依次加入溶菌酶至终浓度为1mg/ml,冰浴反应30min,4℃摇床震荡反应10min;加入TritonX-100至终浓度为1%,冰浴条件下4℃摇床震荡反应10min;冰浴条件下利用超声细胞破碎仪超声(超声3s,停7s)破碎菌体,4℃下1000rpm离心20min,将得到的上清和沉淀分别收集后,上清液用0.45μm滤膜过滤,沉淀用含有8M尿素的结合缓冲液溶解后过滤,将含有目标蛋白的上清或者沉淀溶解液用默克公司的镍柱纯化树脂Ni-NTA His·Bind进行目标蛋白纯化。利用SDS-PAGE凝胶电泳继续检测纯化后所得的组分,并用BCA法测定纯化后的蛋白浓度,并将所得纯化后的蛋白浓度稀释为1mg/ml后分装保存于-80℃冰箱,以备后续研究。
2 结果与分析
2.1 特异性引物设计及扩增片段的确定
利用生物序列分析软件DNAstar分析c-Fos蛋白的亲水性和抗原系数,选取亲水性和抗原系数均较高的最佳片段(图1)作为目标基因片段表达c-Fos融合蛋白,利用特异性引物设计软件Primer Premier 5设计扩增该基因片段的特异性引物(图2),上游引物序列:5’-GGCGGATCCTTTACCAGCCTTAG’;下游引物序列:5’-ATTCTCGAGTTCGGTGTTAGCGG-3’,下划线部分是在上下游引物中分别引入的BamHI和XhoI两个限制性内切酶的酶切位点,保护碱基序列加粗显示。
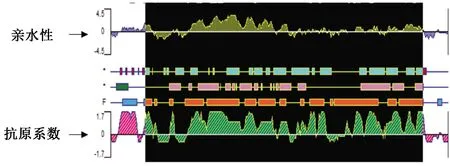
图1 c-Fos蛋白亲水性和抗原系数分析
2.2 RNA提取与RT-PCR
利用TaKaRa公司的RNAiso Plus试剂盒提取草鱼肝脏总RNA,并用1.2%琼脂糖凝胶电泳检测,提取结果理想,未发生核酸降解和污染。以提取所得总RNA为模板,RT-PCR扩增c-fos基因片段,结果显示(见图2)在900bp(c-fos基因片段理论长度为883bp:867bp+12bp酶切位点+4bp保护碱基)处可见一条特异性的DNA条带十分明亮,即为所要扩增的c-fos基因片段。
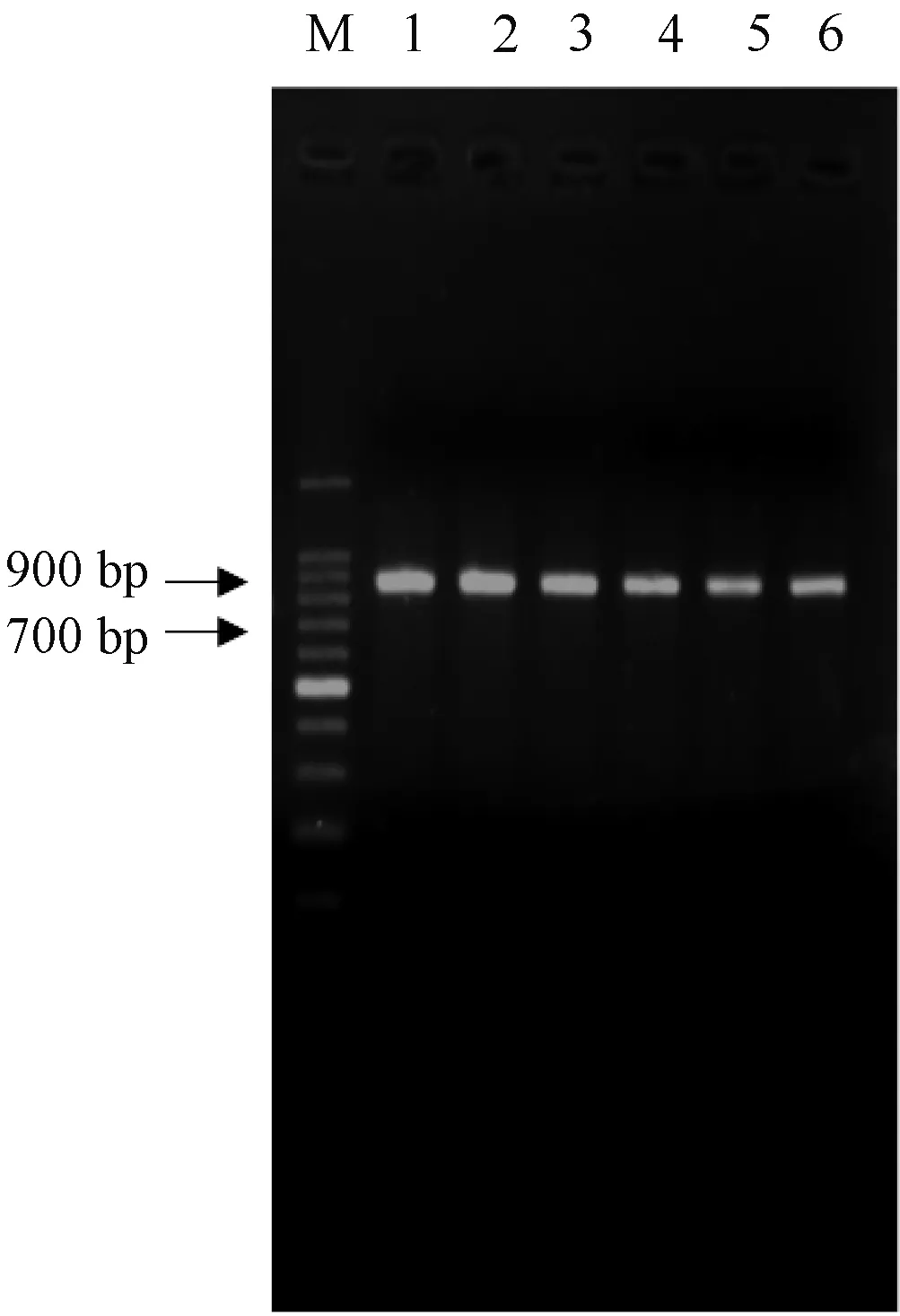
图2 c-fos基因片段扩增结果
2.3 目的片段的克隆与鉴定
重组原核克隆载体pMD19-T/IAP转化感受态E.coliDH5α后,利用菌落PCR检测转化效果,少量抽提质粒后使用限制性内切酶BamHⅠ和XhoⅠ双酶切鉴定结果显示,特异性目的条带在900bp处(图3),送测序公司,测序结果与GenBank上公布的c-fos基因对应区域的序列一致,即重组和转化成功,可进行下一步的原核表达载体构建。
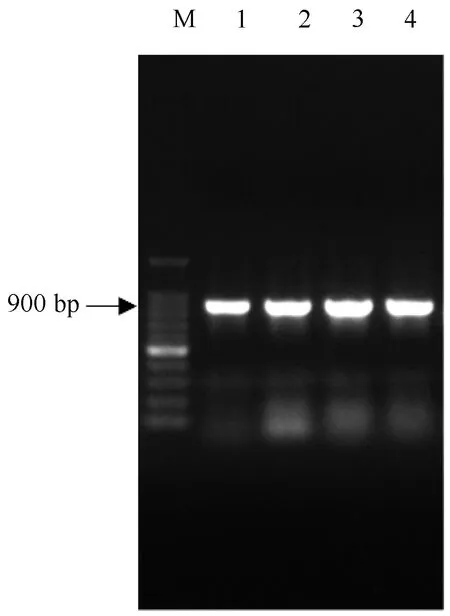
图3 重组克隆载体pMD19-T/c-fos菌落PCR检测结果
2.4 原核表达载体的构建和鉴定
利用限制性内切酶BamHⅠ和XhoⅠ双酶切重组原核克隆载体pMD19-T/c-fos和原核表达载体pET-28a(见图4),将目标片段连接到pET-28a后构建成原核表达载体pET-28a/c-fos,转化E.coliRosetta,同样经菌落PCR检测,发现有一条明亮的特异性的条带在900bp处(见图5)即为目标条带,说明原核表达载体pET-28a/c-fos构建成功。
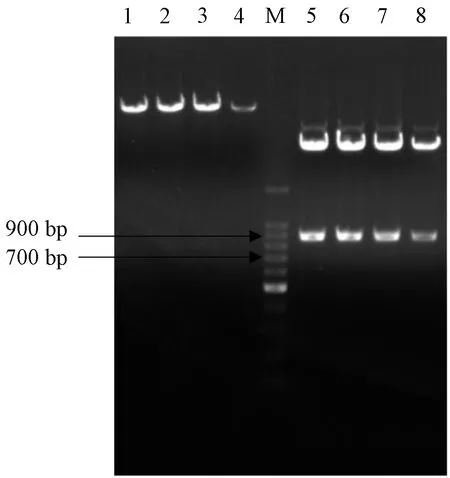
图4 pET-28a载体和重组克隆载体pMD19-T/c-fos双酶切结果
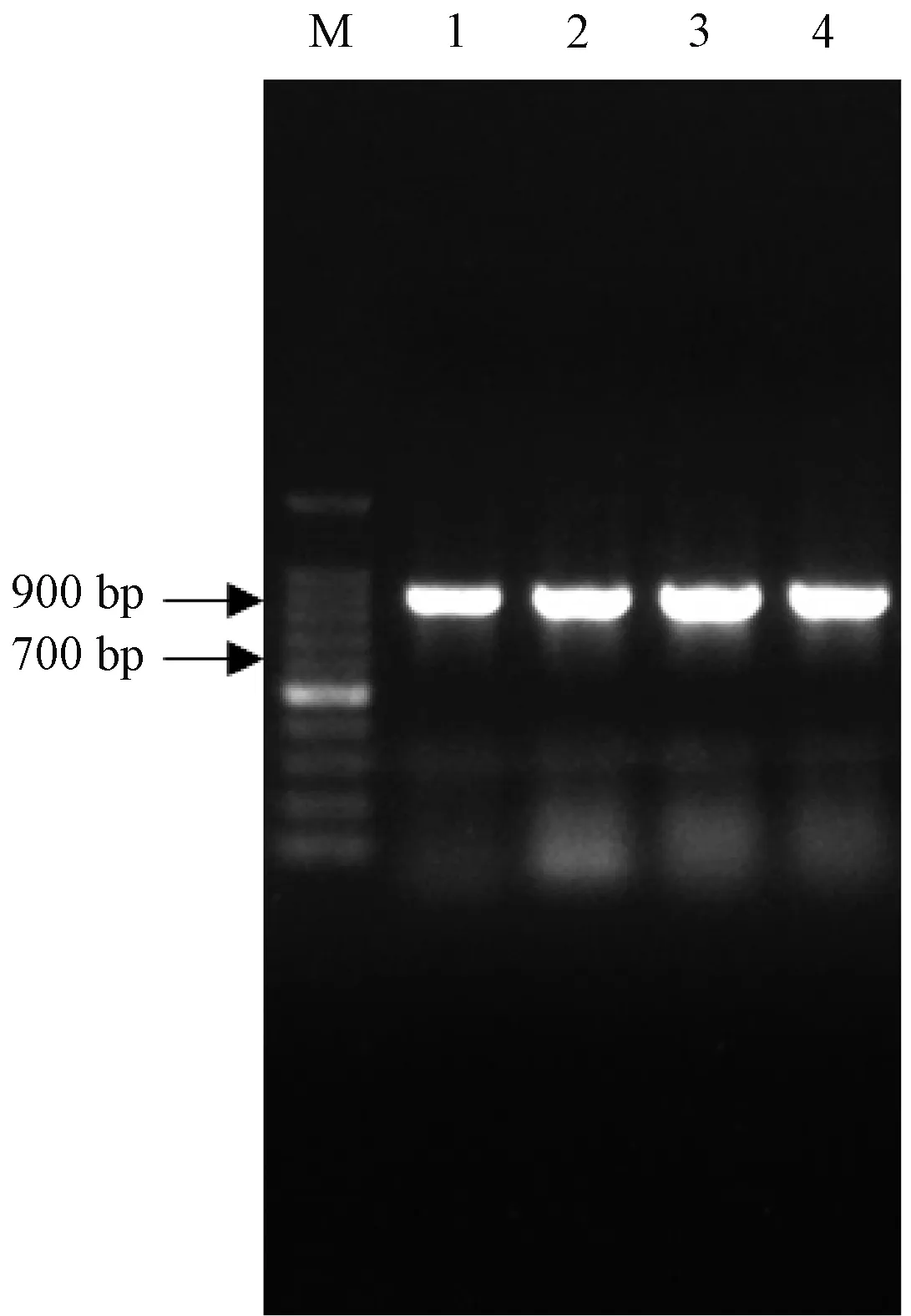
图5 重组原核表达载体pET-28a/c-fos菌落PCR结果
2.5 c-Fos融合蛋白的诱导表达
经菌落PCR检测筛选得到含有表达载体的菌株,继续培养,并加入诱导剂IPTG至终浓度为0.5mM/L,在30℃条件下分别诱导表达2h、4h、6h后,利用SDS-PAGE凝胶电泳检测目标蛋白表达情况。结果显示(见图6),所有诱导条件均可成功诱导表达c-Fos融合蛋白,目标蛋白分子量在40kDa左右,与理论推算分子量(36.56kDa)相符,且30℃、6h为最佳诱导表达条件。
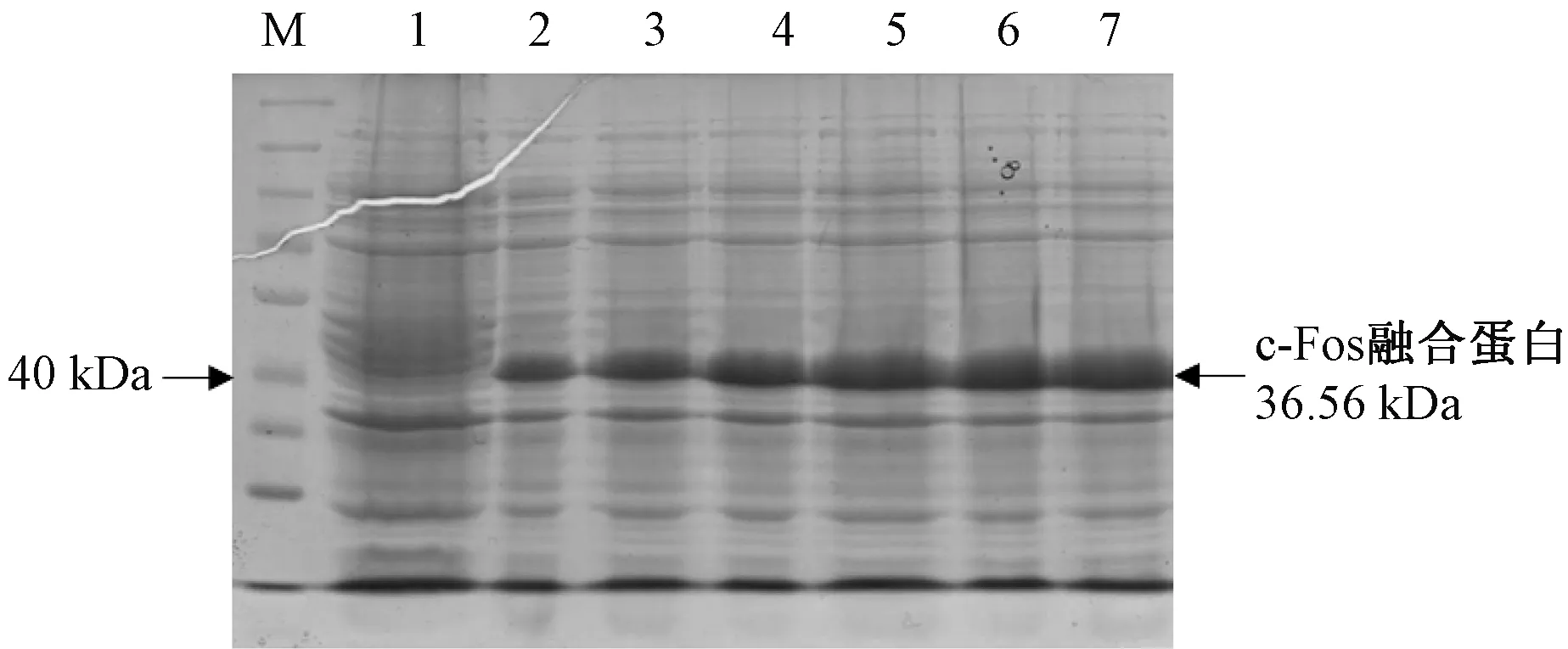
图6 0.5mM IPTG诱导不同时间的目标蛋白表达情况
2.6 c-Fos融合蛋白的纯化
取适量含有表达载体的菌株在500ml培养液中扩大培养,在30℃诱导表达6h(小量表达测试所得最佳条件)后,高速冷冻离心收集菌体,加入结合缓冲液和溶菌酶后进行超声破碎细胞,其后再次离心得到沉淀和上清液,SDS-PAGE凝胶电泳分别检测上清和沉淀中目标蛋白的含量,发现c-Fos融合蛋白基本都包含在沉淀中(见图7),即目标蛋白属不可溶性蛋白。取沉淀继续超声并过滤后利用镍柱纯化树脂Ni-NTA His·Bind纯化目标蛋白,结果可见一单一的目标蛋白条带,且在150mM咪唑洗脱液中的蛋白含量最高,浓度为303μg/ml(见图8)。
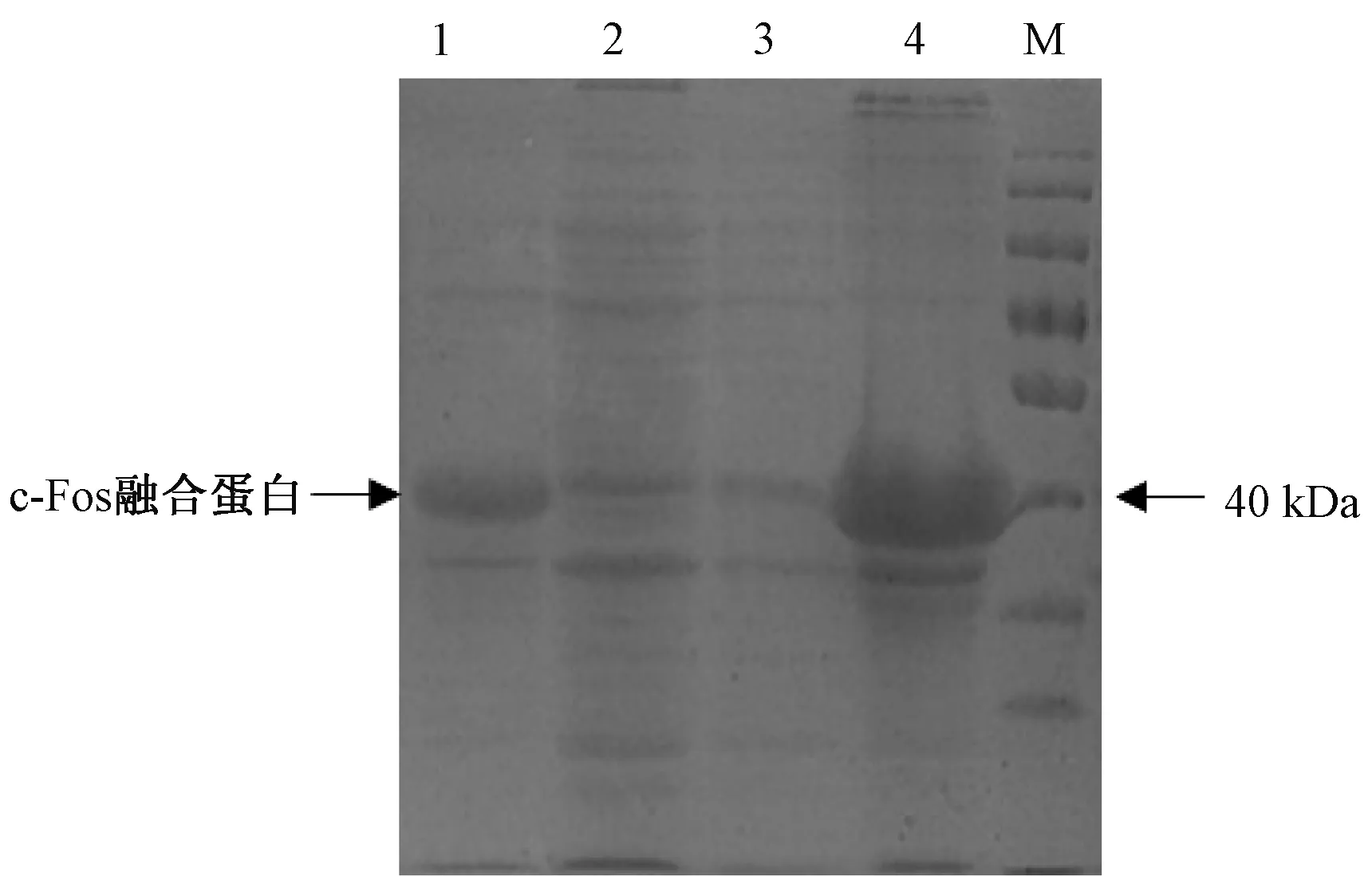
图7 c-Fos融合蛋白大量表达后沉淀和上清液分析
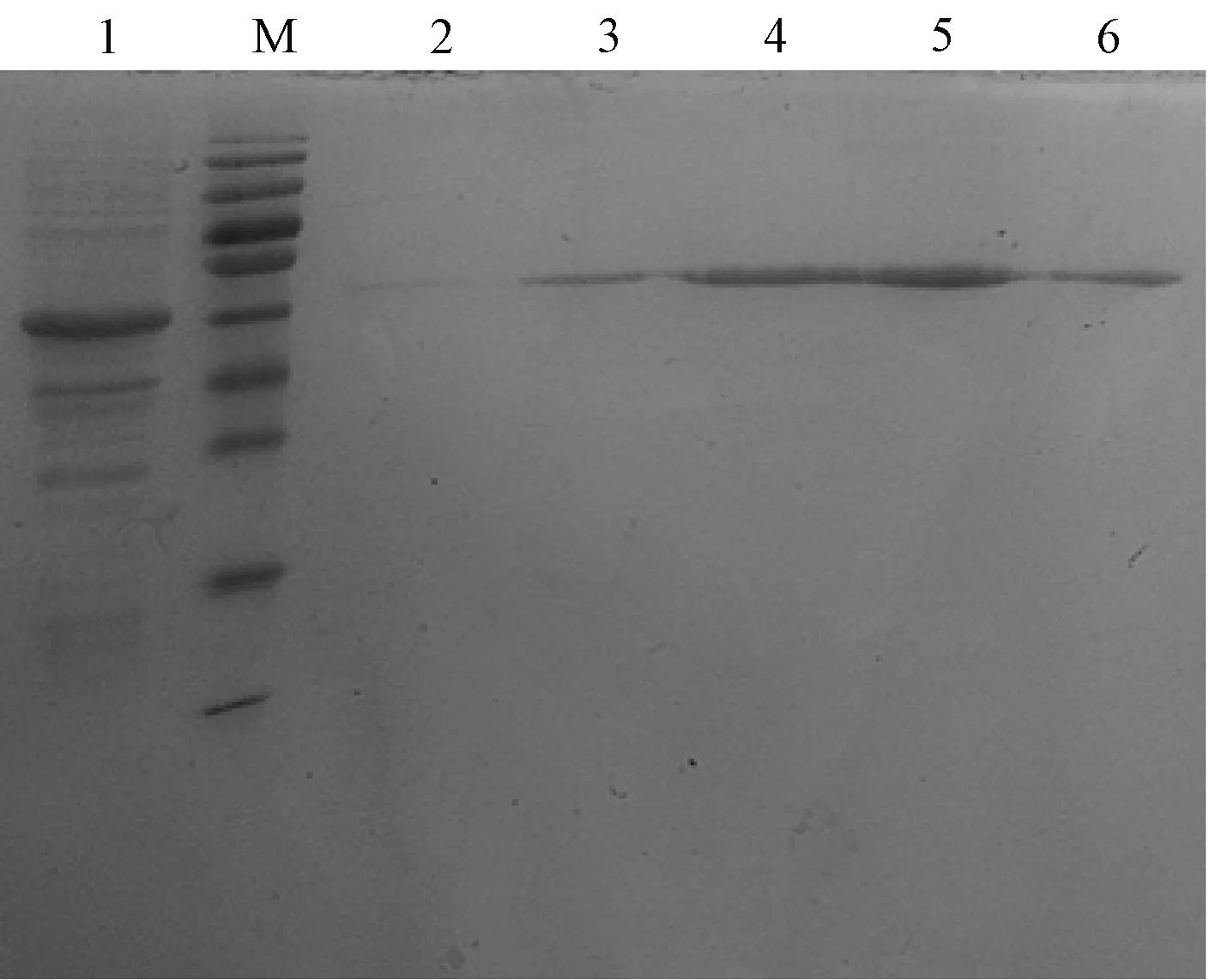
图8 c-Fos融合蛋白大量表达后纯化分析
3 讨论
作为即刻早期反应家族成员,c-fos基因在无外界刺激的状况下,正常参与细胞生长、分化、信息传递、学习和记忆等多种生理过程,而当受到内外环境缺血、缺氧、外伤、癫痫和外周神经刺激时,可以快速反应,高水平表达[12],而在刺激解除后又恢复正常,被认为是最适宜进行中枢神经系统研究的基因[13,14]。
本研究选择鲤科、草鱼属,草鱼肝脏作为研究材料,提取cDNA序列,并反转录其mRNA,对其原癌基因c-fos高亲水性和高抗原性的基因片段进行原核克隆,并构建了原核表达载体,成功地诱导表达了His-c-Fos融合蛋白。高亲水性的原核表达蛋白易于纯化,而高的抗原系数可使目标蛋白在动物免疫时具有较高的免疫原性,易于产生抗体。为此我们利用生物信息学软件分析了c-fos基因表达蛋白的亲水性和抗原系数,并选择了亲水性和抗原系数均较好的区段设计引物进行目标片段的基因克隆和原核表达体系构建,但实验发现,我们得到的蛋白亲水性仍不高,大量形成包涵体沉淀,为不可水溶性表达蛋白,但可溶于咪唑洗脱液,经超声破碎洗脱液溶解后也得到了一定浓度的蛋白。另外,本研究中我们选择了E.coliRosetta菌株进行原核蛋白表达,可有效避免稀有密码子导致的翻译问题,在诱导融合蛋白表达时,我们发现30℃培养效果较好,蛋白可大量表达,且该蛋白表达量在诱导6h时即可达到理想状态。目标蛋白所带His标签较小,不影响该蛋白的功能和免疫原性,经分离纯化最终成功获得了c-fos原核表达蛋白。
本研究成功构建了草鱼c-fos原核表达载体,并在原核表达系统中诱导获得融合蛋白表达,分离纯化后的草鱼c-Fos融合蛋白经进一步浓缩后可用于实验动物免疫以得到多克隆抗体,为草鱼凋亡相关研究中的c-Fos蛋白的检测,也为我们后期对该蛋白的组织和亚细胞定位及生物学功能的研究奠定了基础。
