m6A去甲基化酶ALKBH5在肝细胞癌组织中的表达及其临床意义
2022-03-18郑川军金松吴红梅岑雪青陆明深谭盛葵朱小年
郑川军 金松 吴红梅 岑雪青 陆明深 谭盛葵 朱小年
原发性肝癌是全球第六大常见的癌症和第三大癌症死因,其中肝细胞癌(hepatocellular carcinoma,HCC)占75%~85%[1]。HCC发病隐匿,诊断时往往分期较晚,加之易转移和复发,因此预后较差。目前肝切除术、肝移植术、放疗、化疗、靶向治疗等多种临床治疗手段联合使用大幅提高了其临床疗效,但晚期患者的治疗效果欠佳,远期生存率并不理想。因此仍需继续深入研究HCC发生发展的分子机制,寻找特异性的诊断、治疗和预后生物标志物,从而更有效地指导临床治疗决策制定,改善预后及降低死亡率。
m6A-甲基腺嘌呤(m6A-methyladenosine,m6A)甲基化是1974年首次发现的真核生物mRNA中最普遍的一种RNA修饰[2]。m6A修饰广泛参与了RNA剪接、核输出、翻译及降解等一系列生物学过程,通过影响mRNA的稳定性和翻译效率影响多种病理生理进程[3]。烷基化修复蛋白 B 同源物 5(alkylation repair protein B homolog 5,ALKHB5)属于ALKB双加氧酶家族,是第二种被发现的哺乳动物m6A去甲基化酶,同时也是另一种去甲基化酶脂肪量和肥胖相关蛋白(fat mass and obesity associated protein,FTO)的同源物[4-5]。ALKBH5主要通过m6A去甲基化参与mRNA的加工及降解来调节其输出和稳定性,在生殖发育[4]、成骨分化[6]、DNA损伤修复[7]等多种生物学过程中起着重要作用。m6A修饰是近年来肿瘤领域的研究热点之一,而ALKBH5作为m6A修饰关键酶在肿瘤领域已进行了广泛研究。已有文献报道ALKBH5在肺癌[8]、胶质瘤[9]、乳腺癌[10]等恶性肿瘤中发挥促癌作用,而在胰腺癌[11-12]、膀胱癌[13]、非小细胞肺癌[14]等恶性肿瘤中发挥抑癌作用。然而,ALKBH5在HCC发生发展中的作用及其机制目前尚不清楚。本研究采用免疫组化法检测HCC组织中ALKBH5蛋白的表达情况,并结合临床病理特征和随访资料进行分析,旨在探讨其在HCC中的预后价值。
1 资料和方法
1.1 一般资料
采用回顾性队列研究方法,收集2009年1月至2013年8月桂林医学院附属医院存档的80例接受肝癌切除术的HCC患者癌组织及其癌旁组织(距病灶>3 cm)石蜡包埋标本,由上海威奥生物科技有限公司制成组织微阵列芯片。所有患者均经临床和组织病理确诊为HCC,术前未进行放化疗,临床病理资料完整。采用门诊复查或电话方式随访患者术后复发情况,每半年随访1次,随访截至2015年4月。总生存期(overall survival,OS)定义为手术当日至患者死亡或末次随访的时间,无复发生存期(recurrence-free survival,RFS)定义为从手术当日至患者复发、死亡或末次随访的时间。本研究经桂林医学院伦理委员会批准(批件号:GLMC2014003),组织标本和临床病理资料的获取均征得患者及其家属知情同意。
1.2 免疫组化法检测ALKBH5蛋白的表达水平
组织微阵列芯片(每芯直径1.5 mm)经福尔马林固定、石蜡包埋后,常规烘片、脱蜡、水化,以柠檬酸盐修复缓冲液高压修复抗原,3%过氧化氢溶液淬灭内源性过氧化物酶活性,PBS缓冲液洗涤后在芯片上滴加山羊血清,室温孵育30 min,以封闭非特异性结合位点;滴加稀释的一抗ALKBH5(工作浓度1∶2 000,瑞士ATLAS ANTIBODIES公司),4℃孵育过夜;次日,滴加二抗(酶标抗小鼠/兔IgG聚合物)室温孵育30 min,DAB显色,苏木素复染,常规分化、返蓝、脱水干燥、封片固定。阴性对照采用PBS替代一抗。每个组织点在400倍镜下随机选取5个不同视野,记录平均细胞染色强度(染色强度以多数细胞呈色为标准),计数细胞总数及阳性细胞数后计算阳性细胞数占细胞总数的百分比。免疫组化染色评分由本院两名病理科医师进行双盲评定。半定量分析根据细胞染色强度和阳性细胞百分比进行综合评分。评分标准:⑴染色强度,未着色0分,浅黄色1分,棕黄色2分,黄褐色3分;⑵阳性细胞百分比,阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。取两项评分乘积作为最终染色得分,0~4分判定为低表达,>4分为高表达。
1.3 统计学方法
采用SPSS 19.0(IBM SPSS,美国纽约州阿蒙克)软件处理数据。采用McNemar检验比较HCC及癌旁组织中ALKBH5的表达,免疫组化评分分析选择配对样本t检验。χ2检验和多因素Logistic回归分析ALKBH5表达水平与患者临床病理特征的关系。Kaplan-Meier法绘制生存曲线,Log-rank检验比较两组生存曲线的差异。在 Kaplan-Meier Plotter网站(http://www.kmplot.com/analysis/index.php?p=service)中选择可公开获取的数据集(有总生存资料的HCC患者364例,有无复发生存资料的HCC患者316例)进行在线生存分析。采用Cox回归分析探讨ALKBH5与HCC患者预后的关系。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 ALKBH5在HCC组织及其癌旁组织中的表达
免疫组化染色结果显示,ALKBH5蛋白主要定位于细胞质和细胞膜,见图1。HCC组织中ALKBH5高表达的患者比例低于癌旁组织,差异有统计学意义(χ2=11.429,P=0.001),见表1。HCC组织中ALKBH5染色得分低于癌旁组织(4.125±2.587vs5.475±3.284,t=3.456,P<0.001),见图2。
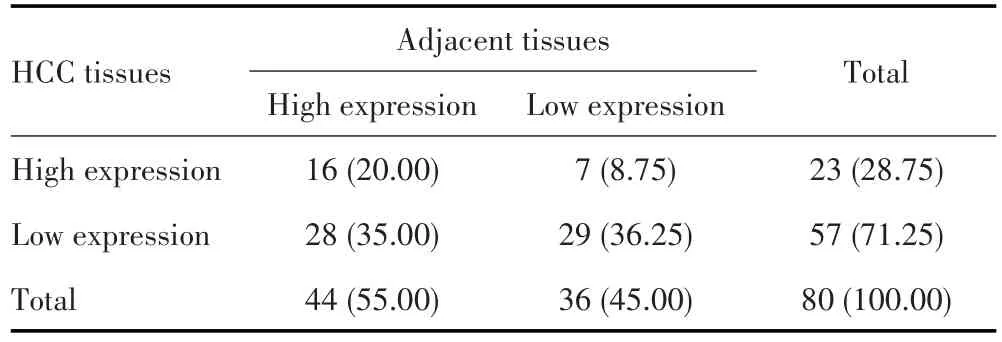
表1 ALKBH5在HCC组织及癌旁组织中的表达[n(%)]Tab.1 Expression of ALKBH5 in HCC tissues and adjacent tissues[n(%)]
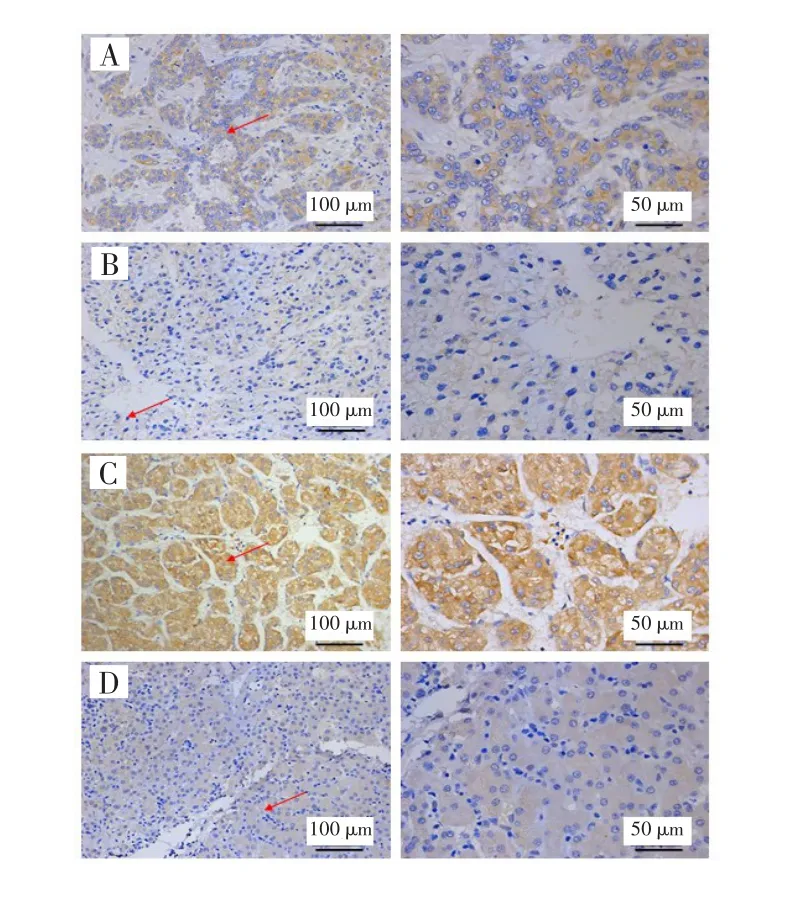
图1 ALKBH5在HCC组织及其癌旁组织中的染色情况(×400)Fig.1 Staining of ALKBH5 in HCC tissues and adjacent tissues(×400)
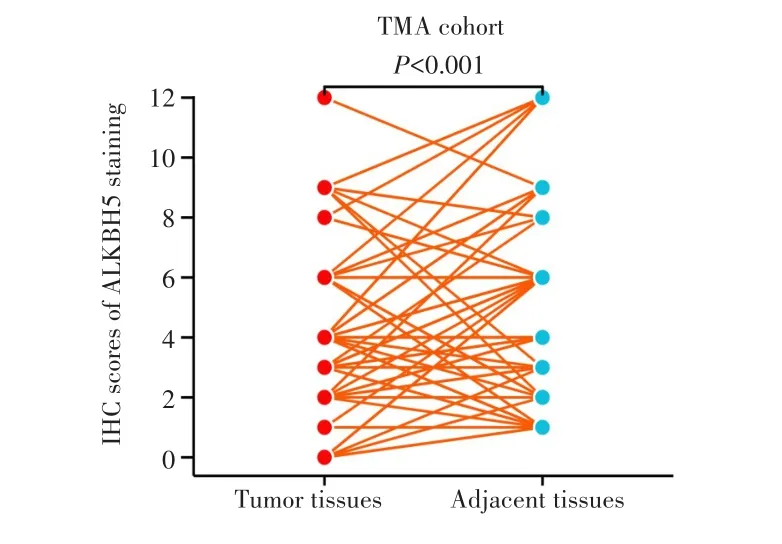
图2 ALKBH5在HCC组织及其癌旁组织中的免疫组化评分(n=80)Fig.2 Immunohistochemistry scores of ALKBH5 in HCC tissues and adjacent tissues(n=80)
2.2 ALKBH5表达与HCC患者临床病理特征的关系
单因素分析显示,ALKBH5表达与肿瘤大小及复发相关(均P<0.05),见表2。将单因素分析中P<0.1的变量纳入多因素Logistic回归模型中,结果显示ALKBH5蛋白表达与肿瘤大小(P=0.028)和血清甲胎蛋白(α-fetoprotein,AFP)水平(P=0.019)有关,见表3。
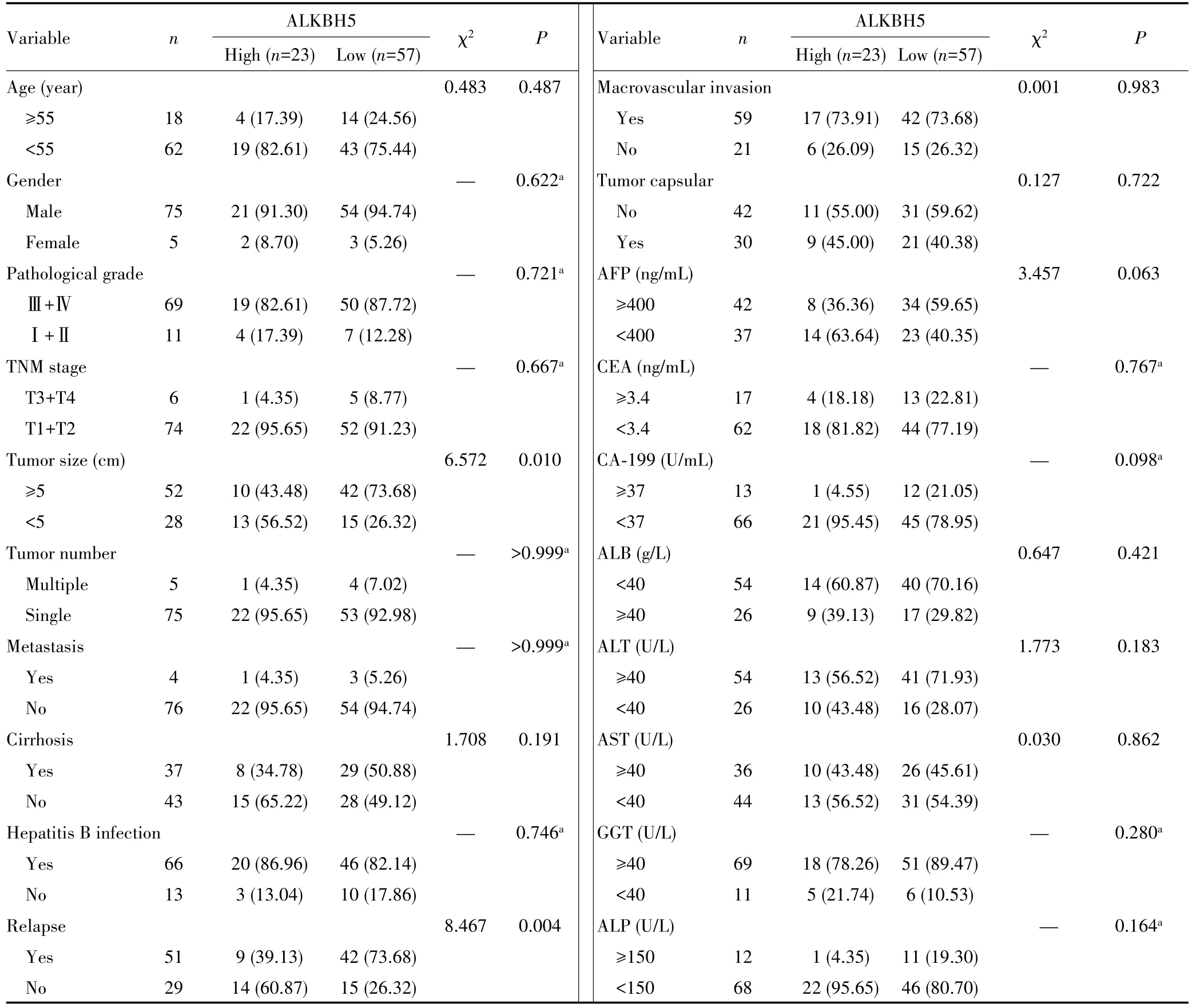
表2 ALKBH5表达与HCC患者临床病理特征的关系[n(%)]Tab.2 The correlation between ALKBH5 expression and HCC clinicopathological features[n(%)]
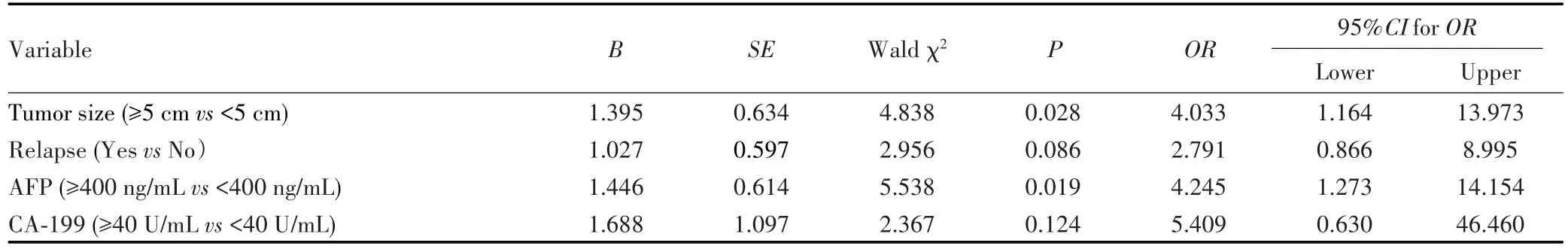
表3 HCC中影响ALKBH5表达的多因素Logistic回归分析Tab.3 Multivariable Logistic regression analysis of ALKBH5 expression in HCC
2.3 ALKBH5表达与HCC患者OS和RFS的关系
总体生存分析中,ALKBH5高表达组和低表达组的中位OS分别为41.0个月和16.5个月,3年OS率分别为52%和23%,ALKBH5高表达组患者组和低表达组患者的OS曲线比较差异有统计学意义(χ2=6.486,P=0.011),见图3A。ALKBH5高表达组中位RFS未达到,其3年RFS率为61%;ALKBH5低表达组的中位RFS为6.1个月,3年RFS率为25%。ALKBH5高表达组患者和低表达组患者的RFS曲线比较差异有统计学意义(χ2=6.296,P=0.012),见图3B。公共数据集生存分析结果显示,ALKBH5高表达组患者的OS(P=0.015)及 RFS(P=0.002)均高于低表达组,见图3C~D。

图3 ALKBH5高表达和低表达HCC患者的OS和RFS曲线Fig.3 The OS and RFS curves of HCC patients with high and low expression of ALKBH5
2.4 HCC患者OS和RFS的单因素和多因素Cox回归分析
将ALKBH5表达、肿瘤大小、复发、病理分级、血管侵犯和ALB水平等单因素分析中P<0.1的变量纳入多因素Cox比例风险回归模型中进行分析。结果显示ALKBH5低表达是影响HCC患者OS的独立危险因素(HR=1.965,95%CI:1.029~3.751,P=0.041),见表 4。ALKBH5低表达是影响HCC患者RFS的独立危险因素(HR=2.201,95%CI:1.046~4.629,P=0.038),见表5。

表4 HCC患者OS期的单因素和多因素Cox回归分析Tab.4 Univariable and multivariable Cox regression analysis of OS of HCC patients
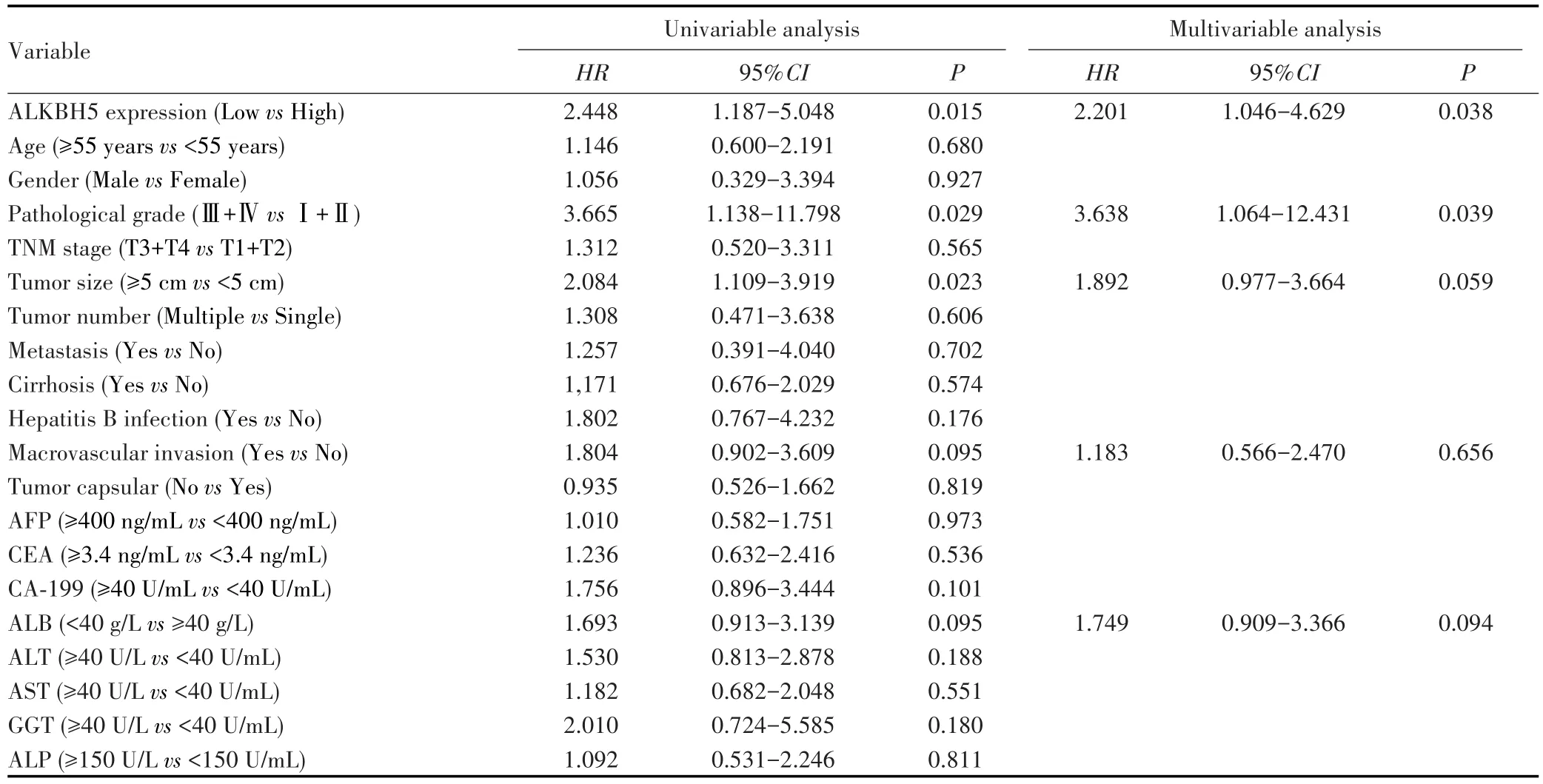
表5 HCC患者RFS的单因素和多因素Cox回归分析Tab.5 Univariable and multivariate Cox regression analysis of RFS of HCC patients
3 讨论
表观遗传调控中的异常如DNA甲基化、组蛋白甲基化和RNA甲基化等都是HCC发生的重要标志[15]。m6A修饰在恶性肿瘤包括HCC的发生发展过程中发挥了重要作用,因此探索m6A修饰酶在HCC中的功能及作用机制对寻找潜在的预后标志物和有效的治疗靶点以及制定针对m6A修饰酶的抗肿瘤治疗策略具有重要意义。现有文献报道ALKBH5在不同类型肿瘤中发挥不同作用,但其是促癌基因还是抑癌基因尚未有统一结论。ZHANG等[9]研究显示ALKBH5可通过去除转录因子叉头盒蛋白M1(forkhead box M1,FOXM1)mRNA的m6A修饰上调其表达,从而促进胶质母细胞瘤干细胞的自我更新、增殖和肿瘤形成。ALKBH5是缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的直接靶标,在低氧条件下表达增强[16]。ZHANG等[10]在模拟缺氧条件下发现缺氧能刺激HIF-1α和HIF-2α表达,并增强了ALKBH5表达,然后通过m6A去甲基化上调胚胎干细胞特异性转录因子的表达,进而促进乳腺癌肿瘤干细胞的浓缩富集,并提高其缺氧环境生存能力。在间歇性缺氧条件下,ALKBH5通过提高mRNA翻译效率促进FOXM1表达而在肺腺癌中发挥促癌作用[8]。然而,YU 等[13]研究发现ALKBH5可通过影响酪蛋白激酶2介导的糖酵解途径抑制膀胱癌进展。在胰腺癌中,ALKBH5通过减少Wnt抑制因子-1(Wnt inhibitory factor-1,WIF-1)mRNA 上的 m6A修饰从而介导Wnt通路抑制肿瘤发生和上皮细胞-间充质转化进程[12],或通过转录后激活生物钟相关蛋白(period circadian regulator 1,PER1)抑制肿瘤进展[11]。还有研究发现ALKBH5可以降低基质金属蛋白酶抑制因子3(TIMP metallopeptidase inhibitor 3,TIMP3)mRNA稳定性并促进非小细胞肺癌进展[17]。但另一研究认为ALKBH5可能通过减少转录共激活因子Yes相关蛋白(Yes-associated protein,YAP)表达并抑制YAP蛋白活性,从而在非小细胞肺癌中发挥抑癌作用[14]。上述研究说明,ALKBH5可能通过调节下游靶基因如转录因子、插头蛋白等的m6A修饰,影响mRNA加工及降解而间接影响靶基因表达,从而在一定程度上影响肿瘤发生发展,且ALKBH5依赖于特定的组织背景、肿瘤亚型和不同的下游分子而在各种癌症中发挥抑癌或促癌作用。
目前关于ALKBH5在HCC中的表达及其作用,各研究中观点也不一致。部分研究显示ALKBH5在HCC中表达上调[18-19],但也有研究报道ALKBH5在HCC中低表达[20-21]。CHEN 等[20]研究显示,在HCC中ALKBH5通过m6A依赖的方式抑制含Ly6/PLAUR结构域蛋白1(Ly6/PLAUR domain-containing protein 1,LYPD1)表达,从而抑制肿瘤的恶性行为。而QU等[22]研究发现ALKBH5在乙型肝炎病毒相关HCC(HBV-HCC)患者中高表达,且与乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)形成正反馈环而促进HBV-HCC进展。以上研究说明了m6A介导HCC效应的复杂性,也显示ALKBH5在HCC中具有重要作用。本研究通过免疫组化法检测HCC患者中ALKBH5蛋白的表达情况,发现在HCC组织中ALKBH5表达低于癌旁组织,进一步结合临床病理特征进行分析发现,相对于肿瘤大小<5 cm以及AFP低水平的HCC组织,ALKBH5在肿瘤大小≥5 cm以及AFP高水平的HCC组织群体中表达降低。而肿瘤大小一般反映了肿瘤细胞的增殖能力,且既往研究在体外实验中也发现ALKBH5可抑制肝癌HepG2细胞的增殖能力[23]。说明ALKBH5低表达可能促进HCC细胞增殖及疾病进展。为了进一步明确ALKBH5对HCC患者预后的影响,本研究还进行临床样本生存分析,结果同样显示,相对于ALKBH5高表达患者,ALKBH5低表达患者的OS和RFS缩短,多因素Cox回归分析也显示ALKBH5低表达是HCC患者OS和RFS的独立危险因素。利用在线数据集分析也得到一致结果,提示ALKBH5在HCC进展中发挥重要作用,但具体的作用机制仍不明确。目前多数癌症研究着眼于ALKBH5的去甲基化作用,但ALKBH5也可能通过其他途径影响癌症表型。此外,m6A修饰受到多种调节因子的影响,因此未来需要进一步探讨ALKBH5在HCC中通过m6A去甲基化调控的具体下游基因,以及其去甲基化作用在m6A修饰中的地位以及是否还存在其他分子机制可以解释ALKBH5在HCC中的效应。
综上所述,ALKBH5在HCC组织中低表达,且与HCC患者预后不良相关,ALKBH5可能在HCC进展过程中具有潜在的肿瘤抑制作用,有望成为HCC患者预后判断标志物及治疗靶点。但由于本研究样本量较小,仍存在一定局限性,如因纳入TNM高分期、发生转移的患者例数较少,未观察到这些重要临床病理特征与预后的联系。今后将进一步扩大样本量并开展更加系统的体内外实验,进一步明确ALKBH5在HCC中的临床意义、生物学功能及其作用机制。
