结肠癌来源外泌体通过HMGB1诱导中性粒细胞活化促进结肠癌细胞增殖、侵袭和迁移
2022-03-18周安付谭琰张惠晶
周安付 谭琰 张惠晶
随着结肠癌治疗理念以及分子生物学技术的不断发展,结肠癌的治疗已取得长足进步,但总体预后依然不理想[1]。因此,研究者不断探索结肠癌发病机制并挖掘新的治疗靶点,以期改善其预后。既往大量研究显示,肿瘤微环境(tumor microenvironment,TME)与肿瘤发生发展密切相关,针对TME的治疗策略也取得很大进展[2]。中性粒细胞作为TME的重要组成部分,也被发现参与了致癌生物学过程的不同阶段,包括肿瘤的启动、增殖及转移扩散[3]。有研究发现,肿瘤来源的外泌体可通过向TME中的免疫细胞发出信号,帮助肿瘤细胞逃避免疫监视,形成转移前的生态位[4]。但肿瘤来源外泌体在中性粒细胞激活中的作用目前尚不明确。高迁移率族蛋白1(high mobility group box 1,HMGB1)是在小牛胸腺中发现的一种高度保守的核蛋白,也是多种恶性肿瘤外泌体的重要组成成分之一[5]。既往研究报道HMGB1可以刺激中性粒细胞形成中性粒细胞外诱捕网(neutrophil extracellular traps,NETs)[6],且 HMGB1 在结肠癌患者血清和癌组织中表达升高[7]。由此推测结肠癌外泌体可能通过HMGB1激活中性粒细胞。本研究旨在探讨结肠癌细胞来源外泌体是否通过HMGB1而在中性粒细胞和结肠癌细胞中发挥作用,以期揭示结肠癌发生发展的分子机制。
1 材料与方法
1.1 主要材料
人结肠癌细胞系SW480和人正常结肠上皮细胞系NCM460购自中国科学院细胞库;shRNA阴性对照(sh-NC)和HMGB1特异性shRNA(sh-HMGB1)购自南京金斯瑞生物科技股份有限公司;Lipofectamine 2000转染试剂和SYTOX Green Nucleic Acid Stain Protocol购自赛默飞世尔科技(中国)有限公司;TransExoTMCell Media Exosome Kit购自北京全式金生物技术有限公司;中性粒细胞分离液购自北京索莱宝科技有限公司;HMGB1抗体、TSG101抗体购自美国GeneTex;CD63抗体购自美国Santa Cruz Biotechnology;CD81抗体和GRP94抗体购自英国Abcam公司;GAPDH抗体购自爱必信(上海)生物科技有限公司;CCK-8试剂盒购自上海碧云天生物技术有限公司。
1.2 细胞培养及转染
SW480和NCM460细胞用含10% FBS的RPMI-1640培养基培养,细胞培养条件为37℃、5% CO2。每2 d更换一次新鲜培养基,待细胞密度达到80%~90%时,用胰酶液消化细胞,进行传代培养或铺板操作。
将对数生长期的SW480细胞以5×105/mL密度接种于6孔板,培养24 h后,将细胞随机分为3组:SW480组(不进行转染操作)、sh-NC组(转染sh-NC)、sh-HMGB1组(转染sh-HMGB1)。根据Lipofectamine 2000转染试剂说明书进行细胞转染,培养48 h后进行后续实验操作。
1.3 外泌体分离和鉴定
收集SW480组、sh-NC组、sh-HMGB1组SW480细胞和NCM460细胞培养上清液,根据TransExoTMCell Media Exosome Kit说明书分离各组细胞培养上清液中的外泌体,分别命名为SW480-exo、sh-NC-exo、sh-HMGB1-exo、NCM460-exo。采用透射电镜观察外泌体形态,纳米颗粒跟踪分析仪检测外泌体粒径,Western blot实验检测外泌体标志性蛋白TSG101、CD63、CD81和细胞标志性蛋白GRP94的表达。
1.4 中性粒细胞的分离及分组
收集2018年8月—2020年8月海南医学院第一附属医院的健康体检者血液样本,血液样本的采集经本院伦理委员会审批通过,所有研究对象均签署知情同意书。中性粒细胞分离:向分离液中缓慢加入血液样本,1 000 r/min离心30 min。吸取白膜中性粒细胞层至新的离心管内,PBS清洗,1 000 r/min离心10 min,弃去上清液;用含10%FBS的RPMI-1640培养基重悬细胞,用台盼蓝拒染法测定中性粒细胞存活率和纯度,存活率>95%、纯度>95%表示中性粒细胞分离成功。分离成功的中性粒细胞分别添加PBS、NCM460-exo、SW480-exo、NCM460-exo、sh-NC-exo和sh-HMGB1-exo,外泌体添加量均为20 μg/mL,依次记为PBS组、NCM460-exo组、SW480-exo组、sh-NC-exo组和sh-HMGB1-exo组。继续培养24 h后,用PBS洗涤2次,加入含MNase(1 U/mL)酶的培养基,在37℃下孵育20 min;加入EDTA终止,离心取上清液,立即使用或置于-80℃条件下保存。
1.5 Sytox green染色检测中性粒细胞NETs形成情况
收集各组中性粒细胞培养上清液,PBS清洗后,用4%多聚甲醛室温固定15 min,加入Sytox green染色液,室温下避光孵育20 min后,弃去染色液。PBS再次清洗后,使用荧光显微镜观察细胞发光情况,用Image J软件分析Sytox green荧光单位。
1.6 Western blot检测HMGB1、TSG101、CD63、CD81和GRP94蛋白的表达水平
收集细胞和外泌体,采用RIPA裂解液裂解。离心收集上清液并测定其蛋白浓度。各组取30 μg蛋白进行SDS-PAGE凝胶电泳以及转膜操作。5%脱脂奶粉封闭非特异性结合位点,加入HMGB1(1∶1 000)、TSG101(1∶2 000)、CD63(1∶2 000)、CD81(1∶1 000)、GRP94(1∶1 000)和 GAPDH(1∶5 000)抗体稀释液,4 ℃条件下孵育过夜;加入二抗(1∶5 000)孵育1 h,滴加ECL发光液,凝胶成像系统检测蛋白条带,Image J软件分析各蛋白条带的灰度值。
1.7 CCK-8法检测细胞活力
取对数生长期的SW480细胞接种于96孔板,每孔1×104个细胞。将细胞随机分为PBS+Neutrophils组、SW480-exo+Neutrophils组、sh-NC-exo+Neutrophils组和sh-HMGB1-exo+Neutrophils组,按照分组,添加对应中性粒细胞培养上清液(与新鲜培养基比例为1∶1)。继续培养48 h后,根据CCK-8试剂盒说明书检测各组细胞光密度(OD)值。细胞活力(%)=[(实验组OD值-空白组OD值)/(PBS+Neutrophils组OD值-空白组OD值)]×100%或者是细胞活力(%)=[(实验组OD值-空白组OD值)/(SW480-exo+Neutrophils组OD值-空白组OD值)]×100%。
1.8 克隆形成实验检测细胞增殖情况
将对数生长期的SW480细胞接种于培养皿中,每皿接种300个细胞,细胞分组及处理同CCK-8法。各组细胞连续培养2周,弃去培养液,PBS清洗3次。4%多聚甲醛室温固定细胞15 min。移除固定液,加入吉姆萨染色液染色10 min后,流水冲洗,空气干燥。肉眼直接计数克隆数。
1.9 Transwell实验检测细胞迁移和侵袭情况
将对数生长期SW480细胞接种于Transwell上室,每孔5×104个细胞,细胞分组及处理同CCK-8法;Transwell下室则加入600 μL含20%FBS的RPMI-1640培养基。细胞于37℃、5% CO2培养箱中培养24 h后,取出Transwell小室,用4%多聚甲醛室温固定30 min,0.1%结晶紫染色10 min,在显微镜下观察细胞迁移情况。侵袭实验时,除所用Transwell小室预先用Matrigel包被外,其余操作步骤与迁移实验相同。
1.10 统计学方法
使用SPSS 21.0软件对数据进行统计分析。计量数据以均数±标准差(±s)表示。两组间数据的比较采用独立样本t检验,多组数据间的比较采用单因素方差分析,组间多重比较采用LSD-t检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌细胞来源外泌体的鉴定
用透射电镜观察结肠癌细胞来源外泌体的形态,结果显示,SW480-exo呈圆形囊泡结构,见图1A;Western blot检测结果显示,SW480-exo中TSG101、CD63、CD81蛋白呈阳性表达,GRP94蛋白不表达;而SW480细胞中TSG101、CD63、CD81蛋白表达不明显,GRP94蛋白明显表达,见图1B;纳米颗粒跟踪分析仪检测结果显示,SW480-exo平均直径为100 nm,见图1C。以上实验结果表明结肠癌细胞来源外泌体分离成功。

图1 结肠癌细胞来源外泌体的鉴定Fig.1 Identification of exosomes from colon cancer cells
2.2 结肠癌外泌体及中性粒细胞中HMGB1的表达水平
Western blot检测结肠癌细胞SW480和正常结肠上皮细胞NCM460外泌体中HMGB1蛋白含量,结果显示,SW480-exo中HMGB1蛋白含量明显高于NCM460-exo(P=0.003),见图2A。PBS和SW480-exo分别处理中性粒细胞后,SW480-exo组中性粒细胞中HMGB1蛋白的表达水平较PBS组明显升高(P=0.001),见图2B。
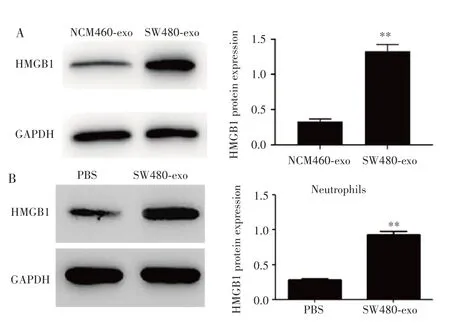
图2 Western blot检测结肠癌外泌体和中性粒细胞中HMGB1蛋白的表达Fig.2 Expression of HMGB1 protein in colon cancer exosomes and neutrophils detected by Western blot
2.3 SW480-exo对中性粒细胞NETs形成的影响
PBS、NCM460-exo或SW480-exo分别处理中性粒细胞后,用Sytox green染色检测中性粒细胞NETs形成情况,结果显示,与PBS组相比,NCM460-exo组中性粒细胞的Sytox green荧光单位无明显变化(P=0.643),但SW480-exo组中性粒细胞Sytox green荧光单位明显升高(P=0.006),见图3。
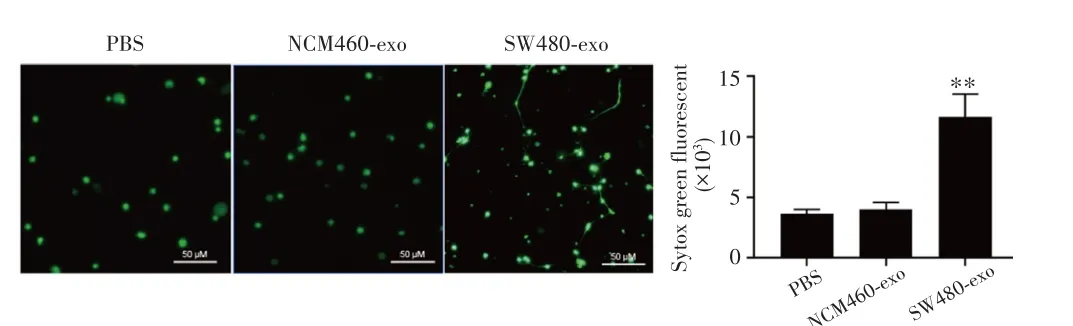
图3 Sytox green染色检测中性粒细胞NETs形成(×400)Fig.3 Sytox Green staining for the formation of neutrophil NETs(×400)
2.4 经SW480-exo处理的中性粒细胞对结肠癌细胞增殖、迁移和侵袭的影响
CCK-8、克隆形成实验和Transwell实验检测结果显示,与PBS+Neutrophils组相比,SW480-exo+Neutrophils组SW480细胞活力(P=0.002)、克隆形成数(P=0.003)、迁移细胞数(P=0.004)和侵袭细胞数(P=0.006)均明显升高,见图4。
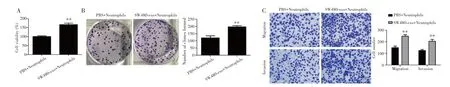
图4 经SW480-exo处理的中性粒细胞对结肠癌细胞的影响Fig.4 Effect of neutrophils treated with SW480-exo on colon cancer cells
2.5 sh-HMGB1-exo对中性粒细胞NETs形成的影响
Western blot检测结果显示,sh-NC和sh-HMGB1转染SW480细胞后,sh-HMGB1组细胞中HMGB1蛋白表达较sh-NC组明显降低(P=0.003),但SW480组与sh-NC组比较差异无统计学意义(P=0.728),见图5A。表明敲低HMGB1的结肠癌细胞模型构建成功。
SW480-exo、sh-NC-exo和sh-HMGB1-exo处理中性粒细胞后,sh-HMGB1-exo组细胞中HMGB1蛋白表达(P=0.002)和Sytox green荧光单位(P=0.004)均较sh-NC-exo组明显降低,但sh-NC-exo组与SW480-exo组比较差异无统计学意义(均P>0.05),见图5B~C。

图5 sh-HMGB1-exo对中性粒细胞NETs形成的影响Fig.5 Effect of sh-HMGB1-exo on the formation of neutrophil NETs
2.6 经sh-HMGB1-exo处理的中性粒细胞对结肠癌细胞增殖、迁移和侵袭的影响
CCK-8法、克隆形成实验和Transwell实验检测结果显示,与sh-NC-exo+Neutrophils组相比,sh-HMGB1-exo+Neutrophils组SW480细胞活力(P=0.008)、克隆形成数(P=0.010)、迁移细胞数(P=0.007)和侵袭细胞数(P=0.005)均明显降低,但SW480-exo+Neutrophils组无明显变化(均P>0.05),见图6。
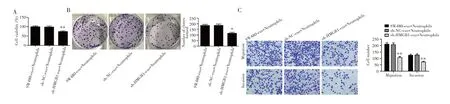
图6 经sh-HMGB1-exo处理的中性粒细胞对结肠癌细胞的影响Fig.6 Effect of sh-HMGB1-exo-treated neutrophils on colon cancer cells
3 讨论
中性粒细胞是人体循环中含量最丰富的白细胞,在炎症和宿主防御微生物感染方面起着关键作用[8]。中性粒细胞通常被认为对肿瘤细胞有防御反应,但最近的证据表明肿瘤调节中性粒细胞功能以支持肿瘤生长和发展,且主要参与促进肿瘤发生、转移、血管生成和免疫抑制等[9]。有研究显示,中性粒细胞可能通过趋化、吞噬、脱颗粒和形成NETs发挥其功能[10]。NETs是一种网状结构,包含由中性粒细胞在一定刺激下排出的解聚DNA细丝和颗粒内容物,可诱导一种不同于凋亡和坏死的新型细胞死亡[11]。NETs还含有丰富的促炎分子,且与各种无菌炎症条件有关[12]。研究表明,中性粒细胞可通过NETs捕获循环中的肿瘤细胞而促进细胞向远处转移,从而导致肿瘤细胞扩散[13]。动物实验表明,结肠癌肝转移模型中的中性粒细胞水平升高与NETs形成及肿瘤转移密切相关[14]。然而,NETs在结肠癌微环境中的作用及机制并不清楚。近年来研究显示,结肠癌细胞来源外泌体作为细胞间通讯的信使,也是肿瘤发生的介质。而靶向抑制外泌体可能是结直肠癌潜在的有效治疗方法[15]。此外,还有证据显示,结肠癌来源外泌体通过将突变的KRAS转移到中性粒细胞,从而诱导中性粒细胞募集和NETs形成,最终导致疾病恶化[16]。本研究亦发现,结肠癌来源外泌体SW480-exo处理中性粒细胞可诱导其NETs形成,进一步将经SW480-exo处理的中性粒细胞培养上清液添加至结肠癌细胞中,发现结肠癌细胞活力、细胞增殖能力、迁移细胞数和侵袭细胞数均升高,提示结肠癌来源外泌体可能通过诱导中性粒细胞NETs的形成,进一步促进结肠癌细胞增殖、迁移和侵袭。
HMGB1作为肿瘤外泌体的成分之一,主要通过调节免疫反应参与癌症进展。如,LI等[17]报道食管鳞状细胞癌来源的外泌体通过HMGB1诱导巨噬细胞M2表型转换,从而促进疾病进展。肝细胞癌细胞来源外泌体也能通过HMGB1激活B细胞并促进TIM-1+Breg细胞扩增,从而促进肝细胞癌免疫逃避和疾病进展[18]。目前,已有证据显示,HMGB1可能是NETs的重要组成部分。ZHA等[19]在胶质瘤细胞中发现HMGB1能修饰NETs的网状结构,同时与胶质瘤细胞上的相关因子相互作用导致核因子NF-κB激活,从而促进细胞增殖、迁移和侵袭。还有研究发现,乳腺癌患者血清HMGB1水平与中性粒细胞数量呈正相关,其中低氧原发肿瘤可导致肿瘤细胞分泌HMGB1,诱导中性粒细胞CD62Ldim表型极化,从而促进肿瘤转移[20]。本研究发现,结肠癌细胞外泌体中HMGB1含量明显高于正常结肠上皮细胞,且结肠癌来源外泌体SW480-exo可诱导中性粒细胞表达HMGB1和NETs形成,但用敲低HMGB1的结肠癌细胞外泌体sh-HMGB1-exo处理中性粒细胞发现HMGB1表达下调且NETs形成减少;进一步将sh-HMGB1-exo处理的中性粒细胞培养上清液加入结肠癌细胞中,发现结肠癌细胞活力、增殖能力、迁移细胞数和侵袭细胞数均降低,与上述文献[18-20]报道一致。说明结肠癌来源外泌体可能通过HMGB1诱导中性粒细胞NETs的形成,进而促进结肠癌细胞增殖、迁移和侵袭。
综上所述,结肠癌来源外泌体可能通过将HMGB1传递至中性粒细胞中并诱导NETs形成,从而促进结肠癌细胞增殖、迁移和侵袭,HMGB1可能是潜在的治疗靶点。本研究结果有助于进一步阐明结肠癌发病机制,也为开发新的治疗靶点提供了的思路。
