DCE-MRI结合DWI评估肝癌介入治疗疗效的应用价值
2022-03-18胡卫刘良进
胡卫 刘良进
江汉大学附属湖北省第三人民医院放射科,武汉 430033
原发性肝癌是以肝细胞癌为主的消化道恶性肿瘤[1],由于病情进展快,患者生存期短,增加了治疗的难度[2],严重威胁患者的生命安全。肝癌治疗根据病情分期不同选择手术或非手术方式治疗,而介入治疗多用于中晚期无法行手术切除的肝癌患者[3]。治疗后有效的疗效评估可积极指导下一步的治疗,目前磁共振成像(magnetic resonance imaging,MRI)等影像学检查是评价疗效的常用方式[4],但常规MRI无法区分肿瘤的坏死区及活性区[5],需通过增强各组织的密度差异进行鉴别。动态增强磁共振成像(dynamic contrast enhance magnetic resonance imaging,DCE-MRI)是静脉注入造影剂后进行扫描,造影剂随血液循环散布到全身各组织,根据不同组织中造影剂的含量鉴别组织密度,可显示肿瘤组织血流动力学情况。较常规MRI,DCE-MRI只可部分区别肿瘤的坏死区[6]。扩散加权成像(diffusion-weighted imaging,DWI)是一种分子水平的成像技术,可观察肿瘤组织内部微环境变化,从分子水平对肝脏肿瘤组织的坏死区及活性区进行分辨[7]。因此,DCE-MRI联合DWI检查评价肝癌介入后的疗效具有显著优势。本文重点探讨DCE-MRI结合DWI评估肝癌介入治疗疗效的应用价值,为临床提供理论依据,详述如下。
资料与方法
1、一般资料
收集2019年2月至2020年3月在江汉大学附属湖北省第三人民医院行肝癌介入治疗的120例患者的病例资料进行病例对照研究,根据治疗疗效不同分为有效组(71例)与无效组(49例)。有效组男性52例,女性19例,年龄41~65(53.16±8.47)岁;病因为肝硬化45例,病毒性肝炎26例;肝癌分期[8]:Ⅱb期34例,Ⅲa期29例,Ⅲb期8例。无效组男性31例,女性18例,年龄41~64(53.21±8.69)岁;病因为肝硬化27例,病毒性肝炎22例;肝癌分期[8]:Ⅱb期23例,Ⅲa期19例,Ⅲb期7例。
本研究通过江汉大学附属湖北省第三人民医院医学伦理委员会批准[批准编号:(2021)伦审科第(17)号]。患者本人及家属知情同意并签署知情同意书。
原发性肝癌诊断标准[9]:有肝区疼痛、消瘦、乏力等症状,结合肿瘤标志物检查、MRI、动脉造影等检查可确诊。
纳入标准:⑴所有病例均符合上述诊断标准并行介入治疗;⑵年龄40~65岁;⑶为多发结节型肝癌,生存期大于3个月;⑷病历资料完整。排除标准:⑴肝门静脉完全阻塞、侧支血管少;⑵肝功能严重障碍、肾功能不全者;⑶有药物过敏史;⑷合并严重心、肺疾患者;⑸无法完全配合检查的患者。
2、检查方法
所有患者于介入术前、术后1个月采用磁共振成像仪(德国西门子,Verio3.0T)行MRI检查,各项主要扫描参数见表1,仪器相对标准偏差为3%。先常规行T1WI、T2WI扫描,再采用DWI序列,弥散梯度因子(b值)取0、1 000 s/mm2,DCE-MRI检查时静脉输注对比剂钆特酸葡胺(377 mg/ml:20 ml,法国GUERBET,注册证号H20110120),高压注射器以2 ml/s的流率注入,对比剂注射完毕后,接着注入0.9%的氯化钠注射液20 ml,连续采集32P,总共扫描时间320 s。
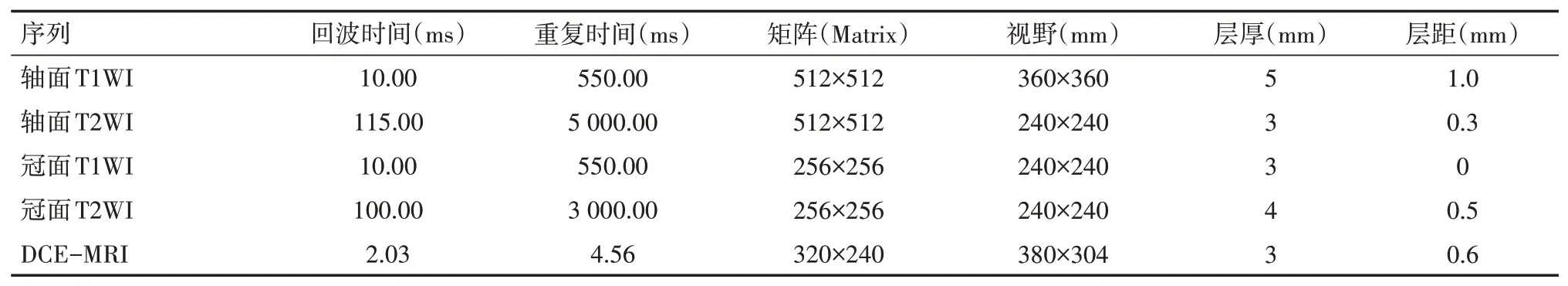
表1 肝癌介入治疗后患者肝脏MRI各项主要扫描参数
3、影像处理及分析
DCE-MRI扫描后将图像传到仪器工作站进行分析,首先设定观察目标的感兴趣区(region of interest,ROI),再进行图像校正处理,调整摆动差,剔除无效时相,获得表观扩散系数(apparent diffusion coefficient,ADC)、血管渗透参数运转常数(volume transfer constant,Ktrans)、速率常数(rate constant,Kep)、细胞外血管外空间体积分数(volume fraction of extracellular vascular space,Ve)、肿瘤体积,在病灶中心区域选择2个ROI区,取2个区域的平均值。由2位高年资医师对120例患者治疗前后检查所得的图像进行分析。计算术前及术后2周ADC、Ktrans、Kep、Ve、肿瘤体积的差值。
4、临床疗效评定
根据改良实体瘤反应评价标准(Modified Response Evaluation Criteria in Solid Tumors,mRECIST)及欧洲肝病学会(European Association for the Study of the Liver,EASL)评价标准[10]评定肝癌介入术后的疗效:若病灶消失,病灶总长径缩小30%以上,病灶缩小30%以下且增加20%以下可评定为有效;若病灶总长径增加超过20%或增加新病灶视为无效。
5、统计学方法
采用SPSS22.0软件分析数据,ADC、Ktrans、Kep、Ve、肿瘤体积等计量资料使用(±s)表示,正态及方差齐性检验满足要求,治疗前后比较采用配对t检验,组间对比采用独立样本t检验,ADC、Ktrans、Kep、Ve差值与肿瘤体积差值等各因子相关性分析采用Pearson相关分析,以P<0.05为差异有统计学意义。ADC、Ktrans、Kep、Ve差值对疗效的评估价值用受试者工作特征曲线(receiver operating characteristic curve,ROC)下面积表示。
结 果
1、肝癌介入术前后患者肝脏MRI测量参数结果对比
与介入术前相比,介入术后ADC值升高,Ktrans、Kep、Ve值、肿瘤体积降低(均P<0.05)。见表2。
表2 肝癌介入术前后120例患者肝脏MRI测量参数结果对比(±s)

表2 肝癌介入术前后120例患者肝脏MRI测量参数结果对比(±s)
注:MRI为磁共振成像;ADC值为表观扩散系数;Ktrans为血管渗透参数运转常数;Kep为速率常数;Ve为细胞外血管外空间体积分数
?
2、不同疗效组患者肝脏MRI成像各参数差值比较
120例患者中治疗有效71例(59.17%),无效49例(40.83%)。治疗有效组ADC、Ktrans、Kep、Ve差值、肿瘤体积差值明显高于无效组(均P<0.05),见表3。
表3 肝癌介入治疗不同疗效组患者肝脏MRI成像各参数差值比较(±s)
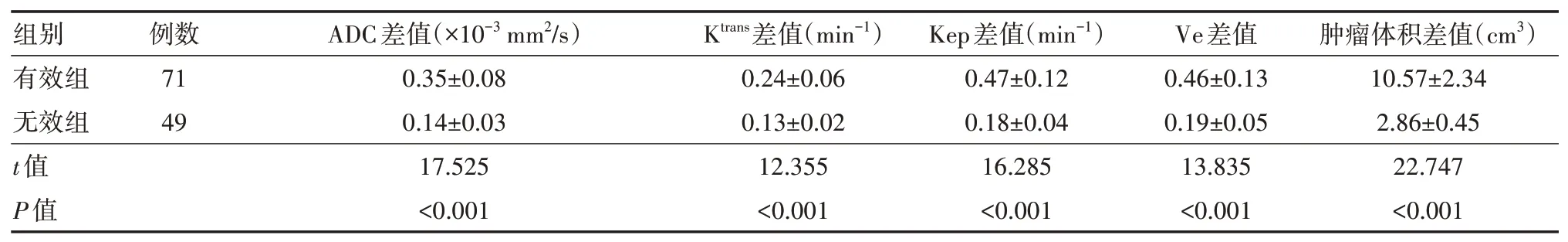
表3 肝癌介入治疗不同疗效组患者肝脏MRI成像各参数差值比较(±s)
注:MRI为磁共振成像;ADC差值为肝癌介入治疗前后表观扩散系数差值;Ktrans差值为肝癌介入治疗前后血管渗透参数运转常数差值;Kep差值为肝癌介入治疗前后速率常数差值;Ve差值为肝癌介入治疗前后细胞外血管外空间体积分数差值
?
3、肝癌介入治疗前后患者肝脏DCE-MRI结合DWI的参数ADC、Ktrans、Kep、Ve的差值与肿瘤体积差值的相关性分析
ADC差值、Ktrans差值、Kep差值、Ve差值与肿瘤体积差值呈正相关(均P<0.05)。见表4、图1。
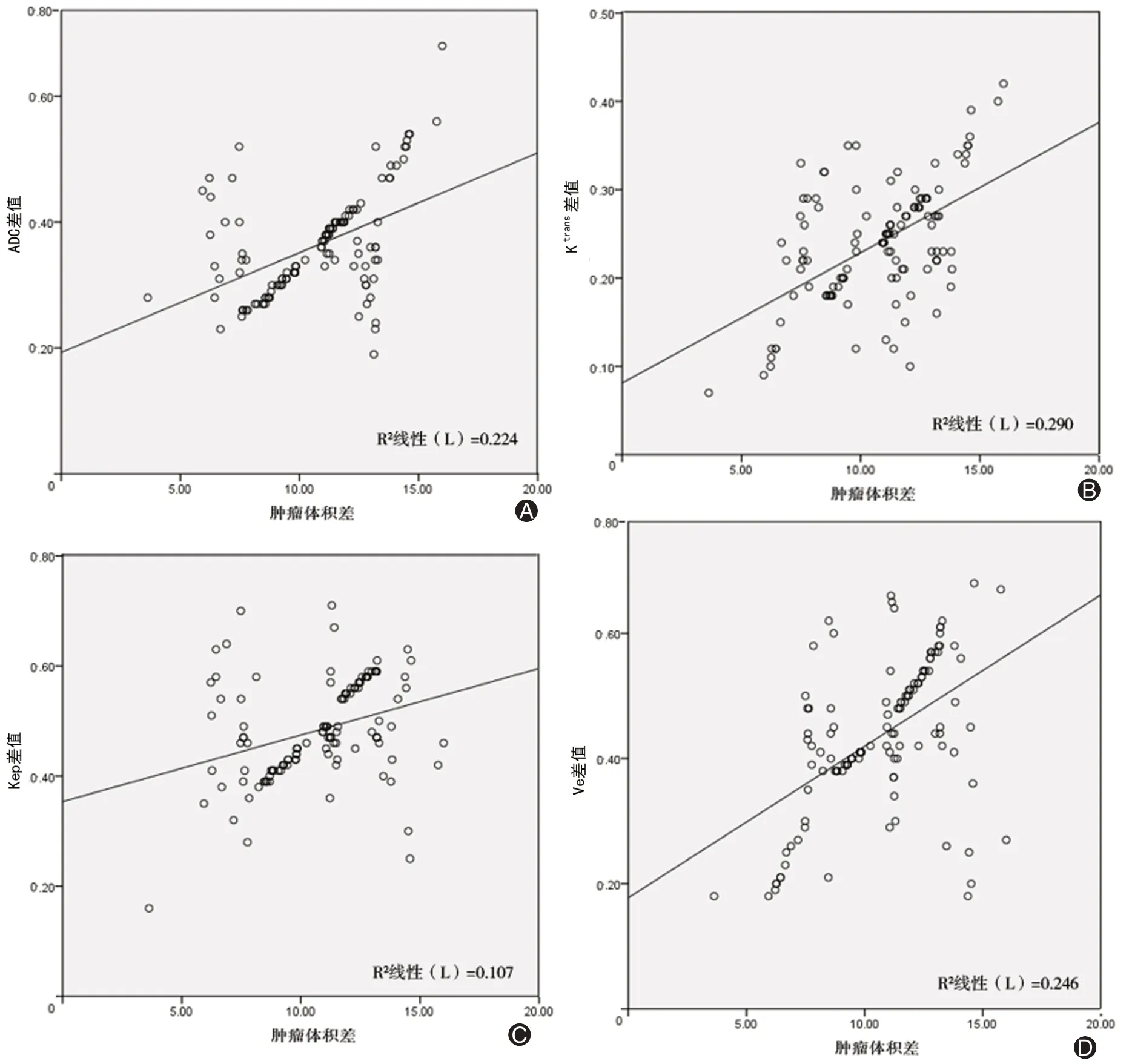
图1 肝癌介入治疗前后120例患者肝脏DCE-MRI结合DWI的参数ADC、Ktrans、Kep、Ve的差值与肿瘤体积差值的相关性。A:ADC差值与肿瘤体积差值的相关性散点图;B:Ktrans差值与肿瘤体积差值的相关性散点图;C:Kep差值与肿瘤体积差值的相关性散点图;D:Ve差值与肿瘤体积差值的相关性散点图

表4 120例肝癌介入治疗后患者肝脏DCE-MRI结合DWI的参数ADC、Ktrans、Kep、Ve的差值与肿瘤体积差值的相关性分析
注:DCE-MRI动态增强磁共振成像;DWI为扩散加权成像;ADC差值为肝癌介入治疗前后表观扩散系数差值;Ktrans差值为肝癌介入治疗前后血管渗透参数运转常数差值;Kep差值为肝癌介入治疗前后速率常数差值;Ve差值为肝癌介入治疗前后细胞外血管外空间体积分数差值DCE-MRI动态增强磁共振成像;DWI为扩散加权成像;ADC差值为肝癌介入治疗前后表观扩散系数差值;Ktrans差值为肝癌介入治疗前后血管渗透参数运转常数差值;Kep差值为肝癌介入治疗前后速率常数差值;Ve差值为肝癌介入治疗前后细胞外血管外空间体积分数差值
4、肝癌介入前后患者肝脏DCE-MRI参数ADC差值与Ktrans差值预测肝癌术后疗效的价值
ADC差值>0.380×10-3mm2/s时的ROC下面积(areaunder curve,AUC)为0.953,95%置信区间(confidenceinterval,CI)为0.898~0.983(P<0.001);Ktrans差值>0.250 min-1时,ROCAUC为0.933(95%CI为0.872~0.970,P<0.001);ADC、Ktrans差值预测肝癌介入术后疗效灵敏度分别为91.84%、89.80%,特异度分别为91.55%、88.73%;ADC、Ktrans差值预测肝癌介入术后疗效的效能均较高(均P<0.05)。见表5、图2。

表5 120例肝癌介入前后患者肝脏DCE-MRI参数ADC差值与Ktrans差值预测肝癌介入术后疗效的价值
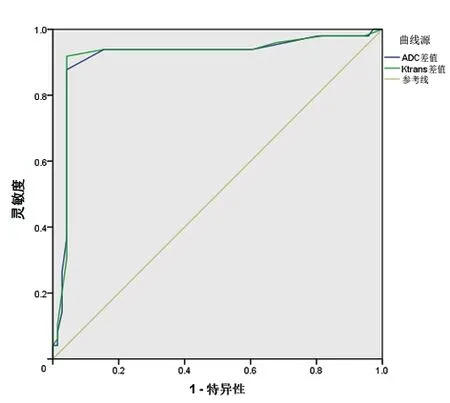
图2 肝癌介入前后120例患者肝脏DCE-MRI参数ADC差值、Ktrans差值预测肝癌介入术后疗效的效能
讨 论
肝癌介入治疗的适应证包括不能手术切除、术后复发的晚期肝癌病例。它是通过药物灌注、肿瘤血管栓塞的方式切断肿瘤细胞血液供应,使之坏死、减少的过程。部分患者在介入治疗后的肝癌分期可发生逆转,原本不能手术的病灶可转化为可切除的肝癌病灶[11];因此,肝癌介入术后早期的疗效评价对提高患者的生存质量有重要意义。目前介入术后没有统一的疗效评价标准[12]。生存分析法、甲胎蛋白复查法及影像学检查是3种主要方式,生存分析法适用于样本量大、患者生存期较长的病例研究。甲胎蛋白是常用的实验室参考指标,影响因素较多,准确性差[13]。超声、计算机断层扫描、数字减影血管造影、MRI等影像学检查在临床应用广泛,临床常根据实体瘤mRECIST及EASL标准评价肝癌介入后的疗效,影像学检查可对肿瘤病灶的大小作出较准确的判断。DWI利用MRI对运动物质的敏感性,反映随着磁场梯度的增强,水分子的扩散引起横向磁化矢量的失相位,呈现出低信号图像,是目前唯一的在活体中行水分子弥散测量的方法[14],可从细胞分子水平研究疾病的病理生理状态。DWI可定性、定量地评估肝癌介入术后的疗效,与计算机断层扫描、超声等相比具有无辐射、客观等优势[15]。
本研究中治疗有效组ADC、Ktrans、Kep、Ve差值高于无效组,与介入术前相比,介入术后,ADC、Ktrans、Kep、Ve差值与肿瘤体积差值呈正相关,说明治疗前后ADC、Ktrans、Kep、Ve值变化越明显,肿瘤体积变化越大,治疗反应也越优。考虑原因如下:ADC值可定量反映肿瘤组织的坏死情况,评判肝癌介入术后的早期疗效[16]。本研究中介入术后ADC值升高,提示肿瘤组织因血供阻断而坏死,降低了对细胞内水分子的束缚。Ktrans、Kep、Ve是DCE-MRI定量指标,反映病灶处的血流量和血管壁的通透性[17]。介入治疗前肿瘤细胞生长迅速,导致病灶新生血管通透性增加,对比剂可更快流入肿瘤组织内,故DCE-MRI测得Ktrans、Kep、Ve数值偏高,而介入治疗后,肿瘤细胞坏死,病灶血管密度减少,血管通透性降低,因此所得数值降低。本研究介入术后Ktrans、Kep、Ve值降低,说明Ktrans、Kep、Ve值可反映介入术后肿瘤细胞的坏死情况。
ROC可直观反映疾病的诊断效能,以诊断界限值来判断准确性,明确反映出诊断方法的灵敏度及特异度的关联,而AUC越大,表明其诊断的准确性越高[18]。本研究ROC提示ADC、Ktrans差值预测疗效的AUC分别达0.953、0.933,灵敏度、特异度达到86%以上,ADC、Ktrans差值预测肝癌介入术后疗效的效能均较高,说明DCE-MRI联合DWI可提高诊断肝癌介入数后疗效评价的准确性。因为ADC、Ktrans作为DWI、DCE-MRI检查的定量参数,介入前后ADC、Ktrans差值与肿瘤体积差值相关性最高,而治疗有效组的差值更高,故DCE-MRI联合DWI评价肝癌介入术后疗效的价值较高。
综上所述,DCE-MRI联合DWI对肝癌介入术后患者治疗反应的评价有重要临床价值,介入术前后的参数变化值可较直观地反映疗效,为疗效评估提供客观的影像学数据,有效指导肝癌患者进一步治疗方案的制定。
利益冲突所有作者均声明不存在利益冲突
