miRNA-34a-5p,SIRT6在不同月龄小鼠耳蜗中的表达及意义
2022-03-17苏琳凌王世飞谢天宏龙依琳
苏琳凌,王世飞,谢天宏,饶 澄,龙依琳,李 欢
(遵义医科大学附属医院 耳鼻咽喉科,贵州 遵义 563099)
老年性耳聋(Age-related hearing loss,AHL)是指因年龄的增长而出现听力减退的生理现象[1],典型临床表现为进行性、双耳对称性的听力下降,往往伴有言语理解能力的明显下降。目前AHL 的致病因素较复杂,近年来国内外相关研究多提示炎症、线粒体突变、氧化应激、细胞凋亡等多种途径都参与了老年性耳聋的发生发展,且mtDNA的突变或缺失是AHL发生的根本原因。 SIRT6 是Sirtuin (沉默信息调节因子 )蛋白家族中的第四类成员,可在哺乳动物细胞核中广泛表达,并自发地催化自身 ADP-核糖基转移反应,调控包括衰老在内的众多生命过程,可通过调控 DNA 双链损伤修复来延缓细胞衰老过程,从而延长寿命,是一个理想的“衰老抑制因子”。miRNA-34a是一种较为保守的miRNA,通常作为癌症的生物标记物,其介导癌症细胞多与细胞增殖、细胞凋亡等相关[2],miRNA微阵列结果显示,哺乳动物体内,随着年龄的增加,miRNA-34a表达水平也随之上升,但作用机制尚不明确[3]。现国内外多数研究者发现miRNA-34a、SIRT6在其他组织器官细胞凋亡中的作用呈负相关[4],但在老年性耳聋发病机制中的作用罕见报道。本研究拟分别检测C57BL/6小鼠4个生长发育时间点( 3、6、12 和 16 月龄)及D-半乳糖造模小鼠耳蜗组织中miRNA-34a-5p(从miRNA-34a前体的5’端臂加工而来)、SIRT6表达的增龄性变化特点,探讨两者在AHL发生发展中的相互作用及意义。
1 材料与方法
1.1 实验动物及分组 选取不同年龄段无耳疾C57BL /6雄性小鼠24只,体重30~40 g,按不同年龄分为:3月龄组6只,6月龄组6只,12月龄组6只,16月龄组6只,选取10只2月龄SPF级C57BL/6小鼠,体重均为15~25 g。上述实验动物由上海灵畅生物科技有限公司提供,于本单位实验动物中心低噪音环境下常规饲养,室温21~23℃,相对湿度40%~60%,室内 12 h 明暗自动切换,通风良好。动物购买回来后,分别放入笼中饲养,自由摄食与进水。按照《遵义医科大学医学伦理委员会条例》,严格规范饲养及实验过程。
1.2 仪器与试剂 显微镜(奥林巴斯公司,日本);显微手术器械( 淮北软隆生物科技有限公司,中国);多功能荧光酶标仪( SANYO 公司,日本);SYBR Premix Ex TaqTM试剂盒(大连TaKaRa有限公司,中国);KitTakara-PrimeScriptTM RT试剂盒(大连TaKaRa有限公司,中国);RNAiso Plus(大连TaKaRa有限公司,中国);实时荧光定量PCR仪(赛默飞公司,美国);戊巴比妥钠规格:25 g/瓶(国药集团化学试剂上海有限公司,中国);D-半乳糖(D-gal);规格:100 g/ 瓶(上海经科化学科技有限公司,中国)。
1.3 D-半乳糖衰老小鼠动物模型制作 选取2月龄SPF级C57BL/6小鼠10只,每日颈背部皮下注射D-半乳糖150 mg/kg,连续6周。实验期间自由进食饮水、节律光照,随机选取6只小鼠用于后续研究。
1.4 耳蜗标本预处理 取各组小鼠,用2%戊巴比妥钠腹腔注射麻醉,注射参照剂量为50 mg/kg。在显微镜下,将小鼠固定于脑立体定位仪(根据Paxinos和富兰克林的立体定位坐标系中的老鼠大脑[2012]),断头处死小鼠后迅速取出双侧听泡,并分别将耳蜗进行分离,用等渗生理盐水冲洗耳蜗样本组织,并置入-80℃液氮中进行保存。一只用于测定miRNA-34a-5p表达,另一只用于测定SIRT6表达。
1.5 miRNA-34a-5p荧光定量PCR检测 取各组耳蜗组织于1.5 mL离心管中,每50~100 mg组织加1mL TRIzol,用匀浆仪进行匀浆处理。样品体积不超过TRIzol体积的10%。Trizol 法提取总 RNA,逆转录成 cDNA,产物用于qRT-PCR 扩增。70℃ 预变性 5 min,42℃ 退火 15 min,4℃ 延伸 5 min 反转录形成 cDNA,扩增目的基因和内参。qRT-PCR 反应条件:95℃ 预变性 30 s, 95℃变性 5 s,60℃ 退火 30 s,循环 40 次,再95℃变性 15 s,60℃ 退火 30 s 。目的基因引物序列如表1所示。

表1 miRNA-34a-5p 和参照基因引物序列
1.6 SIRT6荧光定量PCR检测 取各组耳蜗组织于1.5 mL离心管中,每50~100 mg组织加1 mL TRIzol,用匀浆仪进行匀浆处理。样品体积不超过TRIzol体积的10%。Trizol 法提取总RNA,逆转录成 cDNA,产物用于qRT-PCR 扩增。70℃ 预变性 5 min,42℃ 退火 15 min,4℃ 延伸 5 min反转录形成 cDNA,扩增目的基因和内参。qRT-PCR 反应条件:95℃ 预变性 30 s, 95℃变性 5 s,60℃ 退火 30 s,循环 40 次,再95℃变性 15 s,60℃ 退火 30 s 。所有数据均使用 2-△△CT方法进行处理,目的基因引物序列如表 2 所示。
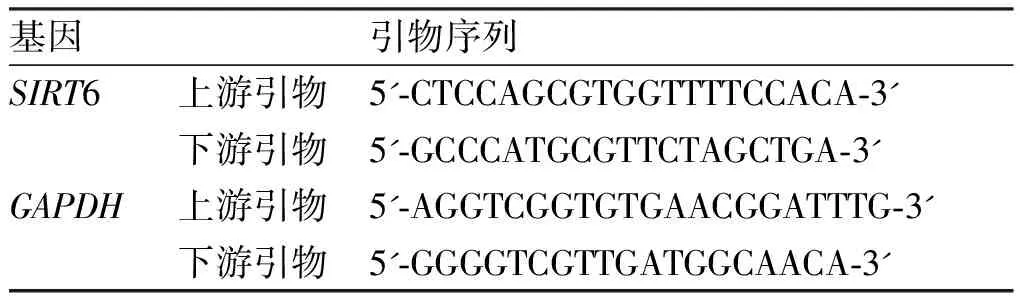
表2 SIRT6和参照基因引物序列
1.7 统计学处理 采用SPSS 17.0 软件进行统计学分析,Graphad Prism 6.01 软件绘制图表。组间比较应用单因素方差分析,组间两两比较应用LSD-t检验。采用Pearson相关系数进行相关性分析;以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠耳蜗中miRNA-34a-5p 表达 3、6、12、16月龄的C57BL/6 小鼠的耳蜗段miRNA-34a-5p表达水平依次增加,两两间差异均有统计学意义(P<0.05) 。其中D-半乳糖造模组与3、6月龄相比,差异均有统计学意义(P<0.05) ;与12、16月龄组比较,差异无统计学意义(P>0.05,见图1)。
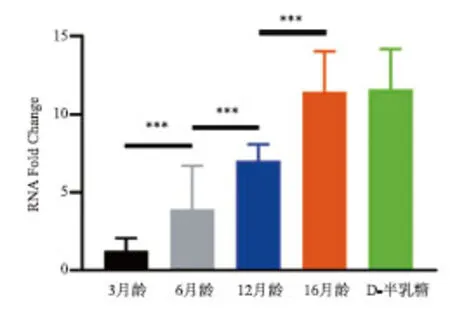
***:P<0.001。图1 miRNA-34a-5p 表达水平
2.2 各组小鼠耳蜗中SIRT6的表达 3、6、12、16月龄C57BL/6小鼠的耳蜗段SIRT6表达水平依次降低,两两间差异均有统计学意义(P<0.05),其中D-半乳糖造模组与3、6、12月龄相比,差异均有统计学意义(P<0.05) ,D-半乳糖造模组与16月龄组比较,差异无统计学意义(P>0.05,见图2)。
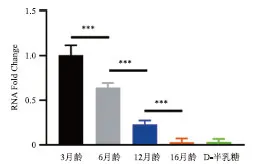
***:P<0.001。图2 SIRT6表达水平
经 Pearson相关性分析,耳蜗中段 miRNA-34a-5p 表达与SIRT6 表达水平呈负相关性(r=-0.591,P﹤0.05) 。
3 讨论
目前老年性耳聋的致病机制复杂,其发生发展机制尚不明确,国内外近年来研究提示AHL的发生发展包含了多种途径,如DNA损伤应答的改变、线粒体功能障碍、炎症以及基因调控的变化等[5];宁云红等[6]报道也提示老年性耳聋发生的根本原因与线粒体DNA(mtDNA)的突变或者缺失相关;研究显示,耳蜗细胞凋亡与线粒体DNA缺失或者基因突变的积累有关;耳蜗毛细胞中的线粒体DNA、细胞脂质、蛋白质等大分子物质会因活性氧(ROS)的积累而被破坏,从而导致慢性炎症的发生[7]。自由基稳态失衡致内耳损伤、细胞凋亡以及糖原蓄积致听觉器官功能丧失也与AHL的发病机制相关;但现有的研究方向多限于对其某方面的因素,对综合因素的研究甚少。由此可见,寻找上述各种途径的交叉点,可能是AHL发病机制研究的关键,也可能是其治疗的关键靶点。
沉默信息调节因子(Silent information regulator,Sirtuin)是一类NAD + 依赖的组蛋白去乙酰化酶,Sirtuin 6(SIRT6)则属于其中一员,具有多种底物和催化活性,可介导多种细胞凋亡途径从而抑制细胞凋亡[8];同时SIRT6参与细胞衰老各个相关机制的调控,在细胞凋亡、免疫和细胞衰老等生理过程中,核转录因子kB( Nuclear factor kB,NF-kB) 信号通路有着重要的作用,研究表明BZBS可能通过激活Sirt6/NRF2/HO-1和Sirt6/P53-PGC-1α-TERT信号通路来保护快速衰老小鼠的氧化还原稳态和端粒完整性,抑制细胞凋亡来减轻早衰[9];有报道对129例有长寿家族史的居民和86例无长寿家族史的个体进行了病例对照研究,确定低水平的SIRT6甲基化可能是中国人长寿的潜在保护因素[10]。SIRT6具有去乙酰化酶活性,同时能通过催化自身 ADP-核糖基转移反应获得核糖基转移酶活性[11];在DNA损伤早期,SIRT6可多途径提高DNA双链损伤 (Double-strand break,DSB)修复能力,招募SNF2H(一种atp依赖的染色质重塑)到DNA双链断裂点,进行DNA的损伤修复[12]。总之SIRT6参与复制性衰老及多种衰老过程,主要通过调控衰老相关基因、维持基因组稳定性实现。针对AHL相关的进展机制,可假设SIRT6对AHL的进展应具有调控作用,本研究发现在不同月龄C57BL/6小鼠及D-半乳糖造模小鼠耳蜗中,SIRT6的表达水平在月龄组间差异均具有统计学意义(P<0.05),提示SIRT6参与了老年性耳聋发展的调控;而16月龄小鼠与D-半乳糖造模小鼠组间差异无统计学意义(P<0.05),同时随着年龄增长,SIRT6表达水平降低,这进一步提示SIRT6可能抑制及延缓老年性耳聋的发展。
miRNA是一类普遍存在于真核生物中非编码单链小分子RNA,长约21~25个核苷酸,在基因转录后水平发挥重要调控功能[13]。与细胞衰老相关的机制如线粒体突变、氧化应激、炎症、细胞凋亡等,几乎都与 miRNA 相关[14],对miRNA 功能的进一步研究有益于多种疾病机制的研究与诊疗。miRNA-34a可通过介导脑组织中的细胞凋亡因子干预细胞转录后生物过程,在大脑中的作用和活性受控制其表达(例如 Tp53/73)及其下游靶基因(例如SIRT1和SIRT6)和信号传导途径(例如Notch途径)所调控[15];Huang 等[16]研究miRNA-34a/Bcl-2 信号转导通路在AHL的作用,结果表明 miRNA-34a 的过表达可以抑制Bcl-2 表达,进而促进毛细胞的凋亡;相反,抑制 miRNA-34a 的表达可以减缓毛细胞凋亡。Thounaojam等[17]研究发现,用miR-34a抑制剂(IB)转染细胞可阻止HG诱导的线粒体功能障碍和衰老相关标志物的上调,而miR-34a模拟物可促进细胞衰老和线粒体功能障碍;这些都进一步证实miRNA-34a 可促进细胞衰老。本研究结果表明,随着月龄增长,小鼠耳蜗 miRNA-34a-5p表达水平随着年龄增加而增加,两两间差异均有统计学意义(P<0.05) 。其中D-半乳糖造模组与3、6月龄相比,差异均有统计学意义(P<0.05) ;与12、16月龄组比较,差异无统计学意义(P>0.05)。在老年性耳聋发病机制中,SIRT6 、miRNA-34a的作用罕见报道。本研究对miRNA-34a组与SIRT6在不同月龄C57BL/6小鼠及D-半乳糖造模小鼠耳蜗表达相关性研究表明,随着月龄增长, C57BL/6小鼠耳蜗中 miRNA-34a 水平升高、SIRT6水平降低,说明miRNA-34a促进老年性耳聋病理进程的发展,SIRT6为老年性耳聋发展进程中的保护因子,两者呈负相关,miRNA-34a与 SIRT6可能是治疗老年性聋的新靶点。其作用方式可能与DNA损伤修复、线粒体功能障碍等相关,如SIRT6可能通过调控miRNA-34a的表达,降低ROS的细胞内累积效应,同时修复损伤的mtDNA,从而起到抗衰老作用。但两者间具体的调控机制还需要进行深入研究。
