不同时期增生性瘢痕组织中巨噬细胞活化相关因子的研究
2022-03-17李镇江李书俊杨成兰聂开瑜
李镇江,李书俊,周 健,陈 伟,杨成兰,胡 鹏,聂开瑜
(遵义医科大学附属医院 烧伤整形外科,贵州 遵义 563099)
增生性瘢痕是创面愈合的结果之一,也是人类真皮特有疾病,能引起程度不等的外形损害和功能障碍,给患者身心健康带来巨大伤害,因此一直是整形外科研究领域的热点及难点。创面愈合的过程是多种类型细胞、细胞因子及细胞外基质(Extracellular matrix,ECM)共同参与并相互作用的动态复杂过程。增生性瘢痕的实质是以纤维结缔组织过度增殖,ECM异常沉积、排列杂乱无序为特征的纤维代谢异常性疾病[1-2]。
炎症期是创面愈合过程的起始阶段,炎症反应对创面愈合的结局起着重要的调控作用。过度的炎症反应不仅与创面愈合不良有关,还会引起ECM异常堆积导致病理性瘢痕形成[3]。而在众多免疫细胞中,巨噬细胞扮演着极其重要的角色[4]。巨噬细胞通过分泌相关炎症因子,如bFGF、IL-12、IL-10、IL-9、IL-1β、TGF-β、IL-6和VEGF等在愈合过程中发挥免疫应答和炎症调控的作用[5-6]。但是,巨噬细胞的活化及其活化后的不同亚型,对巨噬细胞的功能发挥及创面愈合的结果产生直接影响[7]。根据巨噬细胞活化的具体激发通路以及活化后其表型和功能的不同,将其分为M1型巨噬细胞和M2型巨噬细胞;又根据其在创面愈合中的主要功能不同,M1型巨噬细胞又称为为促炎表型巨噬细胞,而M2型则为抗炎表型或免疫调节型巨噬细胞[8-10]。IL-10和IL-12作为巨噬细胞相关标志性炎症因子,其相对表达量能够作为巨噬细胞活化后的不同亚型的定义特征[11]。前者主要由M2型巨噬细胞分泌,主要发挥抗炎作用;后者主要由M1型巨噬细胞分泌,主要发挥促炎作用[12]。众所周知,增生性瘢痕组织中存在长期炎症反应,且在临床表现上存在明显增生期、减退期和成熟期。因此,巨噬细胞活化的过程是否参与并影响了增生性瘢痕的形成及临床转归,值得研究。
本研究通过对临床上不同时期增生性瘢痕组织标本中M1型、M2型巨噬细胞相关标志性炎症因子IL-10和IL-12的研究,通过对比其是否存在差异,从而揭示其与瘢痕形成之间可能存在的联系。
1 材料与方法
1.1 样本来源 自2018年7月至2020年7月本课题组收集增生性瘢痕手术切除后的瘢痕组织标本,满足本研究纳入标准共计31例,术前均取得患者的知情同意,并签署相关同意书。
1.2 实验分组 根据“温哥华瘢痕评估量表”中的色泽、厚度、血管分布、柔软度的描述,再结合瘢痕形成的具体时间和瘢痕的临床症状,将瘢痕组织分为A组(增生期)和B组(减退期)。纳入标椎:A组:色泽(3分)、厚度(2~3分)、血管分布(3分)、柔软度(2~3分)B组:色泽(2分)、厚度(2~3分)、血管分布(2分)、柔软度(2~3分)。经统计,A组瘢痕形成时间为(86±11)天,B组瘢痕形成时间为(192±14)天。
1.3 样本预处理 除了正常术后送相关病理检查的标本之外,剩下的标本均经无菌取材并过无菌生理盐水清洗,然后去除皮下组织和边缘正常皮肤组织,最终留取1.0 g,做好标记,-80 ℃冰箱冻存备用。
1.4 试剂及仪器 OMNI BEAD RUPTOR 24多样品珠式研磨均质仪,1.4 mm直径陶瓷珠,1 mL研磨管,Odyssey®激光检测成像系统(美国LI-COR®Biosciences公司),BioTek 酶联免疫分析仪,BCA蛋白定量试剂盒(美国BIO-RAD Laboratories公司),人炎症相关因子抗体阵列印记膜检测试剂盒(Human inflammatory cytokine Array C1000,RayBiotech公司),IL-10、IL-12 ELISA检测试剂盒(IL-10,IL-12 p40 Human ELISA Kit,Thermo Fisher公司)。
1.5 样本蛋白提取 将增生性瘢痕组织标本置于冰盒上,先使用眼科剪将标本剪成约2 mm×2 mm大小,每份标本分别称取0.5 g,加1 mL PBS液,接着将混合物置于研磨管,研磨管内放入3颗研磨珠,上研磨均质仪,以8 m/s的速度的研磨60 s;将研磨后最终获得的组织匀浆,以离心10 min(离心力为10 000 g),最后取离心后的上清液-80 ℃冷冻保存备用。
1.6 总蛋白浓度测定 按照BCA试剂盒内原配的标准蛋白样品,经过稀释后,配制成浓度为1.0 mg/mL标准蛋白溶液,然后分别配制浓度为0、1.0、5.0、10.0、20.0 mg/mL的标准梯度蛋白样本;在将上述步骤所获得的蛋白样品稀释至合适浓度。分别将标准梯度蛋白样本和我们需检测的蛋白样本,依次加入96孔比色板内,随后加入试剂盒中的BCA工作液,常温静置10 min后上酶标仪,在595 nm波长下进行比色测定,记录各孔OD值。以标准品蛋白含量为横坐标,OD值为纵坐标,绘制出标准曲线;将所测样品的OD值带入标准曲线中,得到样本相应的蛋白含量,最后根据具体稀释倍数计算出所测样本的实际总蛋白浓度。
1.7 相关炎症因子bFGF、IL-12、IL-10、IL-9、IL-1β、TGF-β、IL-6、VEGF表达的检测 (抗体阵列印记膜法)根据检测试剂盒说明书提供的信息,确定所检测样本中的总蛋白合适浓度范围,并根据上述测得的不同组样本总蛋白浓度调整试剂盒所测的样本的总蛋白量为一致,然后将试剂盒中的抗体阵列印记膜经过预处理液处理后,分别加入样本后使用摇床(60 r/min)4 ℃下孵育12 h;去除样本后Ⅰ、Ⅱ型清洗液先后分别清洗3次,每次不少于5 min,然后加入试剂盒抗体Ⅰ,常温孵育1 h,再次Ⅰ、Ⅱ型清洗液先后分别清洗3次,随后加入试剂盒内专用荧光显色剂,常温孵育45 min,最后加入终止液终止。将印记膜置于Odyssey双红外激光成像系统下检测,并获得图像,使用成像系统自带的图像分析软件,测得抗体阵列印记膜上的标准参照点数值和每一组发生反应的特定因子的反应点的数值,并将该数值比上标准参照点数值的平均值,便获得该因子的最终表达的定量数值,记录数据。
1.8 IL-10、IL-12的检测(ELISA法) 因抗体阵列印记膜法同时检测数十个炎症相关因子的表达,可能存在在同一反应体系下,印记膜上的抗体存在捕获蛋白能力的随机性差异。为增加结果的可信度,我们常规采用ELISA重复检测关键炎症因子表达。将试剂盒内所携带的标准蛋白因子试剂,按照说明书的方法加入试剂盒的96孔板中,形成梯度的浓度差,是为标准曲线孔;然后根据检测试剂盒说明书提供的信息,确定所检测样本中的总蛋白合适浓度范围,并根据上述测得的不同组样本总蛋白浓度调整试剂盒所测的样本的总蛋白量为一致后将样品添加到孔中,透明膜封板后37 ℃条件下孵育15 h,按说明书配制好洗涤液洗涤微孔板,加入检测抗体,常温孵育60 min,再次洗涤微孔板后添加底物,常温避光孵育15 min,待微孔板内液体颜色由淡蓝色变为肉眼可见后黄色或淡黄色,加入终止液,终止反应;上BioTek 酶联免疫分析仪检测并输出光密度 (OD) 值;根据标准孔的OD值为纵坐标,标准孔的蛋白因子含量为横坐标,绘制标准曲线,根据标准曲线得到样本中的蛋白因子含量值,记录数据。

2 结果
2.1 抗体阵列炎症相关因子检测结果 IL-10和IL-12的相对表达是M1型和M2型巨噬细胞的定义特征,M2型巨噬细胞产生高水平的IL-10和低水平的IL-12。相反,M1型巨噬细胞产生大量的IL-12和最少的IL-10。故A、B两组的IL-10和IL-12表达差异能反映组织的瘢痕炎症情况。与B组比较,A组中IL-12、IL-6、TGF-β的表达量均明显升高(P<0.05),而IL-10的表达量则明显降低(P<0.05,见图1、表1)。

A:增生期增生性瘢痕组织;B:减退期增生性瘢痕组织;1:bFGF;2:IL-12;3:IL-10;4:IL-9;5:IL-1β;6:TGF-β;7-IL-6;8:VEGF;pos:阳性内参。图1 抗体阵列印记膜检测增生性瘢痕组织中炎症因子的表达谱
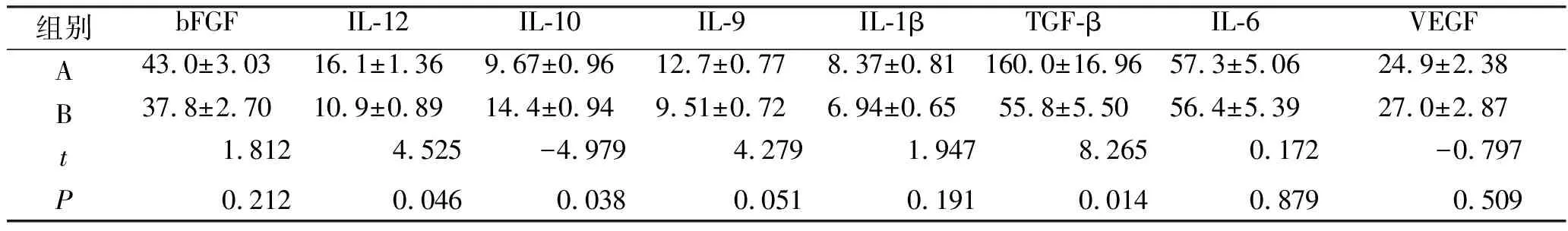
表1 经Odyssey® Infrared Imaging System分析后各炎症因子表达的定量比较
2.2 ELISA相关炎症因子检测结果 IL-10,IL-12 ELISA检测结果 同抗体阵列检测结果一致,与B组比较,A组中IL-12的表达量明显升高(P<0.05),而IL-10的表达量则明显降低(P<0.05),并且IL-10表达量在前二者总表达量中所占的比值也明显降低(P<0.05,见表2)。
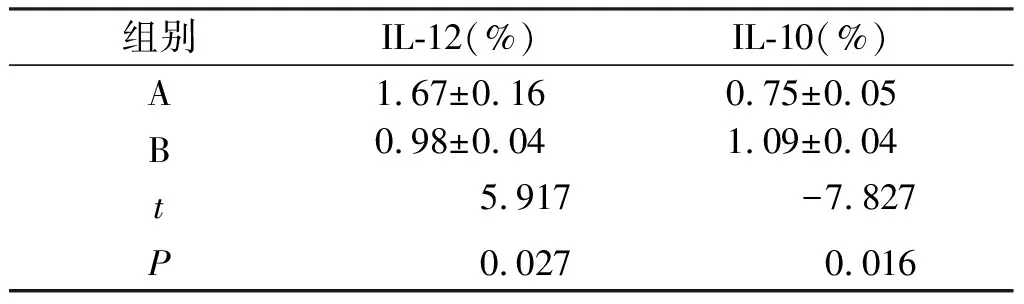
表2 特异性因子IL-12、IL-10在总蛋白中所占比例的比较
3 讨论
以往的关于增生性瘢痕形成机制的研究往往集中于对异质性的成纤维细胞及其相关分子机制的研究[13]。但目前的研究表明,为中和或平衡真皮组织严重受损后引起的强烈炎症反应,组织发生以胶原纤维为代表的ECM的过度堆积,最终形成增生性瘢痕。因此,持续的炎症反应可能是病理性瘢痕形成的重要机制之一。巨噬细胞作为创面愈合中免疫应答和炎症调控的关键细胞,可能在增生性瘢痕的形成过程中发挥重要作用。
IL-10和IL-12是组织损伤后炎症反应的两种主要巨噬细胞衍生介质,分别发挥抗炎和促炎功能[14]。他们的相对表达量能够作为M1型和M2型巨噬细胞的定义特征[11]。M1型通过释放高水平的IL-12激活创面局部炎症反应,从而清除病原体、坏死细胞及组织碎片;而M2型巨噬细胞释放的IL-10能够削弱创面炎症反应并募集成纤维细胞、血管内皮细胞、上皮细胞等促进创面局部组织的重塑与修复[12]。除此之外,在一项基于IL-10基因敲除小鼠的研究中,胎鼠皮肤伤口出现了明显的胶原异常沉积,待小鼠出生后,伤口局部组织中更是出现了过度的炎症反应和大量巨噬细胞浸润[15]。因此IL-10的表达高低,以及IL-12与IL-10之间表达的相对比值的高低,可作为M1型巨噬细胞是否向M2型巨噬细胞自然转化发生的标志之一。本研究发现,与瘢痕增生减退的增生性瘢痕组织相比,瘢痕增生活跃的增生性瘢痕组织中抗炎因子IL-10的表达明显更低,而促炎因子IL-12和IL-6与促纤维化因子TGF-β的表达明显更高,说明了在典型的增生期的瘢痕组织中仍然存在较为强烈的炎症反应。通过比较两组瘢痕组织中IL-10在同时期IL-10和IL-12中所占的比值,我们发现与A组相比,B组IL-10在同时期IL-10和IL-12中所占的比值明显更高,这说明了临床上表现为减退期的增生性瘢痕可能已完成了M1型巨噬细胞向M2型巨噬细胞的转化过程,这也同增生性瘢痕增生期和减退期不同的炎症样临床表现特点相一致,即增生期瘢痕可见扩张的紫红色血管,瘙痒、疼痛等炎症样症状明显;减退期瘢痕逐渐变平变软,扩张血管减少或消失,瘙痒、疼痛等炎症样症状明显减轻[16-17]。
综上所述,巨噬细胞的活化程度可以作为确定增生性瘢痕具体临床时期的分子标志之一。如何抑制M1型巨噬细胞的持续活化,使M2型巨噬细胞活化占据主导地位,从而在创面愈合后增生性瘢痕形成过程中,让其更加接近正常创面愈合过程中M1型和M2型巨噬细胞活化的时相过渡,可能成为基于巨噬细胞为出发点的增生性瘢痕机制研究的新方向。
