胺碘酮对非瓣膜性房颤复律后窦律维持患者肿瘤风险的相关性研究
2022-03-17蓝晓红周永刚东部战区总医院江苏南京000南京医科大学第一附属医院江苏南京009
蓝晓红,杨 艳,周永刚,许 诺,邹 颖(.东部战区总医院,江苏 南京 000;.南京医科大学第一附属医院,江苏 南京 009)
胺碘酮是FDA于1985年批准用于治疗快速性心律失常的药物,临床主要用于复发或顽固性术后房颤患者。2012年欧洲心脏病学会房颤指南将胺碘酮作为Ⅱa类证据推荐,其给药剂量和方法虽在指南中有明确建议,但考虑到该药是脂溶性药物,消除半衰期长达53 d,长期用药可积聚在软组织中,增加药品不良反应(adverse drug reaction,ADR)的发生。胺碘酮所致ADR累及多个系统/器官,FDA报告了胺碘酮治疗后可能有潜在增加肺癌、甲状腺癌、皮肤癌的风险[1-3]。这些ADR给临床确定胺碘酮的给药剂量、制定给药方案带来困惑,如何权衡胺碘酮治疗中的效益-风险比仍是临床关注的热点。非瓣膜性房颤复律后胺碘酮治疗维持窦律患者的疗效与肿瘤风险目前尚不明确。笔者就上述问题开展研究,以期为临床合理使用胺碘酮提供依据。
1 资料和方法
1.1 资料来源
利用PASS系统,收集南京地区东部战区总医院秦淮医疗区、南京医科大学第一附属医院两家三甲医院2001年1月–2010年12月服用胺碘酮片治疗超过30 d的患者,合并疾病主要包括糖尿病、肝硬化、慢性阻塞性肺疾病、慢性肾病、心力衰竭、高血压、心律失常、甲状腺功能亢进、甲状腺功能减退。采用回顾性队列研究,研究终点为肿瘤的发生。纳入通过随访登记和肿瘤病理报告、诊断证明确诊肿瘤的患者。接受胺碘酮治疗的患者随访至肿瘤发生、死亡或至2017年9月。排除年龄<30岁,或在服药前已被诊断为恶性肿瘤的患者。标准化发病率=胺碘酮治疗患者中肿瘤实际发生人数/预期发生人数×100%,肿瘤预期发生人数=入组胺碘酮治疗的患者人数×按照年龄划分特定部位肿瘤发病率。肿瘤在人群中的发病率来源于文献数据[4],本研究符合我院伦理委员会的相关规定(81YY-KYLL-16-07)。
1.2 数据处理
胺碘酮对非瓣膜性房颤复律后窦律维持患者肿瘤发生的风险采用标准化发病率(standard incidence ratio,SIR)计算,其为观察到的肿瘤患者例数/预期肿瘤患者例数。预期肿瘤患者例数=胺碘酮治疗患者例数×肿瘤发病率[5]。假设观察到的肿瘤数量遵循Poisson分布,为避免入组设计的偏倚导致胺碘酮治疗后第一年肿瘤发生风险增加最多,将SIR的亚组按年龄分为30~59岁、60~79岁和≥80岁三组;按入组时间分为0~1年、1~5年、5年三个亚组,确定胺碘酮治疗是否与特定类型的肿瘤发病率相关;对胺碘酮治疗后不同部位肿瘤的SIR进行统计分析。
研究[5]表明从肿瘤暴露至发展为有临床意义,至少有2年的潜伏期。故笔者计算了非瓣膜性房颤患者使用胺碘酮治疗第1年的累积日剂量(cumulative defined daily dose,cDDD),3年后评估高剂量(cDDDs>180)和低剂量(cDDDs≤180)胺碘酮治疗与特定部位的肿瘤发生是否存在剂量-效应关系。采用单变量与多变量的Cox模型分析胺碘酮cDDDs与肿瘤的关系,确定胺碘酮治疗后肿瘤风险的预测因子。为避免偏倚,将随访时间<1年的患者排除在生存分析之外。胺碘酮治疗的患者按cDDDs分为高(>180)、中(90~180)、低(≤90)剂量组,采用Kaplan-Meier分析和对数秩检验评估时间趋势和低、中、高累积剂量和肿瘤风险的关系。实验数据采用SPSS 19.0进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
研究共纳入998例患者,女性571例(57.21%),男性427例(42.79%)。总体中位随访时间为1.85(0.64,4.25)年,其中男性患者为1.92(0.71,4.36)年,女性患者为1.78(0.69,4.18)年。确诊时患者年龄中位数为70岁。患者一般资料见表1。

表1 患者一般资料Tab 1 General information of patients
2.2 性别与肿瘤风险的相关性
随访期内,有44例患者发展为恶性肿瘤,同健康人群相比风险略增高,男性患者接受胺碘酮治疗后肿瘤患病风险显著增加(P=0.035),而女性患者肿瘤患病率未见明显增加(P>0.05)。
2.3 年龄、cDDD与肿瘤风险的相关性
分析结果显示,与健康人群相比,年龄30~59岁、≥80岁的男性用药患者患肿瘤的风险明显增加(P=0.025,P=0.019),其余年龄段患者肿瘤风险未见明显增加。结果显示在胺碘酮治疗的第1年患者肿瘤风险明显增加(P=0.001 9);治疗≥1年的患者肿瘤风险未见明显增加。纳入患者入组3年后,研究结果显示高剂量给药组、男性患者肿瘤发生风险显著增加(P=0.05,P=0.006)。年龄、性别、治疗持续时间对患者肿瘤标准化发病率的影响见表2。
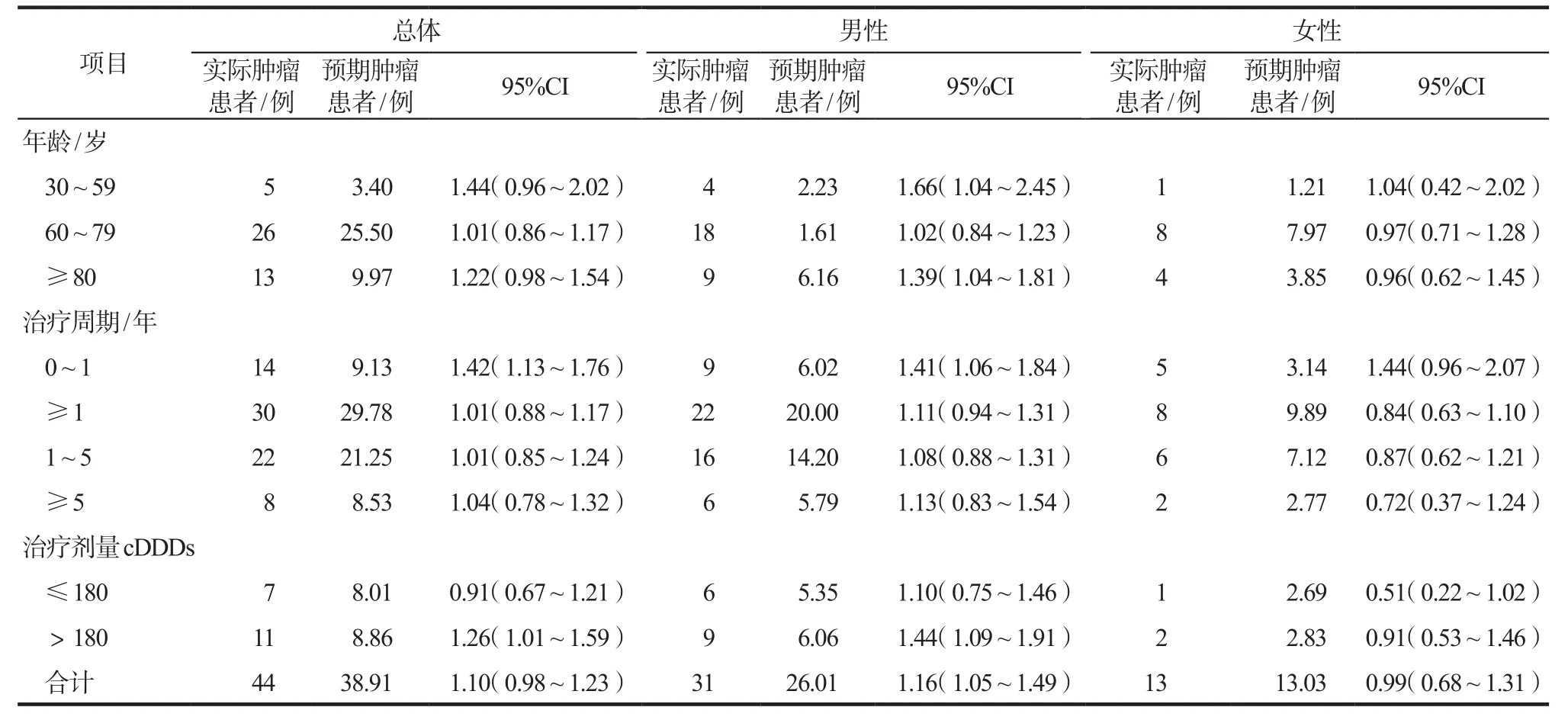
表2 年龄、给药剂量、治疗持续时间对患者肿瘤SIR的影响Tab 2 Effect of age,dosage and course of treatment on SIR of cancer
2.4 肿瘤部位与肿瘤风险的关系
胺碘酮治疗后44例患者发生肿瘤,特定类型肿瘤发生率无显著性差异(P>0.05),见表3。

表3 肿瘤部位对患者肿瘤SIR的影响Tab 3 Effect of tumor location on SIR of cancer
2.5 内部因素与肿瘤风险的关系
多因素分析结果显示,年龄、男性、肝硬化是非瓣膜性房颤患者使用胺碘酮治疗后肿瘤发生风险的重要影响因子,详见表4。
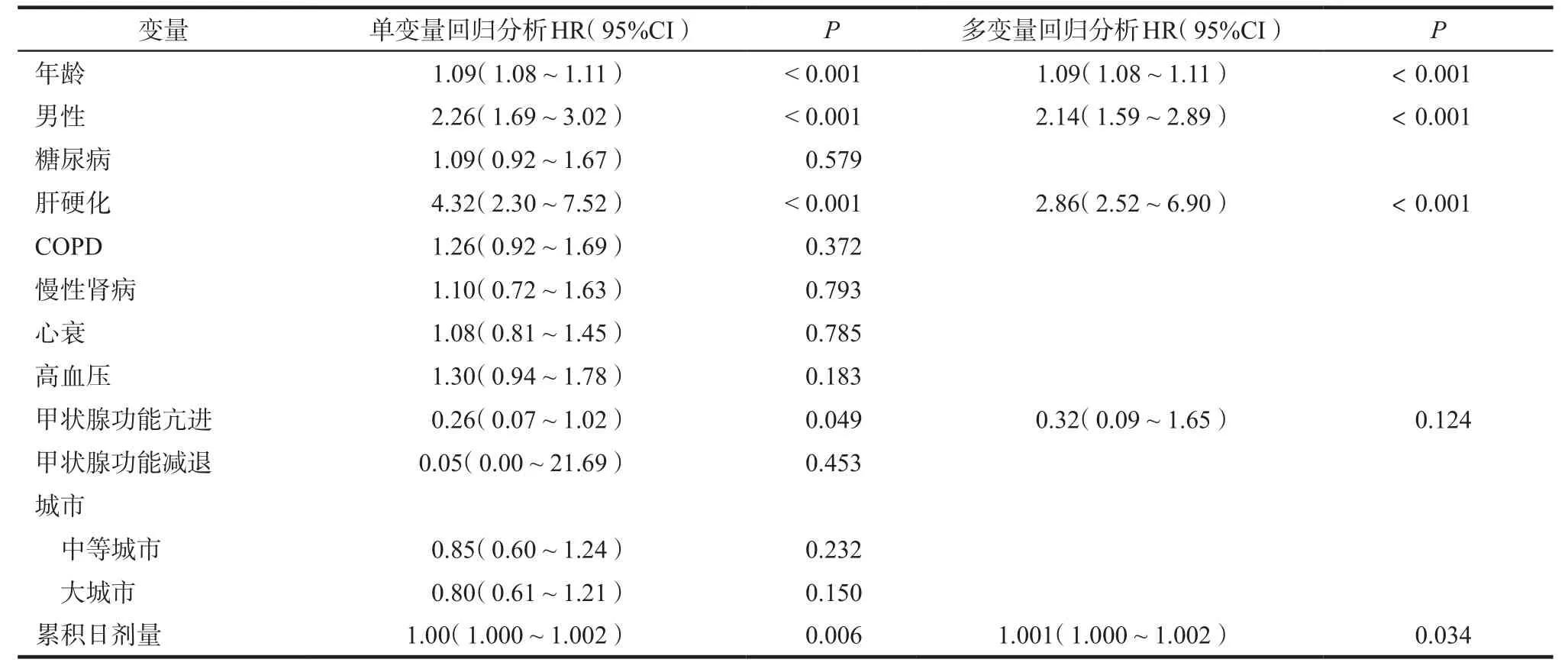
表4 潜在危险因素对患者肿瘤风险的影响Tab 4 Potential risk factors of tumor in patients
在该研究的多变量分析中,不同cDDDs所代表协变量应用于模型,采用风险比(hazard ratio,HR)评估其他变量对胺碘酮治疗后肿瘤风险的影响。若cDDDs>180替代cDDDs ≤180,或cDDDs>90替代cDDDs≤90,调整后的胺碘酮治疗患者发生肿瘤HR分别为1.46(P=0.047)和1.89(P=0.009)。当cDDDs被分为低、中、高剂量组,33.3%患者的cDDDs为90,66.7%患者cDDDs为180。低剂量和中高剂量组肿瘤HR分别为1.78(95%CI:1.05~2.96,P=0.039)和1.98(95%CI:1.22~3.22,P=0.006)。采用Kaplan Meier分析表明,排除第1年内肿瘤的发生,给予低剂量(cDDDs ≤90)、中剂量(cDDDs 90~180)、高剂量(cDDDs ≥180)胺碘酮治疗的患者,肿瘤发生率与平均日剂量相比有显著差别(对数秩检验P=0.003 7)。在低、中、高剂量cDDD组患者累积cDDD值分别为1326、1326、1325,总体肿瘤的发生数量分别为 8、11、25例。中剂量组和高剂量组之间服用胺碘酮患者致肿瘤风险无显著性差异(P=0.579)。
3 讨论
本研究阐明了非瓣膜性房颤患者服用胺碘酮长期治疗与肿瘤风险的相关性。首先,研究结果显示随访1年后,男性和胺碘酮cDDDs>180的患者标准化肿瘤发生风险明显增加。多变量Cox回归模型显示:应用中高剂量与低剂量胺碘酮治疗患者相比标准化肿瘤发生风险明显增加。其次,证实了累积日剂量与胺碘酮致肿瘤风险可能相关。研究显示,规律服用胺碘酮后2~5年的患者发生肿瘤的风险明显增加[6],表明潜伏期与高累积日剂量是胺碘酮发展为恶性肿瘤的必要条件。但低、中、高胺碘酮cDDD值治疗的患者发展为肿瘤的风险明显不同。体外研究发现:胺碘酮治疗后晚期肺巨噬细胞中肿瘤坏死因子mRNA表达增多[6]。我们通过外部因素SIR和内部因素多变量回归模型分析胺碘酮的剂量效应发现:与普通人群相比,胺碘酮cDDDs>180时肿瘤发病率显著增加。当cDDDs分为低、中、高3种剂量临界点治疗时,最高剂量与最低剂量胺碘酮治疗的患者,肿瘤发病率相差近2倍。最后,本研究证明了性别与患者胺碘酮治疗后肿瘤风险可能相关。男性患者的肿瘤风险明显增加,这可能与女性患者对胺碘酮的清除率高于男性、肝药酶活性和脂肪组织的百分比有关;可能还与激素刺激在性别中的差异有关。本研究发现:治疗偏倚可引起胺碘酮治疗1年内肿瘤风险增加,需提供心律失常病因评估和胺碘酮毒性相关指标的监测。对于长期服用胺碘酮治疗的患者,临床需加强用药监管与随访。临床药师需告知患者定期监测心电图、肺功能、胸部X光片、肝功能、甲状腺功能、电解质和眼底病变等指标。肿瘤指标应每年监测1次,本研究中胺碘酮治疗后随访1年内肿瘤发病率有增加的趋势。
本研究也存在一些局限性,60岁以上的高龄患者757例(75.85%),合并基础疾病较多,联合用药品种较多;潜在危险因素(肥胖、吸烟、饮酒、环境暴露、肿瘤家族史)较多。若上述有意义的混杂因素在不同剂量组患者中不均匀分布,可能导致肿瘤风险增加。本研究中死亡率较高患者的胺碘酮中位治疗时间为2.57年,而治疗时间太短无法监测到肿瘤的发生;为了避免治疗时间偏差,笔者仅在胺碘酮治疗第1年计算cDDDs值。因此,不可避免地存在患者肿瘤风险偏差。但有研究[7-8]显示未发现胺碘酮累积剂量与肿瘤发病风险之间的关系。也有体外动物实验研究[9]表明低剂量胺碘酮可减少肿瘤生长和血管生成。可能胺碘酮在不同种族之间的肿瘤风险存在异质性,故仍有待扩大样本量进行更深入的研究。
综上所述,在胺碘酮治疗非瓣膜性房颤患者中,男性存在高肿瘤风险。胺碘酮与肿瘤的发生存在剂量-效应关系。虽胺碘酮作为致癌物的证据较弱,但其每天增加1个额外剂量HR为1.001,值得更多关注。临床药师建议在临床治疗中对服用胺碘酮治疗的患者应重点加强上述相关指标的定期监测和肿瘤不良事件的随访登记。
