不同浓度芦丁和冷冻速率对猪精子冷冻保存效果的研究
2022-03-17董瑞兰刘浩域柳小斌于光辉
罗 兰,崔 超,董瑞兰,刘浩域,柳小斌,于光辉
(1.青岛农业大学动物科技学院,青岛 266109;2.胶州市农业农村局,胶州 266300)
精液冷冻技术是一种常见的辅助生殖技术,可以在很长一段时间内保护有价值的遗传资源,建立和增强保种场间遗传联系和跨群联系,提高优良种源的利用效率[1]。随着猪冷冻精液生产技术的不断完善,采用冷冻精液繁育的种猪在受孕率和仔猪分娩数方面均得到了有效提高,已经接近鲜精的配种水平[2]。尤其是在非洲猪瘟疫情的影响下,跨地引种风险较高,冷冻精液更是解决这一问题最有效的途径。在猪精液冷冻过程中,抗氧化剂一直是研究热点,这是由于精子冷冻过程会损害精子线粒体功能并刺激精子产生过量的活性氧(ROS)[3]。过量的ROS会消耗精子的抗氧化防御系统,使精子进入氧化应激状态,并产生大量丙二醛(MDA),将精子DNA碱基或共价氢键氧化为DNA单碱基,导致DNA双链断裂,细胞凋亡[4]。近年来,一些天然多酚类抗氧化物以其高抗氧化性和低毒性被广泛运用于精液冷冻保存研究中[5]。
芦丁是一种非黄酮类的多酚类化合物,也称为维生素P,在柑橘类水果中大量存在,其以心脏保护[6]、抗炎[7]及抗氧化[8]等功能被运用于各类研究中。Xu等[9]研究表明,芦丁通过增强抗氧化作用来保护公猪精子免受冷冻损伤,并且在冷冻稀释液中添加0.4和0.6 mmol/L的芦丁效果最佳。吴琳[10]研究发现,在猪精子冷冻稀释液中添加0.6 mmol/L芦丁可以显著改善解冻后精子运动能力,提高精子的生理功能,并且还能显著提高总有效受精率。芦丁作为一种有效的抗氧化剂,对哺乳动物精子的影响研究还比较少,特别是对于冷冻-解冻的精子。喻宗岗等[11]在液氮面上1 cm处(高冷冻速率)或3 cm处(低冷冻速率)冷冻鸡精子,结果表明,高冷冻速率下的鸡精子冻后脂质过氧化水平显著低于低冷冻速率,但冻后精子活力和线粒体膜电位水平差异不显著。本研究拟在猪冷冻稀释液中添加不同浓度芦丁后,在不同冷冻速率下进行精液超低温保存,通过检测解冻后精子的品质来判断添加芦丁及冷冻速率对猪精液冷冻的影响,以及芦丁与不同冷冻速率的互作关系,以期为猪精液超低温冷冻保存研究提供依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 葡萄糖、柠檬酸三钠、柠檬酸、碳酸氢钠、EDTA-2Na、Tris、青霉素钠、硫酸链霉素等均购自国药集团;细胞凋亡试剂盒(Annexin V-FITC/PI)、MDA、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、ATP含量等检测试剂盒均购自南京建成生物科技有限公司;ROS、ATP、JC-1等检测试剂盒均购自上海碧云天生物技术有限公司;芦丁、SYBR Green Ⅰ、PI染液、AO染色试剂盒、台盼蓝染液、DCFH-DA 活性氧ROS荧光探针等均购自北京索莱宝生物科技有限公司;OEP购自米尼图公司;封口粉和0.5 mL冻精细管均购自卡苏公司。
1.1.2 主要仪器 冷冻离心机(D-37520,Thermo)、移液枪、液氮罐、恒温箱、光学显微镜(CX21,Olympus)、正置荧光显微镜(BX63,Olympus)、水浴锅、pH计(FE20-K,梅特勒)、高压灭菌锅、冰箱、酶标仪(RZ-9618,天津瑞泽)、化学发光检测仪(GloMax 20/20,Promega)、计算机辅助精子分析系统(CASAS-QH-Ⅲ)等。
1.2 方法
1.2.1 稀释液配制 基础稀释液:称取葡萄糖2.750 g、柠檬酸三钠0.690 g、柠檬酸0.290 g、碳酸氢钠0.125 g、EDTA-2Na 0.235 g、Tris 0.565 g、青霉素钠1 000 IU/mL、硫酸链霉素0.100 g,用灭菌超纯水定容至100 mL,调整pH为7.2,用0.22 μm滤膜过滤后置于4 ℃保存备用。冷冻稀释液(Ⅰ液):乳糖溶液80%、卵黄20%;冷冻稀释液(Ⅱ液):95.5%的Ⅰ液、3%甘油、1.5% OEP,4 ℃保存备用。
1.2.2 精液采集 精液采自山东省平度市环山托佩克种猪场8头体况良好、性欲旺盛且繁殖性能好的杜洛克种公猪。采用手握法采集中段精液并用双层纱布过滤,将过滤后的8头种猪精液混合均匀,以消除个体差异。每周采集精液1次,经常规检测后活力达0.8以上,密度为2.5×1012/mL方可使用,鲜精运输前用基础稀释液1∶1稀释,于2 h内17 ℃恒温箱保存送回实验室。
1.2.3 精液冷冻、解冻 采用两步法进行精液冷冻,对照组不添加芦丁(0 mmol/L),试验组在Ⅱ液中分别添加0.2、0.4、0.6、0.8和1.0 mmol/L芦丁,所有组均分别进行快冷冻和快冷冻,每组3个重复。快冷冻所用泡沫细管托架高度为1 cm,慢冷冻所用泡沫细管托架高度为3 cm。将精液用蒸馏水按1∶100的比例稀释后用血细胞计数板计数,计算精子密度。将精液与17 ℃保存过夜的基础稀释液按1∶1等比例混合后置于17 ℃恒温箱平衡2 h,之后在预冷的17 ℃离心机中800×g离心10 min,弃上清。将沉淀与Ⅰ液按1∶1稀释,并用移液枪吹打混匀,离心管用6~8层纱布包裹并放入4 ℃平衡约1.5 h,使之缓慢降温至4 ℃。平衡结束后按1∶1加入Ⅱ液稀释,使终浓度为5×108/mL精子,再放入4 ℃平衡30 min。平衡后的样品需在4 ℃环境中快速用口吸法罐装进0.5 mL细管中,再用封口粉封口。准备2个泡沫箱,倒入2/3的液氮,放入快冷冻和慢冷冻细管托架,将细管平铺到细管托架上,保证每根细管相隔0.5 cm,使其更能充分熏蒸,盖上盖子熏蒸10 min后迅速将细管投入液氮内,浸泡30 min后,按组别分别装进拇指管内并装入纱布袋置于液氮罐中保存。解冻时将细管从液氮罐中取出,置于50 ℃水浴锅中解冻10 s,解冻的精液与解冻液1∶4混匀,于37 ℃水浴孵育10 min后进行检测。
1.3 检测指标
1.3.1 精子运动参数 采用计算机辅助精子分析系统(CASAS)进行精子活力检测,每组均需检测精子总活力(totalmotility,TM)、直线运动百分率(progressive motility,PM)、直线速度(straight-line velocity,VSL)、曲线速度(curvilinear velocity,VCL)、平均路径速度(average path velocity,VAP)值。将精子样品解冻后4 ℃、600×g离心3 min,弃上清,PBS重复清洗3次,再用PBS重悬,将血细胞计数板置于37 ℃载物台预热,再将精液样品缓慢注入,使之均匀流入整个计数室,每个样品观察5个视野,每个视野至少计数200个精子。
1.3.2 质膜完整率 采用SYBR-14/PI双染色法检测,将精液样品解冻后4 ℃、600×g离心3 min,弃上清,PBS重复清洗3次,再用PBS重悬,吸取100 μL精液放入1.5 mL离心管中,加入0.2 μL SYBR-14染色液,混匀,37 ℃避光染色5~10 min,再加入1 μL PI染色液,混匀,37 ℃避光染色5~10 min,吸取10 μL着色精液于荧光显微镜下进行检测,其中发红光的为PI染色的质膜损坏的死精子,发绿光的为SYBR-14染色的质膜完整的活精子。每个样品观察5个视野,每个视野至少计数200个精子。
质膜完整率(%)=绿色精子数/总计数精子数×100%
1.3.3 顶体完整率 采用异硫氰酸荧光素-花生凝集素(FITC-PNA)染色法检测,样品前处理同1.3.2,吸取10 μL精液于载玻片上,自然风干后用甲醇固定10 min,取20 μL FITC-PNA染液滴于样品上,覆盖样品,37 ℃避光染色30 min,再吸取20 μL DAPI染液滴于样品上,覆盖样品,室温染色10 min。随后用PBS冲洗3次,自然风干后用甘油密封,盖上盖玻片后在荧光显微镜下观察。其中顶体发明亮绿光的为顶体完整的精子,顶体不发光或发绿光不明亮的为顶体损坏的精子。每个样品观察5个视野,每个视野至少计数200个精子。
顶体完整率(%)=绿色精子数/总计数精子数×100%
1.3.4 线粒体膜电位 采用JC-1荧光探针法检测,样品前期处理同1.3.2,取0.1 mL JC-1工作液加入100 μL精液中,混匀,37 ℃孵育20 min,孵育后4 ℃、600×g离心3 min,弃上清,再用JC-1染色缓冲液重悬精子,随即在荧光显微镜下观察,其中头部发绿光尾部发橙光的为高MMP活精子,头部发红光尾部不发光或发绿光的为低MMP死精子,头部发红光尾部发橙光的为高MMP死精子。每个样品观察5个视野,每个视野至少计数200个精子。
线粒体膜电位(%)=尾部橙色精子数/总计数精子数×100%
1.3.5 DNA完整率 采用吖啶橙荧光染色标记法检测,样品前期处理同1.3.2,吸取5 μL AO染液加入95 μL 精液中,避光染色10 min,加入5 mL PBS,1 500 r/min离心5 min,弃上清,重复清洗2次后在荧光显微镜下观察,其中损伤的单链DNA发红色荧光,完整的双链DNA发绿色荧光。每个样品观察5个视野,每个视野至少计数200个精子。
DNA完整率(%)=绿色精子数/总计数精子数×100%
1.3.6 ROS水平 采用DCFH-DA荧光检测法,精子前处理同1.3.2,离心后的精子以DCFH-DA染液重悬,37 ℃避光水浴孵育30 min后在荧光显微镜下观察,其中绿色荧光强度与RDS的水平成正比,明亮绿色荧光为高水平ROS,淡绿色荧光为低水平ROS。每个样品观察5个视野,每个视野至少计数200个精子。
ROS水平(%)=淡绿色精子数/总计数精子数×100%
1.3.7 ATP含量 精液前期处理同1.3.2,将精液用PBS清洗重悬后用超声波细胞破碎仪破碎精子,吸取上清液,按照ATP检测试剂盒说明书处理,用化学发光检测仪进行检测,根据0.1、0.3、1.0、3.0和10 μmol/L这5个浓度梯度来绘制标准曲线,并根据标准曲线计算ATP含量。试验设置3个重复。
1.3.8 MDA水平及抗氧化酶活性 精液前期处理同1.3.2,精液用PBS清洗重悬后用超声波细胞破碎仪破碎精子,吸取上清液进行检测,CAT、SOD、GSH-Px活性和MDA含量严格按照试剂盒说明书进行处理,随即用酶标仪进行检测。每组重复检测3次。
1.4 数据统计分析
采用SPSS 22.0软件进行双因素方差分析,采用Duncan氏法进行多重比较,结果用平均值表示。P<0.05表示差异显著。
2 结 果
2.1 精子活力及运动参数检测结果
由表1可知,在冷冻稀释液中添加不同浓度的芦丁进行快冷冻后解冻,与对照组相比,0.4和0.6 mmol/L芦丁组总活力均显著提高(P<0.05),所有芦丁组直线运动百分率均显著提高(P<0.05),0.8和1.0 mmol/L芦丁组直线速度均显著提高(P<0.05),0.6和0.8 mmol/L芦丁组平均路径速度均显著提高(P<0.05),各组曲线速度均无显著差异(P>0.05)。在冷冻稀释液中添加不同浓度的芦丁进行慢冷冻后解冻,与对照组相比,除1.0 mmol/L芦丁组直线运动百分率和直线速度差异不显著外(P>0.05),其余各试验组各运动参数均显著提高(P<0.05),其中以0.6 mmol/L芦丁组提高最为显著(P<0.05)。互作结果显示,速率×浓度互作时差异显著(P<0.05),相较于不同的冷冻速率而言,慢冷冻各项运动参数均高于快冷冻,而且速率与浓度之间存在互作效应,在互作条件下,最适芦丁添加量为0.6 mmol/L。
2.2 精子质膜完整率、顶体完整率、线粒体膜电位、DNA完整率以及ROS水平检测结果
由表2可知,在冷冻稀释液中添加不同浓度的芦丁进行快冷冻后解冻,与对照组相比,0.6和0.8 mmol/L芦丁组顶体完整率、线粒体膜电位和DNA完整率均显著提高(P<0.05),0.6 mmol/L芦丁组ROS水平显著降低(P<0.05),0.8 mmol/L ROS水平显著提高(P<0.05),0.2和0.4 mmol/L芦丁组线粒体膜电位和DNA完整率也显著提高(P<0.05)。在冷冻稀释液中添加不同浓度的芦丁进行慢冷冻后解冻,与对照组相比,0.6、0.8和1.0 mmol/L芦丁组质膜完整率、顶体完整率、线粒体膜电位和DNA完整率均显著提高(P<0.05),ROS水平均显著降低(P<0.05),0.4 mmol/L芦丁组质膜完整率、顶体完整率和线粒体膜电位均显著提高(P<0.05),0.2 mmol/L芦丁组质膜完整率和线粒体膜电位均显著提高(P<0.05)。 互作分析显示,速率×浓度互作时差异显著(P<0.05),且在冷冻稀释液中添加不同浓度的芦丁慢冷冻组各项指标均显著好于快冷冻,且0.6 mmol/L芦丁效果最显著。
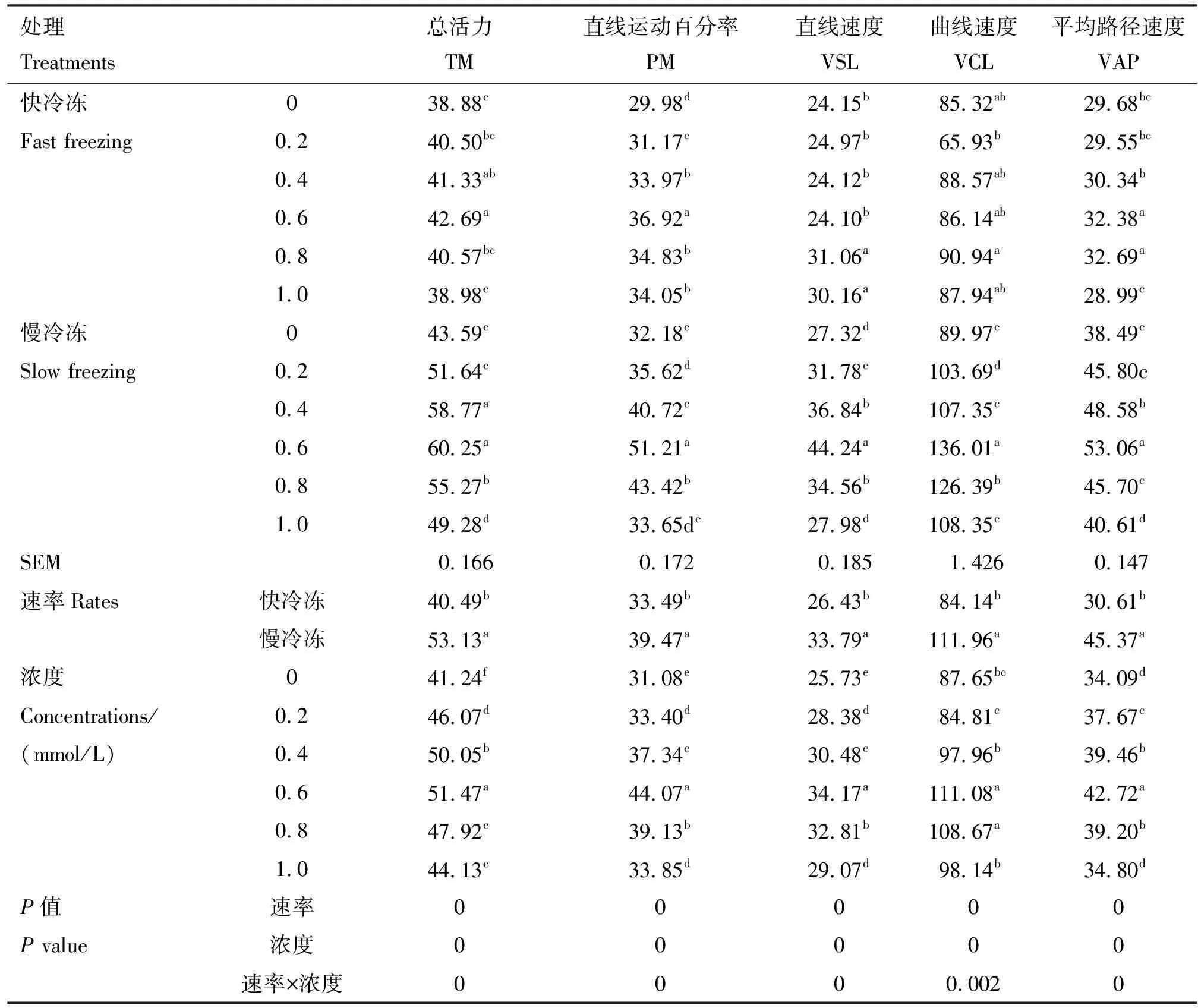
表1 各组精子活力及运动参数
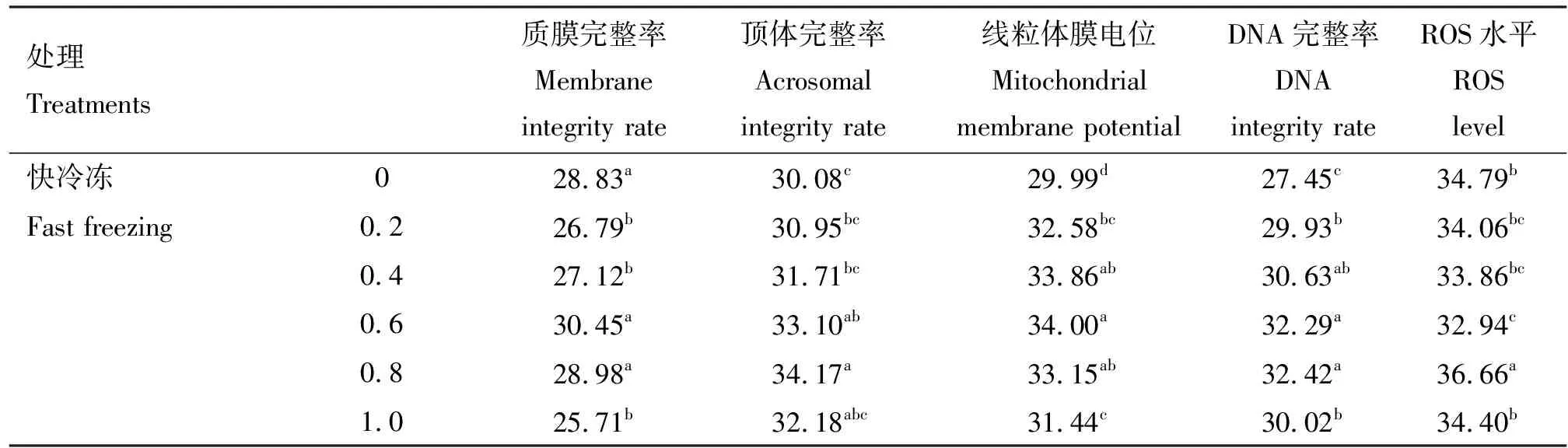
表2 各组精子质膜完整率、顶体完整率、线粒体膜电位、DNA完整率以及ROS水平
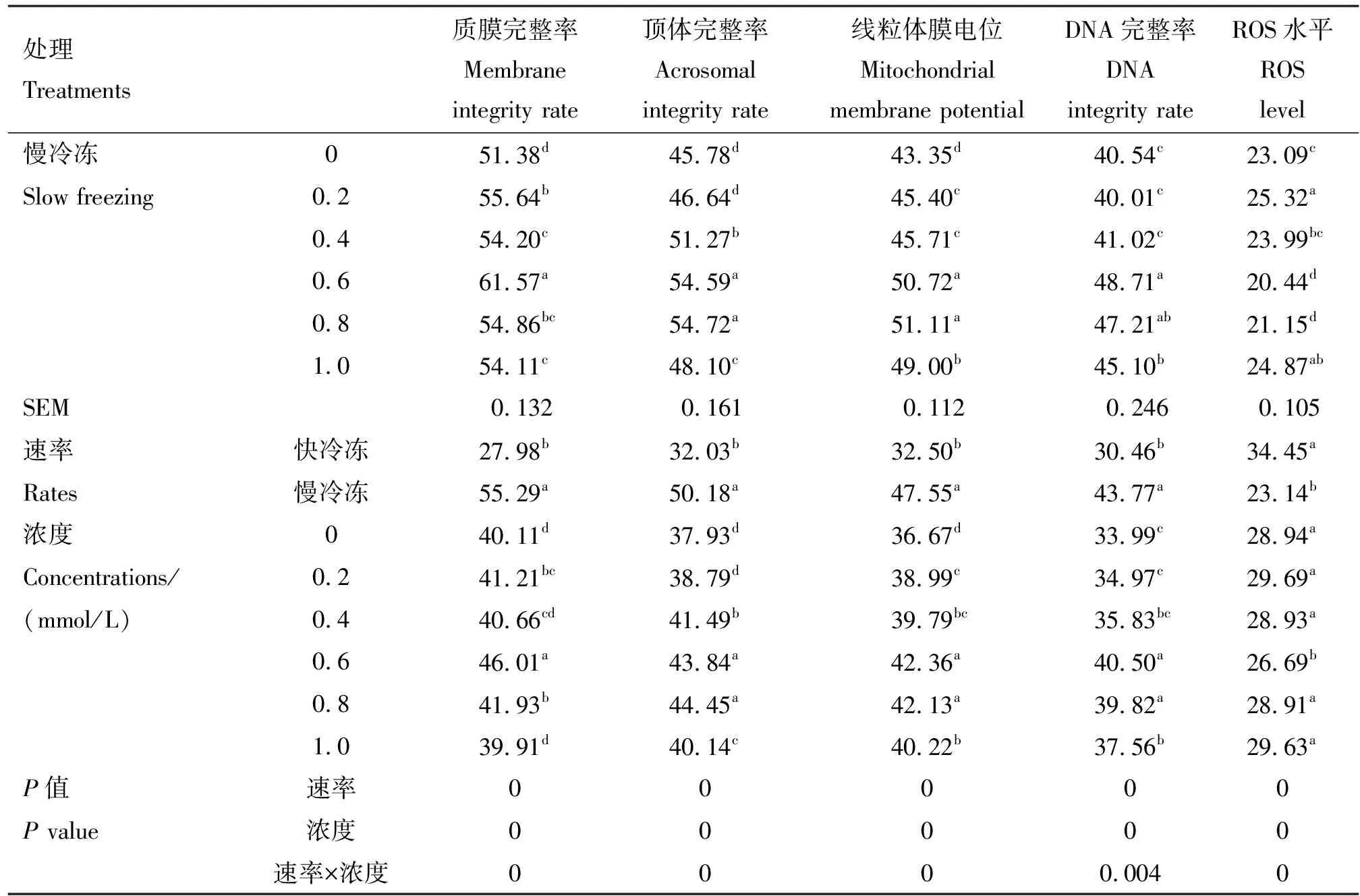
续表
2.3 精子ATP、MDA含量及SOD、CAT、GSH-Px活性的检测结果
由表3可知,在冷冻稀释液中添加不同浓度的芦丁快冷冻后解冻,与对照组相比,0.6 mmol/L芦丁组ATP含量、CAT和GSH-Px活性均显著提高(P<0.05),0.8 mmol/L芦丁组ATP含量和CAT活性均显著提高(P<0.05),0.2和0.4 mmol/L芦丁组CAT和GSH-Px活性均显著提高(P<0.05),各组MDA含量均无显著差异(P>0.05)。在冷冻稀释液中添加不同浓度的芦丁进行慢冷冻后解冻,与对照组相比,0.4和0.6 mmol/L芦丁组ATP含量、SOD和GSH-Px活性均显著提高(P<0.05),MDA含量显著下降(P<0.05);0.8 mmol/L芦丁组SOD和GSH-Px活性均显著提高(P<0.05),MDA含量显著下降(P<0.05);1.0 mmol/L芦丁组CAT和GSH-Px活性均显著提高(P<0.05)。互作结果显示,速率×浓度互作时差异显著(P<0.05),且在冷冻稀释液中添加不同浓度的芦丁慢冷冻组各项指标均显著好于快冷冻,互作条件下,最适芦丁添加量为0.6 mmol/L。
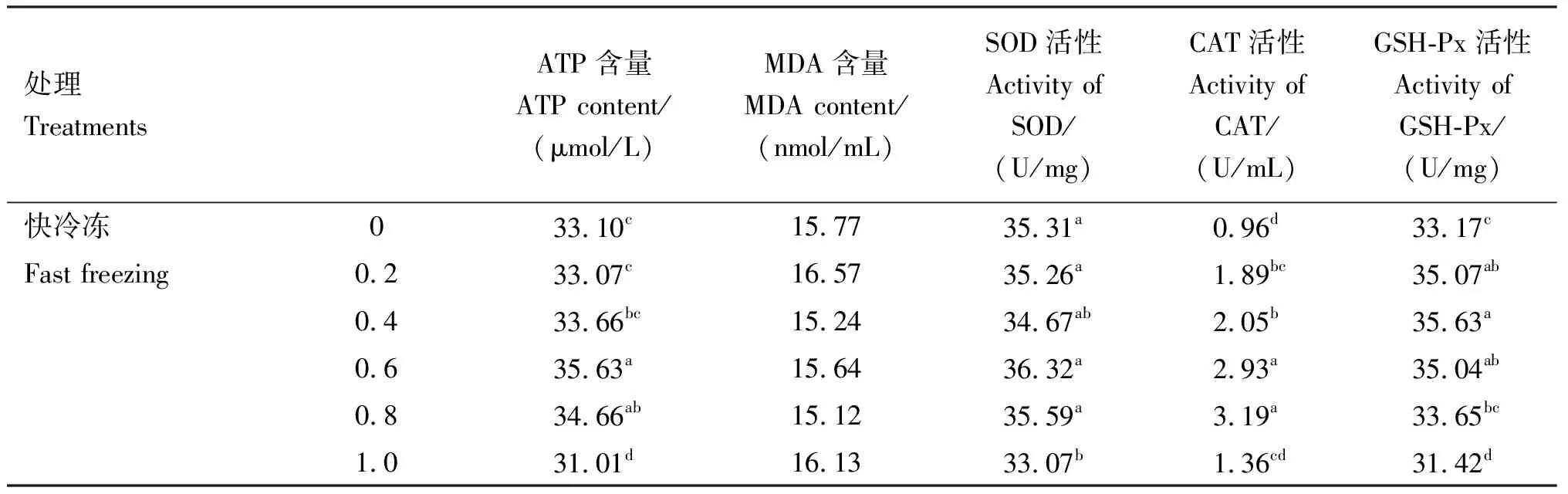
表3 各组精子ATP、MDA含量及SOD、CAT、GSH-Px活性
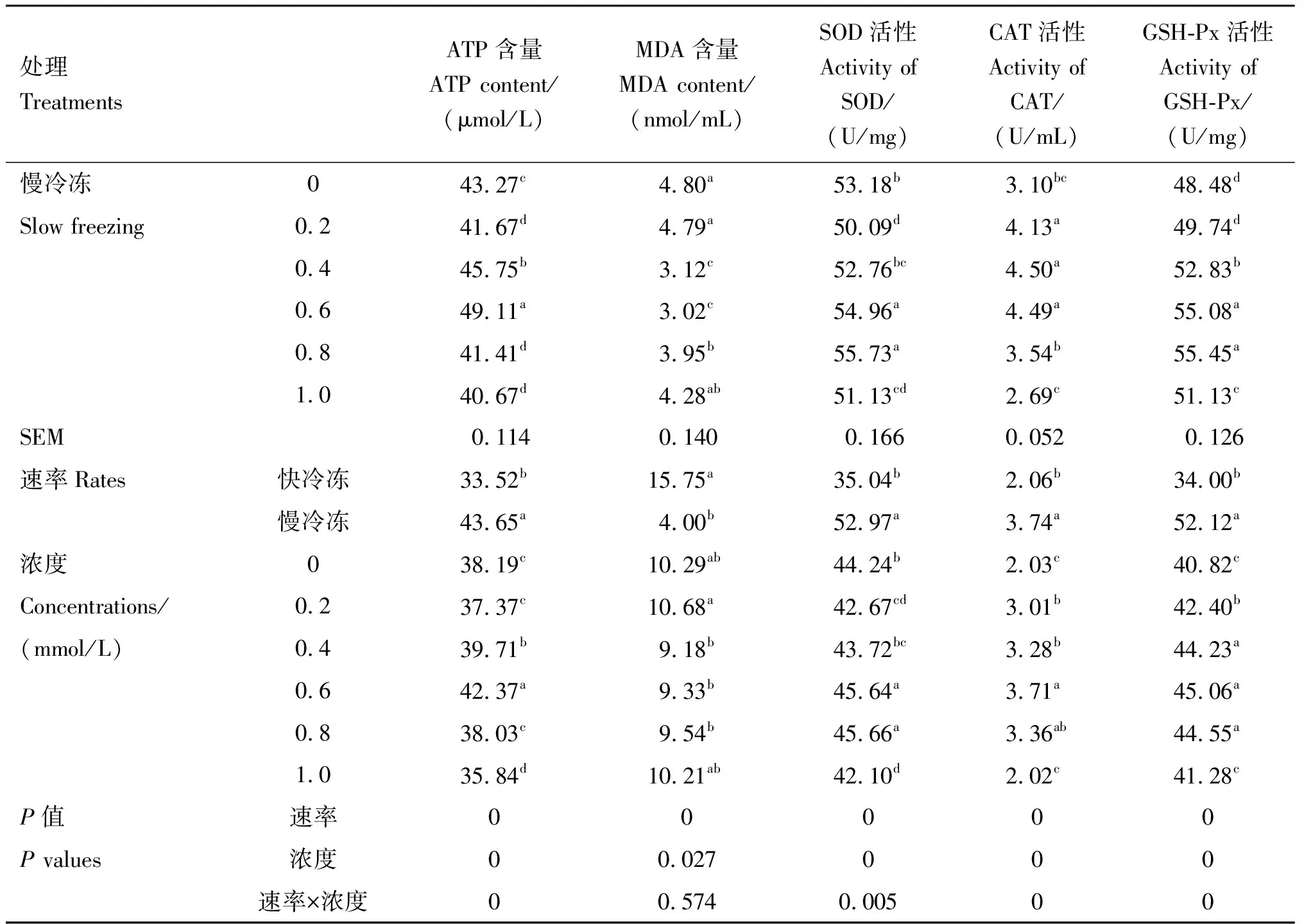
续表
3 讨 论
3.1 冷冻速率对冷冻保存猪精子质量的影响
冷冻精液制作过程中,冷冻速率至关重要,需要快速通过-80~0 ℃这一阶段,从而提高精子的存活率,不同物种对冷休克的敏感性决定精子所能承受的最大冷却速率,一般哺乳动物精子的冷冻速率约为0.25 ℃/min[12-13],而猪精子的最佳冷冻速率为0.1 ℃/min[14],过快或过慢都会造成精子存活率降低。梁鸿斌等[15]比较了3种(-100 ℃、10 min,-120 ℃、10 min,-140 ℃、10 min)不同冷冻速率,发现-120 ℃熏蒸10 min效果最好,本试验中距液氮面3 cm能更好地保护猪冷冻精液,获得较低的脂质过氧化水平,与其研究结果一致。喻宗岗等[11]研究表明,不同冷冻速率通过胞内外化学势能平衡决定形成的冰晶大小,进而控制对精子的损伤程度。有证据表明,精子冷冻后的存活率与冷冻速率表现出特征性的倒U形曲线,正是这种非线性特征提高了精子冷冻-解冻后的存活率[16],然而在通常情况下冷冻速率是通过将样品悬浮在液氮上方并固定熏蒸高度,在这种情况下冷却速率会受到精液包装和表面积大小的影响,因此对冷冻速率精确度的控制还需进一步改进。本研究发现,距液氮面3 cm冷冻效果好于距液氮面1 cm,这可能是由于精液在冷冻过程中需要一个温度梯度,距液氮面1 cm温度与进入液氮之前的温度相差太大,导致精子在快速冷冻过程中细胞破裂而降低精子活率。
3.2 芦丁对冷冻保存猪精子活力及运动参数的影响
冷冻精液的解冻后活力和运动参数是检测精子质量的重要指标。有研究表明,精子运动能力差会导致不孕症[17],直接影响人工授精效果。 Xu等[9]研究表明,在猪冷冻稀释液中添加0.4和0.6 mmol/L的芦丁冷冻后解冻,精子的运动参数(VCL、VSL)均显著提高。本研究结果显示,在冷冻稀释液中添加芦丁,能有效提高冷冻后解冻精子的活力与各项运动参数,而且距离液氮面3 cm的慢冷冻比1 cm的快冷冻效果好,且芦丁的最佳添加量为0.6 mmol/L,研究结果与Xu等[9]结果一致,说明添加芦丁能够提高冷冻-解冻精子的质量。
3.3 芦丁对冷冻保存猪精子质膜完整率、顶体完整率、线粒体膜电位、DNA完整率以及ROS水平的影响
精子超低温保存过程中需要保护细胞内结构和生物分子,特别是在冷冻精子的解冻过程中对ROS和脂质过氧化具有高度敏感性[18],ROS可直接作用于精子DNA的胞嘧啶[19],也可作用于DNA上的鸟嘌呤形成DNA氧化损伤的标志产物(8-羟脱氧鸟苷(8-OHd G)),并引起DNA链断裂[20]。ROS可直接损伤线粒体DNA,且与线粒体膜中丰富的PUFA(polyunsaturated fatty acid)发生LPO(lipid hydroperoxide)反应,从而引起线粒体损伤。精子质膜中的二十六碳六烯酸(DHA)在精子形成和膜流动性中起重要作用,并极易与ROS发生LPO反应,造成精子的氧化损伤,进而导致质膜完整性破坏、膜流动性和通透性降低等[21]。有研究表明,在马鹿[22]和公羊[23]精液中添加1 mmol/L芦丁保存于37 ℃条件下有助于提高精液质量,并推断将芦丁用作低温保存精液更能激发其保护精子的作用。另有研究发现,芦丁能提高血清/葡萄糖剥夺(SGD)条件下PC12细胞的活力,减少ROS和脂质过氧化的产生,可通过降低促凋亡蛋白(Bax、Caspase-3、Caspase-9)水平和提高抗凋亡蛋白Bcl-2水平,减轻DNA损伤,抑制细胞凋亡[24]。本研究结果表明,添加0.6 mmol/L的芦丁显著提高了精子质膜完整率、顶体完整率、线粒体膜电位、DNA完整率,同时也显著降低了ROS水平,有效减少了精子冷冻-解冻过程中的氧化应激,提高了解冻后精液的品质。与本研究结果类似,有研究还发现芦丁可通过其高效的抗氧化能力提高小鼠的线粒体功能[7,25]。然而,本研究中高浓度的芦丁并没有进一步提高解冻后精液的质量,这可能是由于高浓度的芦丁引发了新的脂质过氧化反应,从而导致精液质量下降。
3.4 芦丁对冷冻保存猪精子ATP、MDA含量及SOD、CAT、GSH-Px活性的影响
线粒体是真核细胞中能量的主要来源,通过氧化磷酸化与柠檬酸循环产生ATP,而ATP含量是决定精子获能的重要因素。线粒体是产能单位,线粒体的氧化损伤会导致胞内ATP含量快速减少,精子形态缺陷增加,活力降低。同时,精子中ROS水平升高会引起精子线粒体膜电位的改变[26]。有研究表明,芦丁通过调节氧化应激和改善细胞凋亡对大鼠肝脏和肾脏起保护作用[27-28]。槲皮素作为芦丁水解后的产物,在冷冻稀释液中添加0.25 mmol/L槲皮素可提高冷冻-解冻后精子的运动性和活力,同时降低脂质过氧化水平[29]。本研究发现,虽然大部分芦丁添加组ATP含量有所升高,ROS和MDA有所降低,但差别不大,这可能是由于精子冷冻后导致线粒体受损,而受损的线粒体减少了ATP的产生,也可能是因为受损的精子在死亡过程中释放了大量ROS,导致精液中MDA含量升高,发生氧化损伤引起精子细胞凋亡,从而影响了解冻后精液的品质。Khan等[30]研究发现,通过在大鼠精液中添加芦丁,有助于提高抗氧化酶活性,并且改善了脂质过氧化产生的损伤。另有研究表明,饲粮中添加1.5 g/kg芦丁可提高SOD和CAT的活性,并且降低MDA含量,从而保护银鱼肝脏免受氧化应激和凋亡的影响[31]。本研究结果表明,在冷冻稀释液中添加0.6~0.8 mmol/L芦丁降低了ROS和MDA的产生,增加了解冻后精子SOD、CAT、GSH-Px的活性,与上述研究一致。因此,添加芦丁可以提高冷冻过程中精子的ATP含量,改善保存过程中猪精子的抗氧化能力,减少自由基的损害。
4 结 论
不同芦丁浓度与不同冷冻速率间存在互作效应,其中在精液冷冻稀释液中添加0.6 mmol/L芦丁距液氮面3 cm的冷冻速率冷冻-解冻后精子质量最好。
