CuFe/BC活化缓释过硫酸盐降解金橙II研究
2022-03-16潘青青邹海明范行军赵建荣
王 艳,江 腾,潘青青,邹海明,范行军,赵建荣
(安徽科技学院资源与环境学院,安徽 蚌埠 233100)
硫酸根自由基的高级氧化技术适用范围广、水溶性高、性质稳定、反应迅速、氧化降解能力强,基本可以降解大多数有机污染物等特点受到广泛关注[1]。过硫酸盐具有反应高效的特点,且在比较宽的pH条件下都具有良好的氧化能力,是目前环境污染修复中应用广泛的氧化剂。在众多过硫酸盐中,过硫酸钠(PS)的水溶性最高,而且分解之后的产物无毒害作用[1]。但过硫酸钠在污水治理中能快速溶解,如果消耗不彻底,会造成氧化剂的浪费[2]。将过硫酸钠通过熔融法制成过硫酸钠缓释颗粒,一方面可以稳定反应液中氧化剂的浓度,另一方面可以提高氧化剂的利用效率[3]。
文献报道,CoFe2O4[4]、CuFe2O4[5]等AB2O4型铁酸盐和炭基材料[6]对活化过硫酸盐具有较高的催化活性。但大部分铁酸盐具有磁性,容易团聚,弱化其催化活性;炭基材料使用一次后,催化活性也大大减弱。两者相结合不仅可以克服铁酸盐的团聚效应,还可以充分利用炭基材料的庞大比表面积作为铁酸盐的载体,也有助于提高铁酸盐的整体活性。炭基材料负载铁氧化物活化过硫酸盐降解有机物的过程中展现了很好的效果,但未见炭基材料负载铁酸盐活化过硫酸盐缓释剂降解有机物的报道。
随着科学技术的飞速发展和人们生活水平的提高,合成染料广泛应用于各行各业。合成染料在生产和使用过程中产生的废水具有较强的生物毒性和很高的“三致”风险,如果这类废水在排放之前得不到妥善处理,将给生态环境造成恶劣的影响[7]。本文以具有代表性的偶氮染料金橙II作为目标污染物,CuFe/BC为催化剂,考察了过硫酸盐缓释剂催化氧化降解过程中的效果、操作条件对金橙II降解情况的影响以及降解机理。
1 材料与方法
1.1 试剂
过二硫酸钠(PS),硼氢化钠(NaBH4),氯化铁(FeCl3),对苯醌(BQ),迭代钠(NaN3),氯化铜(CuCl2),叔丁醇(TBA),金橙II(OII),甲醇(MeOH),均为分析纯,购于国药集团化学试剂有限公司。4-氧代-2,2,6,6-四甲基哌啶(4-oxo-TEMP),5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)均为分析纯,购于阿拉丁试剂有限公司。明亮发光杆菌T3冻干粉购于南京土壤所。
1.2 主要仪器
紫外可见光分光光度计(UV-1750,SHIMADZU公司,日本);电子自旋顺磁共振波谱仪(EPR,布鲁克A200,德国);智能化生物毒性仪(DXY-3,中国);生化培养箱(SPX-250AB)等。
1.3 试验方法
1.3.1 CuFe/BC催化剂的制备
从滁州某污水处理厂取含水率90%的活性污泥自然晾干后,粉碎,记为HN。称取一定量HN置于陶瓷坩埚内,压实,在500℃马弗炉中煅烧2 h。马弗炉内冷却到室温,采用玛瑙研钵研磨成粉末,通过80目筛孔的粉末为生物炭(BC)。将一定量的Fe2(SO4)3和CuSO4溶解在50 mL超纯水中,搅拌至硫酸盐完全溶解。加入BC;搅拌,再加入NaOH,继续搅拌至NaOH溶解。边搅拌边加入1 g NaN3。10 min后,将棕褐色悬浮物转移到100 mL高压反应釜中。将反应釜放入180℃的烘箱内,加热24 h。最后自然冷却到室温,采用砂芯过滤器过滤,所得黑色固体颗粒用超纯水冲洗至中性,60°C烘箱内烘干[5,8],即为CuFe/BC粉末。
1.3.2 过硫酸盐缓释剂的制备
采用熔化成型法将4 g石蜡置于70℃水浴中融化[2],以400 r/min的速度边搅拌边加入0.5 mL 液体甘油和1 g 细小的过硫酸盐颗粒,待混合10 min后,将混合物填入直径为0.4 cm球形硅胶盘或直径为1 cm的圆柱形模具中,置于冰水浴中冷却成型,即制得过硫酸盐缓释剂(SRPS)。
1.3.3 催化降解实验
在室温条件下,向300 mL烧杯中加入200 mL一定浓度的金橙II模拟染料废水,并将烧杯放在搅拌速度为150 r/min磁力搅拌器上。在持续搅拌的过程中同时加入一定量的SRPS和CuFe/BC,并开始计时。在设定的间隔时间内用注射器取样,0.22 μm水系滤膜过滤,滤液置于波长为484 nm的分光光度计中测量其吸光度。金橙II脱色率:
(1)
其中,R为金橙II脱色率,%);Ct为t时刻金橙II的浓度(mg/L);C0为金橙II的初始浓度(mg/L)。
反应液中残留PS浓度采用碘量法测定[9-10]。将0.1 g NaHCO3和2 g KI加入到装有20 mL去离子水的螺旋玻璃瓶中,待其溶解后,向里面加入0.1 mL 样品,摇匀,静置15 min后在352 nm测定其吸光度值。
1.3.4 生物毒性分析
依照《水质急性毒性的测定发光细菌法》(GBT 15441—1995)测定[11]。每个样品做3个重复和3个空白。
(2)
其中,I为金橙II降解出水对发光菌发光强度的抑制率(%);A为发光菌在金橙II降解t时刻时出水中的发光强度(mV);A0为发光菌在金橙II降解0时刻时出水中的发光强度(mV)。
2 结果与讨论
2.1 不同操作条件的影响
为了解过硫酸盐缓释剂在CuFe/BC/SRPS体系中的效果,当金橙II初始浓度为20 mg/L,反应液pH为6时,考察了单独PS、CuFe/BC、CuFe/BC+PS、SRPS和CuFe/BC+SRPS等不同实验条件下金橙II的降解情况,其中单独PS和CuFe/BC+PS体系中PS的用量为25 mmol/L;SRPS和CuFe/BC+SRPS体系中SRPS的用量为25 mmol/L(约30 g/L);在CuFe/BC、CuFe/BC+PS和CuFe/BC+SRPS体系中CuFe/BC的投加量均为1 g/L,其结果如图1所示。
由图1和图2可知,90 min后CuFe/BC体系中金橙II的去除率只有3.91%,CuFe/BC对金橙II的吸附能力很弱;虽然单独PS反应液中PS的浓度是23.6 mmol/L,单独SRPS体系中PS的浓度是9.58 mmol/L,但是金橙II在PS或SRPS体系中的脱色率都小于2%,说明PS(E0=2.01 V)的氧化能力有限[12],不足以降解金橙II。
虽然金橙II在CuFe/BC+SRPS氧化体系中的脱色速率比在CuFe/BC+PS氧化体系中慢,但是90 min内金橙II的脱色率都可以达到97%以上。这是因为CuFe/BC对PS具有很强的催化活性,活化反应液中的PS产生大量的SO4·-,SO4·-进一步氧化金橙II,从而促进了金橙II脱色率的提高。但是氧化降解反应结束时,CuFe/BC+SRPS氧化体系中残留的PS浓度大于CuFe/BC+PS氧化体系中残留的PS浓度,说明CuFe/BC+PS氧化体系中存在PS无效分解的情况。
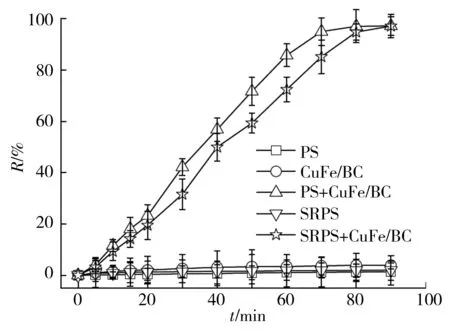
图1 不同降解系统下金橙II的脱色率
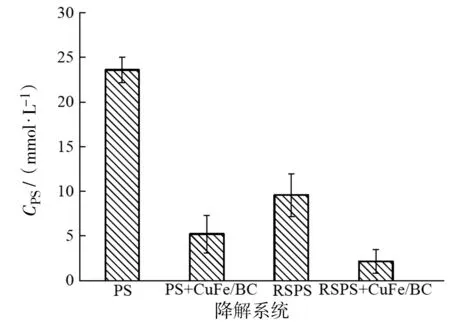
图2 不同降解系统下残留的过硫酸盐浓度
2.2 连续运行条件下金橙II的降解情况
为了进一步了解SRPS的缓释效果,SRPS连续两次被作为氧化剂用于降解金橙II,降解实验的初始条件为:金橙II初始浓度为20 mg/L,CuFe/BC的投加量均为1 g/L,反应液pH为6,PS或SRPS初始用量为25 mmol/L。反应90 min后,再分别加入4 mL 1g/L金橙II到CuFe/BC+PS体系或CuFe/BC+SRPS体系中,搅拌均匀,同时计时,其结果如图3所示。在90 min以内,在CuFe/BC+PS体系中金橙II的降解速率高于在CuFe/BC+SRPS体系;而第二次加入金橙II后,在CuFe/BC+SRPS体系中的金橙II的降解速率高于在CuFe/BC+PS体系。将反应时间延续到180 min时,在CuFe/BC+SRPS体系中金橙II的脱色率达到了93.42%;在CuFe/BC+PS体系中金橙II的脱色率只有30%。而且在反应时间达到140 min后,金橙II在CuFe/BC+PS体系中的降解速率就非常缓慢了。这种现象进一步说明了,在CuFe/BC+PS体系中PS短时间内被活化,产生大量的SO4·-,而SO4·-在水体中的半衰期只有30~40 μs[12],无法将大部分SO4·-用于降解金橙II,而是通过公式(3)和(4)成为无效分解[13-14]。而SRPS是一个缓慢释放PS的过程,那么产生SO4·-的速率也受到控制,减少了PS的无效分解,增加了PS的有效利用。
(3)
·OH+·OH→H2O2
(4)
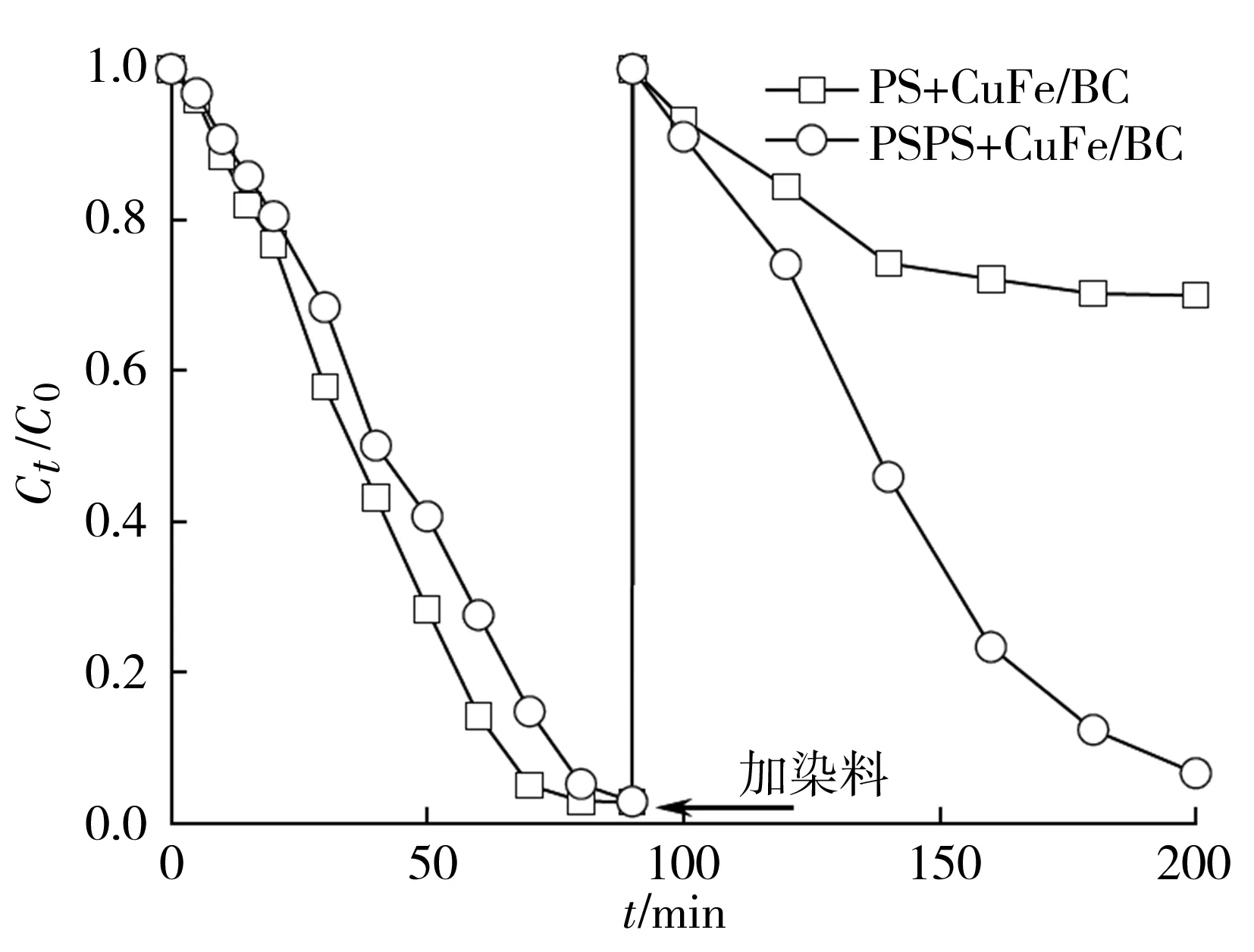
图3 连续运行状态下金橙II的脱色情况
2.3 不同形状SRPS的效果
SRPS展现出了比PS好的氧化效果,为了解不同形状的SRPS效果,制备出了柱状和颗粒状的SRPS,并在金橙II初始浓度为20 mg/L,CuFe/BC的投加量均为1 g/L,反应液pH为6,SRPS初始用量为25 mmol/L条件下考察了金橙II的脱色情况,其结果如图4所示。由图3可知,颗粒状SRPS作为氧化剂的体系中,金橙II的脱色速率远高于柱状的SRPS+CuFe/BC体系中的效果。主要是因为颗粒状SRPS中PS比柱状SRPS中的PS溶解扩散到反应液主体的路径短,所需要的时间少,从而提升了SO4·-产生的速率,进一步加快了金橙II的脱色速率。
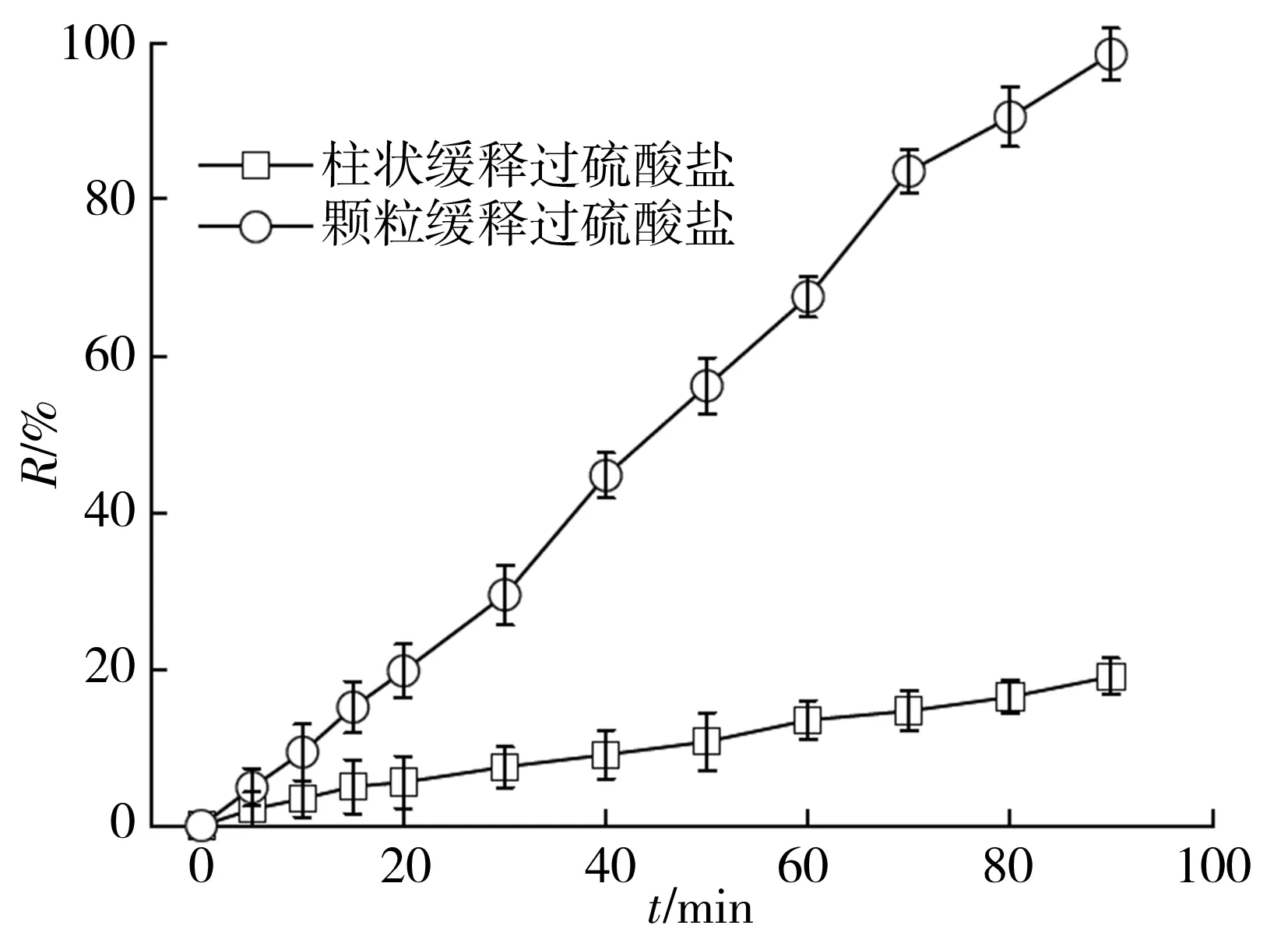
图4 不同形状缓释过硫酸盐对金橙II脱色效果的影响
2.4 催化剂的重复使用效果
为了解CuFe/BC在SRPS+CuFe/BC体系中的催化性能,在金橙II初始浓度为20 mg/L,CuFe/BC的投加量均为1 g/L,反应液pH为6,SRPS初始用量为25 mmol/L条件下,考察了CuFe/BC作为催化剂,4次反复使用过程中金橙II的脱色情况,结果如图5所示。从图5中可以看出,CuFe/BC重复使用4次后,金橙II的脱色效果基本维持不变,脱色率分别为97.12%、98.50%、98.36%、98.45%,说明CuFe/BC在SRPS+CuFe/BC体系中具有较好的催化活性,也是一种长效催化剂。
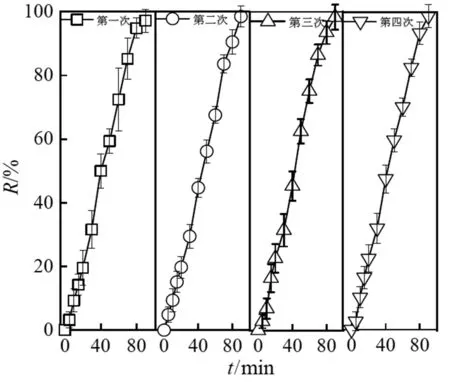
图5 CuFe/BC的重复使用性
2.5 活性物种的鉴别

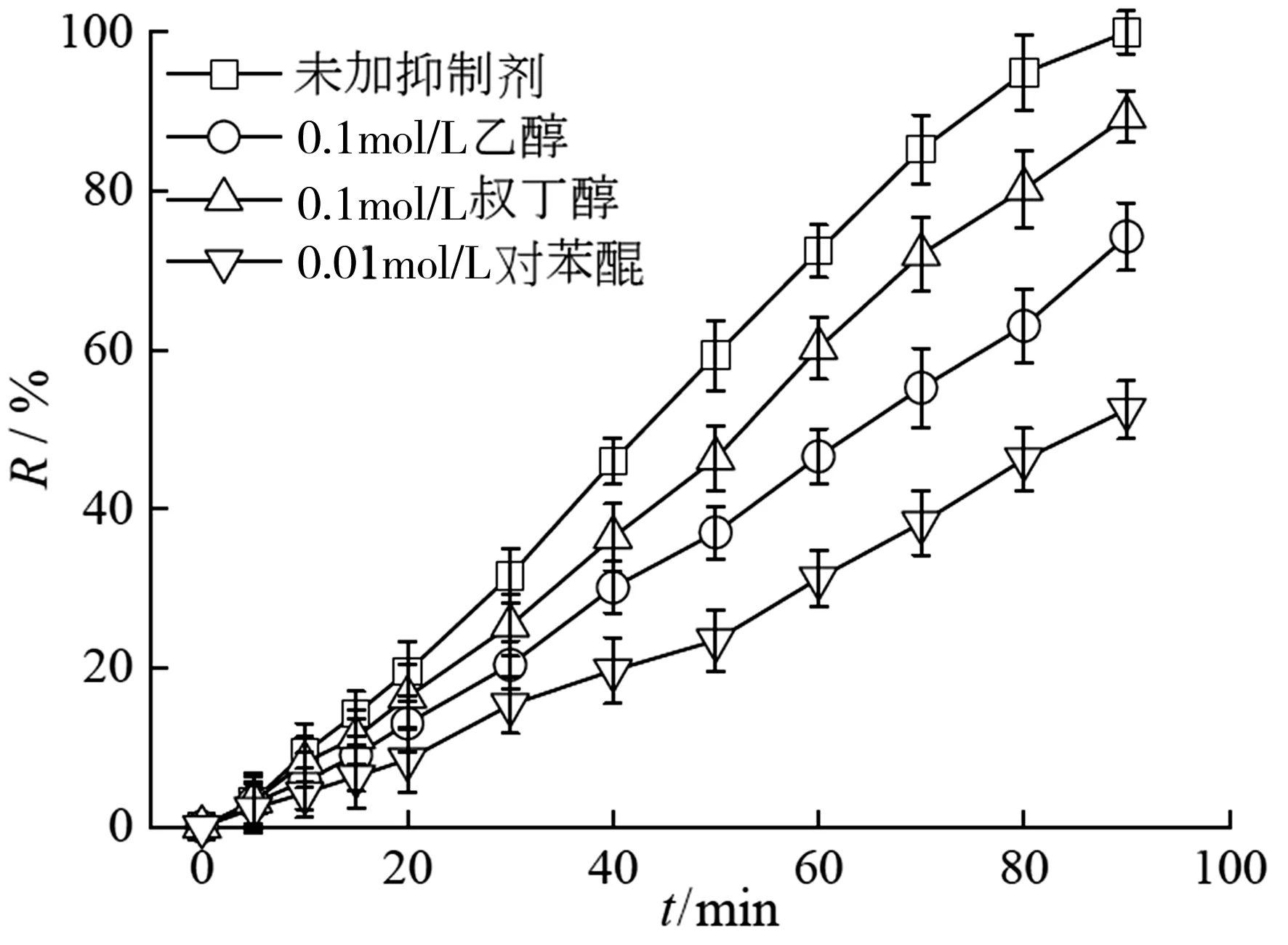
图6 抑制剂对脱色效果的影响
为了更直接地了解各氧化体系中存在的活性物种,EPR技术被用于鉴别反应过程中常见的几种自由基,结果如图7所示。如图7(a)所示,DPMO-OH和DMPO-SO4在PS+BC、PS+CuFe/BC、SRPS+CuFe/BC体系中均被检测到,说明这三种体系BC和CuFe/BC都可以活化过硫酸盐产生·OH和SO4·-;但是单独的PS在pH为6条件下无法自分解产生·OH和SO4·-,也直接地证明了图7(a)的结果[19]。虽然,BQ的加入使得金橙II的脱色率明显降低,但是在EPR检测过程中,并未见到显著的特征信号,可能是因为DMPO-O2·-信号不如其他信号强。TEMP因能与1O2形成稳定的TEMP-1O2加合物而且具有显著三重等高线的EPR特征信号,而成为一种典型的1O2自旋捕集剂[6]。在SRPS+CuFe/BC体系下检测TEMP-1O2的特征信号,见图7(b),说明1O2对于金橙II的脱色做出了贡献的作用。
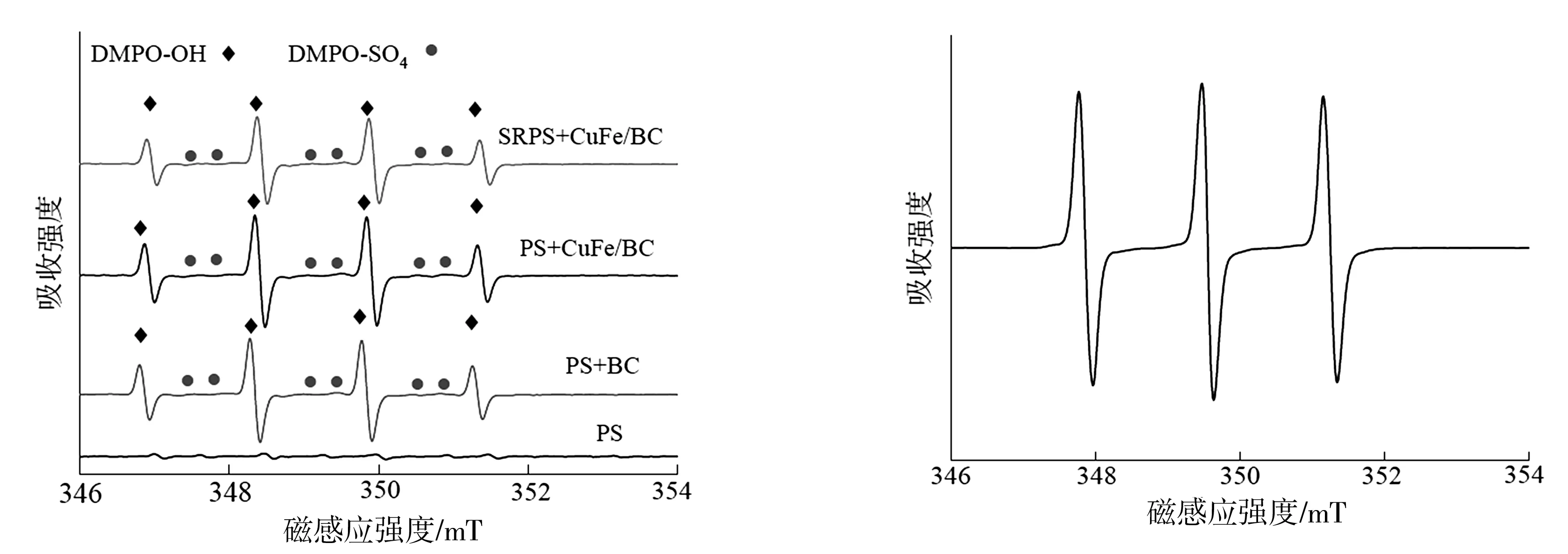
(a)DMPO的EPR图谱(b)TEMP的EPR图谱图7 DMPO和TEMP的EPR图谱
2.6 系统参数对金橙II脱色效果的影响
从图8(a)中可以看出随着反应液初始pH值的升高,金橙II的脱色率先升高然后逐渐降低。这是因为作为载体的生物炭BC上的含氧基团(如-COOH,-OH)也能通过公式(5)(6)活化过硫酸盐产生SO4·-[20-21]。
(5)
(6)
但是反应液中的H+可以与-COOH和-OH反应,降低BC表面-COOH和-OH的数量,从而抑制-COOH和-OH活化过硫酸盐分解产生SO4·-。由此,反应液pH越低,溶液中的H+越多,那么产生的SO4·-越少,必然导致金橙II脱色速率的降低。当反应液初始pH值大于6之后,金橙II的脱色率却随着pH的升高而逐渐减低。这是因为碱性条件下,反应液中存在的OH-能与产生的SO4·-反应生成了·OH。虽然·OH的氧化还原电位也很高,但是其半衰期却远低于SO4·-,由此很大程度地降低了与金橙II碰撞反应的机率。进一步降低了金橙II的脱色率。FENG等[7]采用磷化铜活化PS降解金橙II和DANIELE等[15]采用修饰的纳米零价铁活化PS降解甲基橙时也出现了相似的现象。
图8(b)显示随着SRPS投加量的增加,金橙II的脱色速率逐渐增加。这是因为SRPS增加氧化体系中SO4·-的数量,从而提高了金橙II的脱色率。同样的道理,催化剂CuFe/BC投加量的增加为SRPS的分解产生SO4·-提供了更多的活性位点,进一步加速了金橙II的脱色,如图8(c)所示。
SRPS释放PS的原理是甘油在水的作用下慢慢溶解,并在SRPS中形成空隙,水顺着空隙进一步渗入SRPS中溶解PS[2],然后溶解在水中的PS扩散到水体中参加催化氧化反应。如图8(d)所示,随着甘油量的增加,金橙II的脱色率逐渐增加。当甘油量增加到约0.5 mL/(10 g SRPS)后,继续增加甘油的添加量时,金橙II的脱色率不再增加。可能是因为催化剂提供的活性位点是恒定的,当释放到反应体系中的氧化剂量达到一定值时,产生SO4·-的速率也会恒定,那么用于氧化金橙II的SO4·-也是恒定的,即金橙II的脱色率也不会再增加。
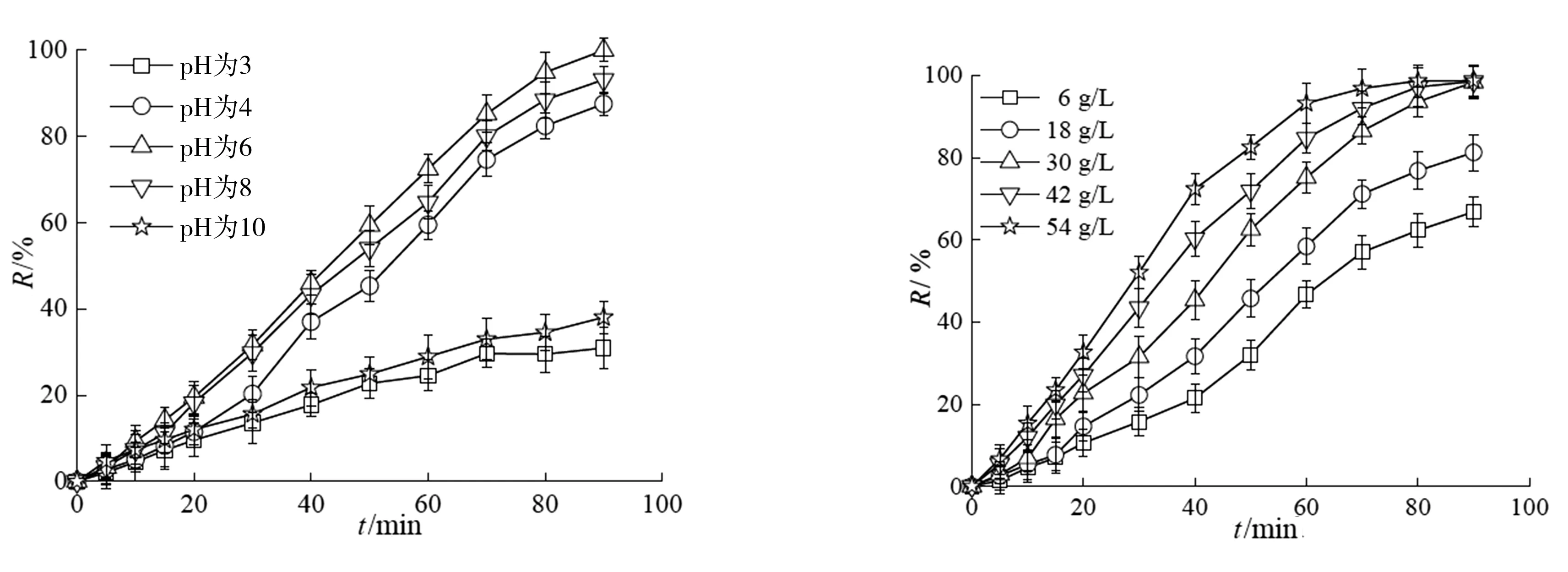
(a)pH (b)SRPS投加量
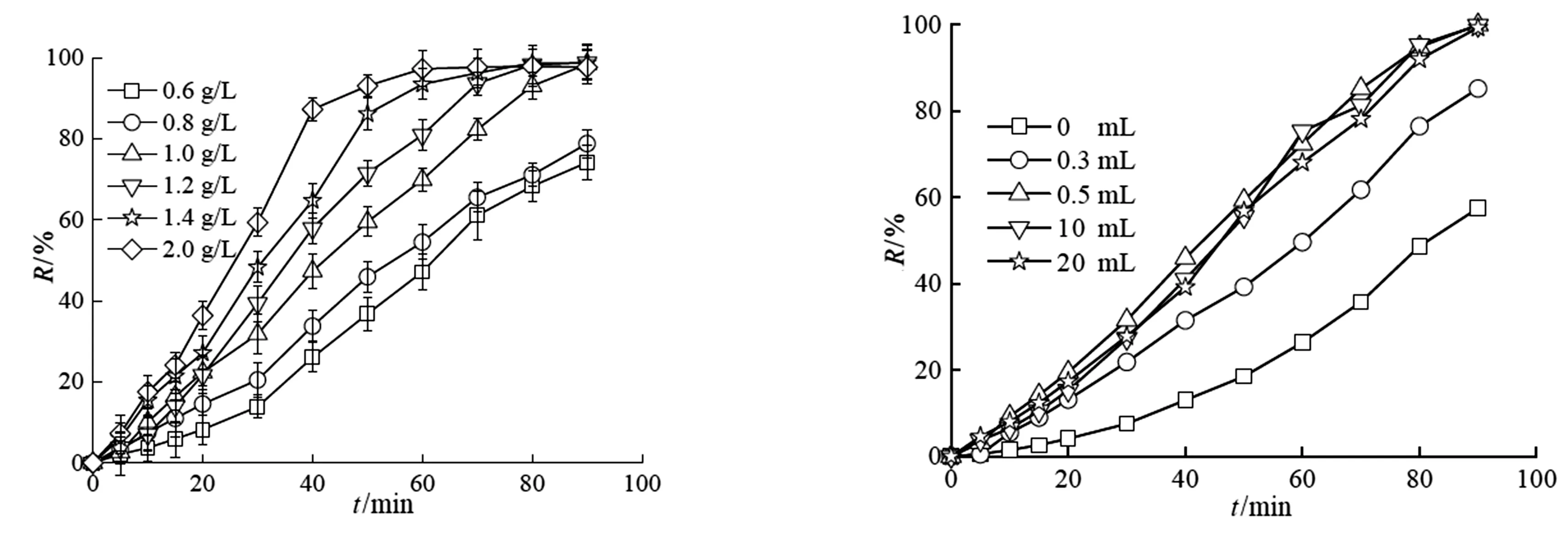
(c)CuFe/BC投加量 (d)甘油加入量图8 操作条件对脱色率的影响
2.7 金橙II降解出水的生物毒性变化
众所周知,在高级氧化技术降解有机污染物的过程中,一些中间产物的生物毒性会高于母物质[19]。而废水治理的目的是为了降低出水的生物毒性,因此在废水治理过程中,生物毒性的监测很重要。在SRPS+CuFe/BC氧化体系中,金橙II几乎完全脱色,为了解在SRPS+CuFe/BC体系中金橙II脱色过程出水的生物毒性,采用明亮发光菌为目标测试物,考察了反应过程中出水对明亮发光菌发光强度的影响,结果如图9所示。由图9可知,随着金橙II的降解,出水对发光菌发光强度的抑制率先升高然后逐渐降低。在染料废水降解反应达到60 min时,反应出水对发光菌抑制率达到87%。这是由于金橙II在降解过程中生成了比金橙II生物毒性更高的中间产物[22-23]。随着染料废水降解时间的增加,氧化物种逐步降解了这些具有较高生物毒性的中间物质,那么染料降解出水的生物毒性也随之逐渐降低。
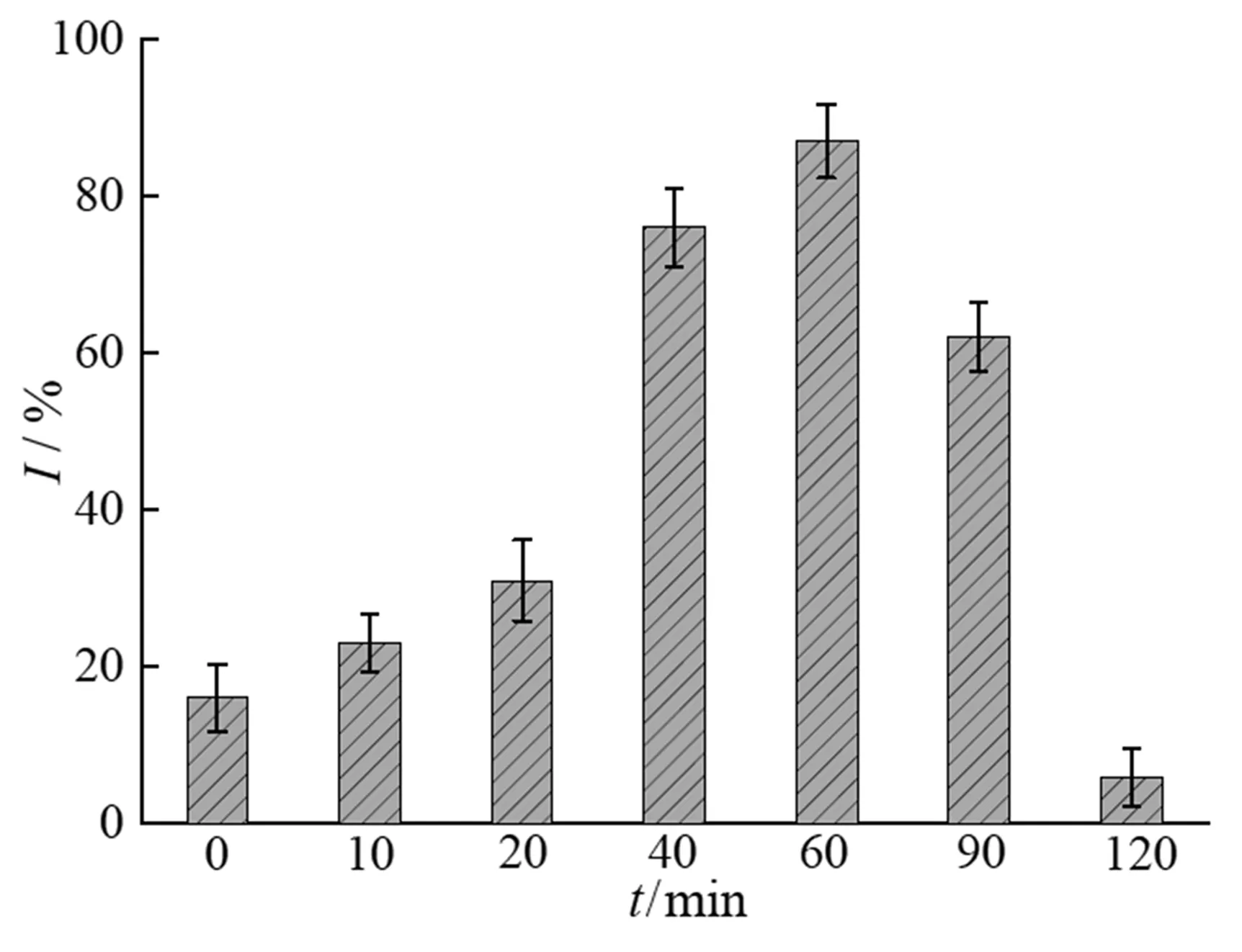
图9 金橙II降解过程中生物毒性变化
3 结论
采用熔化成型法制得的过硫酸盐缓释氧化剂,以CuFe/BC为催化剂,考察了CuFe/BC活化SRPS降解金橙II的催化效能。结果表明,在非均相反应体系中CuFe/BC展现出较高的催化活性,在90 min内能使金橙II脱色率达到97%。CuFe/BC经4次循环重复使用后金橙II脱色率均可达到97%以上,由此证明CuFe/BC催化性质稳定,具有良好的循环使用性。
颗粒状的SRPS氧化性能高于柱状的SRPS,连续使用两次,仍能使金橙II的脱色率保持在93%左右。CuFe/BC+SRPS氧化体系中加入抑制剂和EPR技术检测说明了CuFe/BC+SRPS氧化体系中存在·OH、SO4·-、O2·-和1O2。
单因素实验结果表明,随CuFe/BC、甘油和SRPS投加量增加金橙II的脱色率也逐步增加;金橙II反应液初始pH小于6时,随pH值的增加而金橙II脱色率而提高,金橙II反应液初始pH大于6后,随过pH值的增加而金橙II脱色率逐渐降低。金橙II降解出水的生物毒性先升高后降低,延长降解时间到120 min时,出水的生物毒性几乎可以忽略。
