高精细水凝胶微图案的快速制备及其对细胞行为的诱导
2022-03-16张维彩郑美玲董贤子
张维彩,郑美玲,董贤子,刘 洁,金 峰
1中国科学院理化技术研究所仿生智能界面科学中心有机纳米光子学实验室,北京 100190;
2 中国科学院大学未来技术学院,北京 101407
1 引言
组织工程旨在进行组织和器官的损伤修复和重新构建,需要成熟的细胞学理论和良好的生物材料的支撑。细胞在体内进行规则有序地排列,呈现特殊的形貌并产生特定功能,是各种生物化学信号、环境的地形特征和力学性能等共同作用的结果[1]。因此,通过功能化生物材料在体外创造一个仿生细胞微环境,对研究细胞与环境、细胞与细胞的交互作用以及诱导调控细胞粘附、增殖、迁移和分化等生物行为具有重要意义[2-3]。研究表明,图案化表面对细胞具有接触诱导效应[4],微米结构可有效调控细胞的黏附形态与排列。2021 年,Agnes Szabo 等利用SU-8 图案化基底培养胶质细胞,发现微沟槽阵列能够引导细胞核生长的方向,与微柱阵列相比,细胞核表现出更明显的拉伸长度[5]。而纳米结构则从分子水平影响细胞的行为和功能[6-9]。2012 年,Robinson 等利用垂直纳米线电极阵列作为神经回路的细胞内接口的可扩展平台,刺激并记录了大鼠皮质神经元的分离培养物中的神经元活动,并证明该平台可用于绘制多个单独的突触连接[10]。2021 年,Cheng 等制备了纳米孔和纳米棒,发现这些纳米形貌可以促进丝状体的产生和长突起的延伸,随着孔深和柱高的增加,细胞迁移速度和迁移方向产生相反的效果,这可被用于细胞分拣和筛选[11]。因此,利用生物友好性材料创建具有不同尺度、不同拓扑地形的体外细胞培养平台,考察细胞-材料,细胞-环境相互作用机制,对组织工程领域的发展具有重要意义。
水凝胶材料由于成分类似于细胞外基质,具有良好的生物相容性、无毒性和可降解性等优点,是组织工程、医用伤口敷料、药物输送等领域常用的生物功能材料[12-15]。利用水凝胶材料制备不同尺寸和拓扑形貌的微纳米结构,可以更好地模拟和维持细胞在体内的生长环境,是当前的研究热点[16-18]。近年来,随着微纳加工技术的发展,研究人员利用3D 打印[19-20]、软印刷[21-22]、自组装、紫外光刻[23-24]、激光光刻以及多种技术结合制备了各种图案化表面如沟槽-脊[25-27],微纳米点、棒、坑[28-29],网格[30-31]以及其它形貌的微岛[32],并证明了沟槽结构可以使细胞沿着沟槽取向和排列,促进血管生成和创口愈合[33]。点、棒、坑可以调节细胞骨架上长突起的产生和延伸,改变细胞迁移速度[34]。这些微结构对细胞增殖、迁移和分化等行为表现出诱导和调控作用,对了解生物体的内在运行规律和生命的本质有着重要意义。然而,体内细胞生活在具有复杂网络的细胞外基质中,上述技术加工的微结构由于水凝胶性质和制造方法本身的限制,一般都尺寸较大,结构精细度相对较低;同时,又存在图案过于简单、加工不灵活等缺点。因此,复杂程度更高、面积更大、具有任意拓扑形貌的水凝胶微结构的制备是一大难点。
基于数字微镜器件(digital micromirror device,DMD)的无掩模光刻技术作为传统光刻技术衍生出的一种技术,以可单独寻址的微反射镜组成的阵列器件与对应存储元件集成的芯片作为数字掩模,曝光投影过程同传统光刻相似[35],但制备的结构精度不高。本研究团队在前期所发展的飞秒激光无掩模投影光刻技术中取得了重要突破,该技术以飞秒激光作为光源,利用大数值孔径物镜聚焦,通过多子场拼接可以实现大面积微结构的制备,兼顾了加工效率和结构精度[36-37]。
在这项工作中,我们利用自主搭建的DMD 无掩模投影光刻系统,以400 nm 飞秒激光作为面投影曝光光源,结合多子场拼接,制备了大面积、不同尺寸的空心水凝胶多边形和多角星微结构,用以研究复杂地形特征对细胞生长的影响规律。实验中,本实验室自主配制的生物相容性水凝胶前驱体可以直接利用该技术进行图案化曝光。曝光图形由计算机控制,预先设计好尺寸和形貌,制造过程简单、快速。带有微结构的基底与成纤维细胞L929 共培养实验证明,空腔尺寸大的微结构由于细胞活动空间大,细胞行为基本同二维平面上一致,仅靠近微结构边缘的细胞的骨架会产生形变和交互。而空腔尺寸小的微结构则对细胞具有明显的限位作用,细胞两端拉长度明显降低,同时方度增加。特别的是,我们观察到小尺寸三角形和三角星微结构上的细胞骨架表现出适应基底图案的分布,细胞核落入中心凹陷里,细胞形貌最终铺满整个微结构表面,形貌保持同微结构一致。该研究为制备水凝胶基底拓扑结构研究细胞行为提供了新思路,在组织工程领域具有广阔的应用前景。
2 理论推导
2.1 实验试剂及仪器
本实验中所用的试剂包括:聚合单体PEGDA(Mn=700)、光敏引发剂2-苄基-2-二甲基氨基-1-(4-吗啉苯基)丁酮和苯偶酰(Sigma Aldrich Reagent Company,美国);交联剂PE-3A(LOT.No.0072994,KYOEISHA,日本);DMEM 培养基(GE Healthcare Life Sciences,美国);青霉素-链霉素和DAPI 探针(北京阳光生物科技有限公司生产);胎牛血清(TransGen Biotech,澳大利亚) ;肌动蛋白探针ActinRed 555(ThermoFisher,美国);NaCl、KCl、KH2PO4和Na2HPO4(Amresco 公司,美国);无水乙醇(国药集团化学试剂有限公司);超纯水来自Millipore Milli-Q 超纯水机(MQ 水电阻率>18 MΩ·cm,法国)。实验中所有试剂均未经纯化直接使用。
本实验中所用仪器:飞秒激光器(Spectra-Physics,MAI TAIHPINSPIRE AUTO 100);DMD 芯片(0.7’’XGA 型,德州仪器公司,美国);无掩模光刻系统(本课题组自主搭建);细胞培养箱(MCO175,SANYO,日本);离子溅射仪(株式会社日立制作所,日本);扫描电子显微镜(SEM,HITACHI S-4800,株式会社日立制作所,日本);激光扫描共聚焦显微镜(LSCM,Nikon,A1R MP,日本)。
2.2 无掩模投影光刻(DMD)制备大面积微图案
在本研究中,所采用的DMD 面投影光刻系统以400 nm 的超快激光(MaiTai HP+Inspire AUTO100,Newport)作为光源,DMD 芯片可以根据设计的黑白图形生成相应的图案化光场,白色部分反射激光,黑色部分激光无法反射。当采用负性光刻胶曝光时,光刻胶在激光照射下发生聚合反应,聚合部分形成微结构;当采用正性光刻胶时,正性光刻胶遇光分解,未分解部分形成微结构。通过计算机可以根据需要调控DMD 生成的任意图案化光场。此外,在DMD 投影光刻中,单次的曝光只能获得一个子场面积的微结构。通过三维位移台(XMS160,GTS30V,NEWPORT)精确地控制样品的移动,可以在下一个确定位置处简单地重复上述投影光刻过程。这种拼接的加工方法,可以在保持精度、均匀性的同时实现多种图案化微结构的批量制备。图1 是无掩模投影光刻制备大面积水凝胶微图案的流程图。
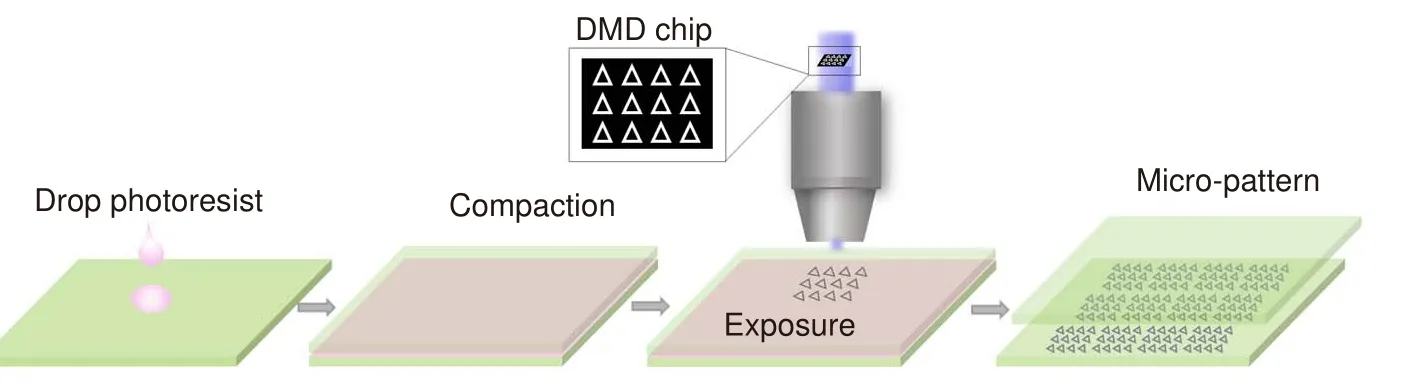
图1 制备大面积水凝胶微图案的流程图Fig.1 Schematic diagram for the preparation process of large-area hydrogel micropatterns
2.3 水凝胶基光刻胶的配制及聚合流程
实验中,聚乙二醇二丙烯酸酯(PEGDA)和交联剂(PE-3A)重量比为2∶3,以确保结构具有足够的力学性能支撑细胞的生长。2-苄基-2-二甲基氨基-1-(4-吗啉苯基)丁酮和苯偶酰按照1∶1 混合用作光引发剂。整个水凝胶前驱体中PEGDA、PE-3A 和两种光引发剂重量比为39.2∶59.2∶0.8∶0.8 wt%。图2 是光刻胶各组分化学结构示意图。投影曝光前,取两滴水凝胶基光刻胶滴在玻璃片上,盖上另一块玻璃片,光刻胶受毛细作用铺满整个玻璃片间隙,间隙厚度最高可达几十微米。曝光时,只有白色图案部分反射激光,被激光照射过的区域水凝胶发生聚合,从而获得设计的微结构。曝光结束后,从一角开始慢慢揭开玻璃片,选用乙醇作显影液,将玻璃片浸在乙醇溶液里5 min,未聚合的水凝胶基光刻胶溶解在乙醇中,聚合的部分则留在玻璃片上,得到所需微结构图案。
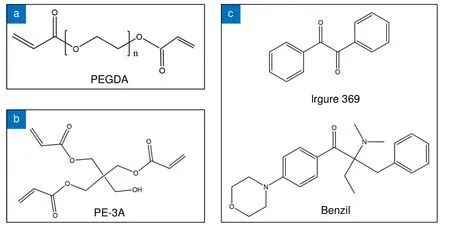
图2 光刻胶各组分化学结构示意图。(a) 单体;(b) 交联剂;(c) 两种光敏引发剂Fig.2 Schematic diagram of the chemical structures of the component of photoresist.(a) Monomer;(b) Crosslinker;(c) Photoinitiators
2.4 细胞-微图案共培养
培养前处理:带微结构盖玻片裁切成合适大小,用70%的乙醇溶液冲洗3 次,PBS 缓冲液冲洗3 次,紫外线照射30 min。最后,再利用培养基清洗三次,干燥后放置在玻璃培养皿里。
细胞培养:细胞培养时,将成纤维细胞 L929 细胞(密度大约为 5 × 105细胞/cm2)接种在放有带微图案盖玻片的培养皿(35 mm × 12 mm 型;NEST) 中,在 37 ℃、5% CO2气氛的加湿培养箱中培养48 h。
观察前处理:去除培养基,PBS 缓冲液冲洗3 次,用4%的多聚甲醛覆盖培养皿,固定15 min;0.1%的Triton X-100 通透5 min;ActinRed 555 室温避光孵育30 min,进行肌动蛋白染色;最后用DAPI 染细胞核10 min。
3 实验结果与数据分析
3.1 大面积结构制备
3.1.1 大尺寸微结构
DMD 芯片尺寸为1024 pixel×768 pixel,微图案的设计尺寸与像素的关系根据公式:计算。其中:L表示设计尺寸,N是成像镜头的缩放倍数。图3(a)~3(d)是单子场内单图形的大空心微结构(相当于2~3 倍成熟细胞尺寸),主要包括三角形、四角星、五角星和六边形,设计边宽为7 μm~10 μm。本实验中,采用的物镜放大倍数为50 ×,数值孔径为0.8,一个子场的实际尺寸为311.2 μm×233.4 μm。在图形设计时,微图案的设计尺寸不能大于一个子场的尺寸。投影光刻中,设置曝光功率为40 mW~50 mW(出光口),曝光时间为700 ms。图3(e)~3(h)是投影曝光得到的微图案结构的SEM 图。从图中可以看出,曝光得到的水凝胶微图案具有良好的保真度,结构表面平整光滑,边缘清晰,图3(i)~3(l) 是图3(e)~3(h)的局部放大图。

图3 大尺寸微结构SEM 图像。(a)~(d) 大尺寸微结构设计图;(e)~(h) 拼接得到的大尺寸微结构SEM 图像;(i)~(l) 大尺寸微结构的局部放大图Fig.3 SEM images of large-size microstructures.(a)~(d) The designed pattern of large-size microstructures;(e)~(h) SEM images of large-size micropatterns;(i)~(l) Enlarged local details of large-size micropatterns
3.1.2 小尺寸微结构
对于细胞来说,如果图案化基本单元尺寸远大于细胞,图案化基底对单个细胞的调控效应不显著。考虑到这一现象,我们仿陷窝设计并制备了一系列小尺寸的多角形和多角星微图案。每个子场内包含3 ×3 个基本图形单元,每个图形单元尺寸接近成纤维细胞,其空心模拟陷窝设计。图4 是在不同曝光参数下获得的微图案结构的SEM 图像。其中图4(a)中微图案的曝光功率为50 μW~60 μW(物镜前),单次曝光时间为700 ms,该条件下完成8 mm × 8 mm 面积的图案化只需要40 min。微图案具有完整的几何形貌和清晰的边缘,图案尺寸同设计基本一致。
值得注意的是,由于图形单元尺寸较小,DMD芯片上对应的激光通道距离更近(单个子场内反射激光的白色图像部分更多,距离更近),激光光束之间的相互作用会对图案的成型产生影响。水凝胶基液态光刻胶,聚合前光刻胶体系是具有流动性的透明液体。图形尺寸小时,距离较近的几束激光辐照到光刻胶里面时,产生的自由基更多,由于光刻胶是液态,自由基更容易在内部扩散。不同微反射镜芯片对应的激光光束之间的相互作用会产生二次聚合,如图4 所示,多角星的角形随着角的数目增加而逐渐变圆,甚至在底部产生薄薄的黏连聚合。而在多边形微图案中,随着边数的增加,图案形貌也趋近于圆形。同时,在四边形和六边形中,微图案单元之间的黏连比较明显。
当增大曝光功率到120 μW~140 μW 时,延长曝光时间到1500 ms,获得的微结构的SEM 图像如图4(b)所示,只能观察到微图案大概的轮廓,空心部分边缘不清晰,且聚合不均匀,微图案分辨率和保真度都有所降低。进一步证明了自由基扩散和光在光刻胶中发生衍射是产生二次聚合的主要因素。以上研究结果表明,投影光刻的曝光剂量越大,二次聚合的影响也越大,就难以获得符合预期分辨率的微图案阵列,无法为细胞培养提供可控的地形线索,预示着在选择液态光刻胶的最佳曝光条件时,应该充分考虑图案的尺寸和布局。

图4 不同曝光条件下制备的小尺寸微结构。(a) 激光功率50 μW~60 μW,曝光时间700 ms;(b) 激光功率120 μW~140 μW,曝光时间1500 msFig.4 Small-size microstructures prepared under different exposure conditions.(a) Laser power is 50 μW~60 μW,exposure time is 700 ms;(b) Laser power is 120 μW~140 μW,exposure time is 1500 ms
3.2 浸润性能表征
由于基底表面微结构带来的地形变化对细胞的生长分布具有诱导作用,细胞的形貌变化与微结构的几何特征存在显著的相关性。研究表明,基底的亲疏水性对细胞在基底上的粘附、增殖、迁移也会产生影响[38]。因此,要了解图案化表面对细胞行为的诱导机制,还需要考虑微结构本身带来的基底表面浸润性的差异。我们分别制备了具有不同形貌的大尺寸和小尺寸空心微结构,并进行了接触角测试。每种微结构面积为8 mm × 8 mm。测试时,2 μL 的水滴以0.5 μL/s 的速度滴下,每个样品至少测五个点。接触角测试结果如图5 所示,图5(a)~5(h) 是各基底接触角测试的光学显微图像,图5(i)是各基底接触角的数值分析。从图中可以看出,玻璃表面的接触角平均值大约为72°(图5(a))。大尺寸微结构中四角星接触角最小,大约61.12°,三角形基底的接触角最大,为68.98°,均小于玻璃表面的接触角。小尺寸多角微结构中三角形和四角星接触角分别为64.3°、65.12°,略小于玻璃表面,五角星最大,为71.38°。以上数据表明,这些微结构对表面的浸润性能会产生一定影响。
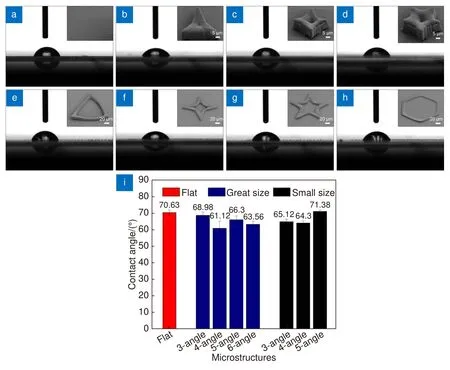
图5 不同尺寸微结构表面的(a)~(h) 接触角显微图像及(i) 接触角分析Fig.5 (a)~(h) The bright field images of contact angle and (i) contact angle analysis of microstructures with different sizes
3.3 微结构与细胞共培养实验
为了研究不同尺寸的微结构对细胞行为的影响,将成纤维细胞L929 培养在上述大尺寸和部分小尺寸微图案上48 h,观察细胞在不同尺寸微结构上的生长形貌和功能的变化。图6(a)是大尺寸微结构上L929细胞的共聚焦荧光显微图像,图6(b)是对应 SEM 图像,而图6(c)是6(b)的局部(白框标出)放大图。三角形和六边形空心面积大,对于单细胞而言,只能接触到其中一个边或者一个角,细胞这部分的铺展和粘附会受到边和角调控,但整体上还是同在平整的二维平面上生长类似。如六边形中细胞的一端片状粘附在边上,部分细胞的骨架布满整个边(白框部分),而在三角形中我们观察到细胞正在翻越三角形的一边,细胞膜被拉成薄薄的片状,紧裹在边上。四角星和五角星的空心面积相对较小,只允许少数几个细胞粘附,细胞生长过程中由于空间受限,和在空间较大的多边形内的细胞有明显的差异。如图中所示五角星的空心部分有三个细胞,四角星空心部分只有一个细胞。这两种微结构内的细胞与微结构的边、与其他细胞之间更容易产生交互作用。小空间带来的限位效应使得细胞的伸展度比在多边形中小很多,进而影响细胞行为和功能。此外,粘附在图案外围的细胞,则同二维平面上相差不大,这说明微图案的尺寸在调控细胞生长中至关重要。
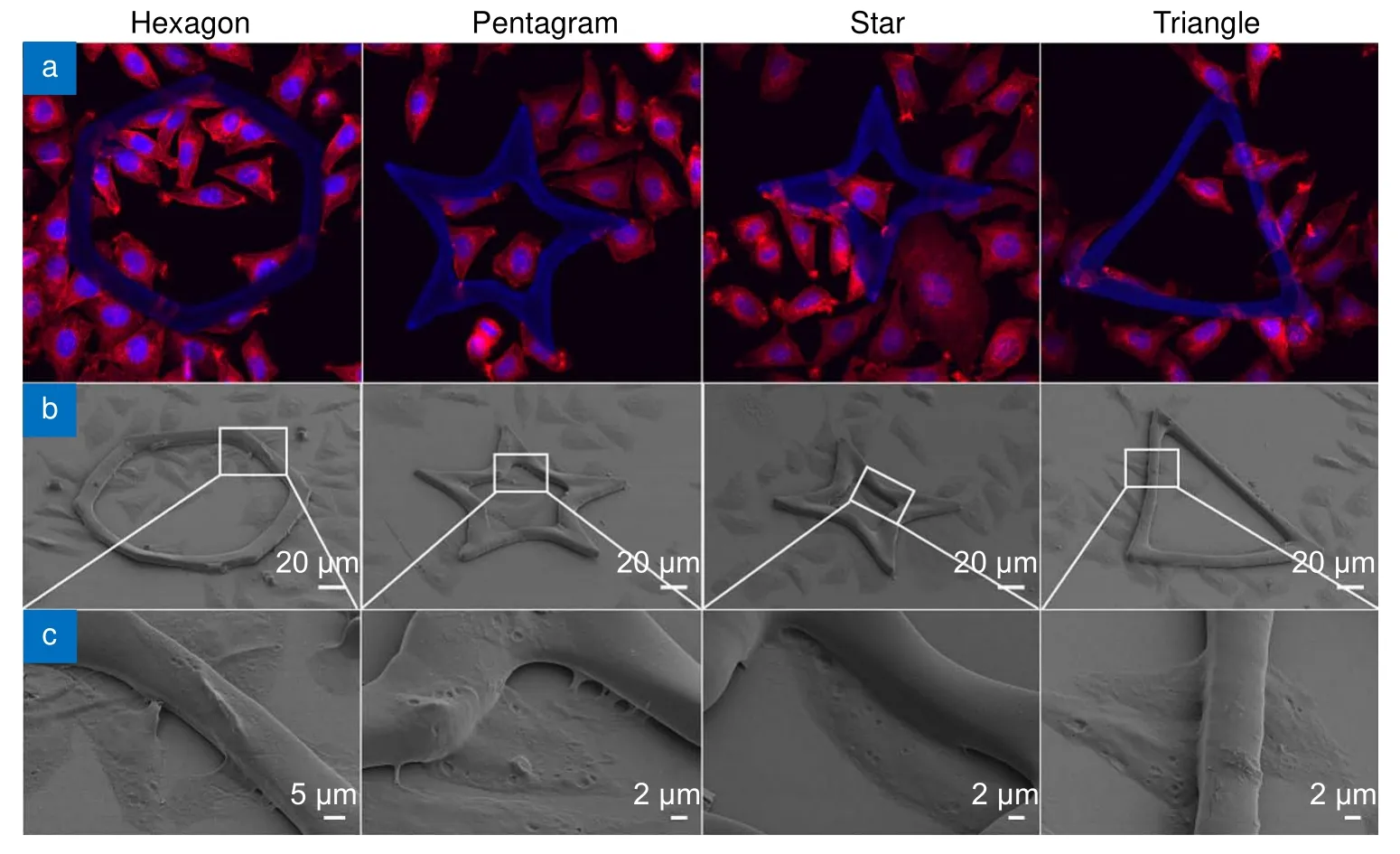
图6 大尺寸微结构细胞培养48 h 后的荧光及SEM 图像。(a) 共聚焦荧光显微图像,蓝色:DAPI 染色细胞核,激发波长405 nm,收集波段410 nm~460 nm,红色:ActinRed 555染色肌动蛋白,激发波长561 nm,收集波段570 nm~620 nm;(b) SEM 图及(c) 细节放大的SEM 图Fig.6 Fluorescence and SEM images of cells cultured on large-size microstructures after 48 h.(a) Confocal fluorescence images,blue:nuclei stained by DAPI,excitation wavelength is 405 nm,collected wavelength range is 410 nm~460 nm,red:actin stained ActinRed 555,excitation wavelength is 561 nm,collected wavelength range is 570 nm~620 nm;(b) SEM images and (c) magnified SEM images of local details
小尺寸微图案对细胞形貌的影响更明显,图7(a)、7(b)中单个细胞的肌动蛋白完全覆盖整个三角形和三角星,且沿着三个角延伸出去,细胞形貌和微图案一致。而细胞核则正好嵌在三角形和三角星的中心陷窝里,如图7(e)和7(f)所示。三角形具有较大的中心凹陷区,因此成纤维细胞的细胞核可以完整落入其中,而三角星的中心凹陷区则要小于细胞核。但在重力的影响下,最终细胞核会落入凹陷处并半嵌在其中。而在四角星上,也观察到细胞正向凹陷处迁移,细胞前端的肌动蛋白铺满了四角星的一角,越过凹陷向对角延伸(图7(c)),细胞的尾部还没来得及攀到上表面,但已经脱离了玻璃基底,并收起了丝状伪足(图7(g))。在五角星上,同样也观察到了细胞正在翻越微结构的边缘。细胞在小尺寸的多角微结构上的这种形貌适应性改变和分布,为调控细胞行为提供了科学依据。
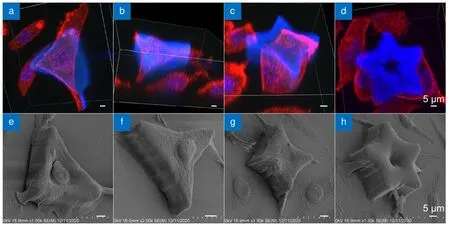
图7 小尺寸微结构细胞培养48 h 后的荧光及SEM 图像。(a)~(d) 三维的共聚焦荧光显微图像,蓝色:DAPI 染色细胞核,激发波长405 nm,收集波段410 nm~460 nm,红色:ActinRed 555 染色肌动蛋白,激发波长561 nm,收集波段570 nm~620 nm;(e)~(h) SEM 图Fig.7 Fluorescence and SEM images of cells cultured on small-size microstructures after 48 h.(a)~(d) 3D confocal fluorescence images,blue:nuclei stained by DAPI,excitation wavelength is 405 nm,collected wavelength range is 410 nm~460 nm,red:actin stained ActinRed 555,excitation wavelength is 561 nm,collected wavelength range is 570 nm~620 nm;(e)~(h) SEM images
4 结论
本研究中,我们利用飞秒激光无掩模投影曝光技术,结合液态生物相容性水凝胶材料,直接在液相环境中曝光,快速制备了不同尺寸和形貌的大面积空心微结构。细胞共培养实验证明,大尺寸三边形和六边形微结构空腔较大,除了同微结构的边框部分有交互作用外,细胞的生长同在平面上基本相同。大尺寸四角星和五角星结构空腔相对较小,只有两三个细胞大小,细胞在空腔内由于限位作用,形貌会受限,拉长度降低,方度增加,这说明通过控制微结构尺寸大小能有效调控细胞形貌。同时,在小尺寸的微结构上,我们观察到细胞核会落入中心凹陷,细胞骨架形貌则和微结构形貌保持一致,细胞在这种复杂微结构上的形貌自适应性改变和分布,为体外细胞接触诱导研究提供了一种新思路。
