类胡萝卜素生物利用率及其乳液递送体系研究进展
2022-03-16孙梦嘉邓乾春全双禹晓陈洪建陈亚淑陈春艳
孙梦嘉,邓乾春,全双,禹晓,陈洪建,陈亚淑*,陈春艳
(1.中国农业科学院油料作物研究所,农业 农村部油料加工重点实验室,油料 脂质化学与营养湖北省重点实验室,湖北 武汉,430062;2.湖北生物科技职业学院,湖北 武汉,430074)
类胡萝卜素是一类具有独特结构和功能的重要天然色素,在光养和非光养生物中广泛分布,目前已经有超过700 种天然类胡萝卜素被鉴定,其化学多样性非常丰富。类胡萝卜素在生物学中的重要性不言而喻。它可通过化学或酶转化成其他衍生物,如维生素A、植物激素或芳香类化合物等。由于维生素A缺乏症是全世界主要微量营养素缺乏症之一,对于类胡萝卜素的研究热点曾经主要集中在其作为维生素A前体物质方面。但是类胡萝卜素不止是天然着色剂和维生素A 前体,其更多用途已经引起不同学科领域的兴趣,如植物科学、农业、食品科学与技术、营养和健康等。流行病学研究表明富含类胡萝卜素的饮食(主要由水果和蔬菜组成)具有促进健康作用,同时有助于降低患某些癌症及心血管、眼睛、皮肤或骨骼疾病的风险,对认知功能也可起到改善作用[1]。由于类胡萝卜素无法通过人体自身合成,而是在食物中与其他分子如糖类、蛋白质或脂肪酸相结合从而被人体摄取,因此研究人体从膳食中摄取及吸收类胡萝卜素的效率及其影响因素至关重要。由于受到自身溶解性、稳定性等影响,单一摄入的类胡萝卜素无法较好地被人体吸收利用,而膳食来源类胡萝卜素如叶黄素,通常以酯化的形式存在于许多水果中。由于其溶解度与氧化稳定性的改变,类胡萝卜素在食品中的稳定性和人体内的生物利用率也发生变化[2]。膳食来源类胡萝卜素的功能特性启发了人们对类胡萝卜素食物来源、生物利用率及其作为功能性食品和营养补充剂方面的研究,其中新型运载类胡萝卜素食品级脂质递送体系的构建及其对类胡萝卜素生物利用率的影响等研究与实际应用值得关注。
1 类胡萝卜素结构功能及其生物利用率
1.1 类胡萝卜素的理化特性与功能活性
类胡萝卜素是人类发现的第一种天然色素,类胡萝卜素长链分子的主链通常是由9~11 个共轭C=C键构成,其线性链的长度对应于分子铆钉穿透膜的疏水区的厚度,从而在某些真菌与动物体内起到增强细胞膜脂质功能的作用[3]。尽管类胡萝卜素分子中存在双键,在大多数情况下存在重要的空间位阻,但仍可以形成多个几何异构体(顺/反或Z/E)。异构体顺式和反式的结构差异较大(图1),通常天然类胡萝卜素大多处于较为稳定的全反式构型,由于光或热等环境因素的影响极易引起异构化,产生不稳定的顺式类胡萝卜素[4]。类胡萝卜素通常根据分子组成分为两类:一类指在多烯主链的一端或两端有碳氢环的非极性类胡萝卜素(如β-胡萝卜素、番茄红素),另一类是指结构中具有含氧基团-OH(如叶黄素),=O(如斑蝥黄素),OH 与=O 的结合(如虾青素),或醇酯(如岩藻黄素)的极性类胡萝卜素[5]。在生物体所含天然磷脂双分子层膜中,分子两端带有羟基和/或氧基的极性类胡萝卜素如叶黄素,以垂直于磷脂膜表面的长轴方向定位于磷脂的极性头,将导致脂质烷基链的运动自由度降低,模型膜和生物膜中水和氧的通透性降低,这些效应被称为膜中的固化效应;而不含氧的β-胡萝卜素中对称的脂肪链与磷脂的非极性部分发生非共价结合,增加磷脂头极性基团的运动自由度,导致膜结构的流动性增强[5],因此类胡萝卜素的数量与种类是影响膜功能的重要参数[3]。类胡萝卜素的机械特性在进化后期用于保护蛋白质的相关结构,暴露的类胡萝卜素外部结构能够与蛋白质相互结合,从而对环境条件产生一定抵抗性[6];如橙色类胡萝卜素蛋白(OCP)由类胡萝卜素与蛋白相结合而成,参与蓝细菌的光保护机制[7],以上研究均表明了类胡萝卜素在光合作用与生物进化中的重要功能。

图1 β-胡萝卜素几何异构体的化学结构Fig.1 Chemical structure of β-carotene isomers
与此同时,类胡萝卜素中β-胡萝卜素、α-胡萝卜素,β-隐黄素等可作为人类饮食中维生素A 的重要来源,对人体健康至关重要[8],在改善人的眼睛和心脏健康方面起着关键性作用,并有助于增强大脑认知功能[9],预防皮肤癌变,防止紫外线损伤[10],有效增强婴幼儿营养健康,刺激免疫调节[11],以及形成转录、翻译基因组效应,发挥调节作用[12]。Yoshida 等研究发现类胡萝卜素能够通过降低低密度脂蛋白的生成与氧化,防止心脏病的发生[13]。Tanaka 等发现类胡萝卜素还能通过淬灭自由基来降低癌症的风险,并抑制异常细胞分裂,增强细胞间隙连接传递[14]。根据Chisté 等人的研究发现红细胞内氧合血红蛋白的自氧化产生的自由基,攻击红细胞膜并诱导脂质与蛋白质氧化损伤,导致红细胞溶血时,类胡萝卜素利用其可清除血液中自由基的特性,发挥其抑制溶血的功能[15]。总体而言,类胡萝卜素的主要优势和活性基础在于其较强的抗氧化活性[16],其共轭双键的多烯链长度是具有淬灭单线态氧且高效消除自由基的结构基础。分子中长P-电子系统具有较强的活跃性,能够显著提高类胡萝卜素自身的还原能力。同时,类胡萝卜素可与磷脂膜结合或溶解在其他脂质结构中,有效保护其完整结构,防止脂类因自由基氧化而发生不可逆破坏[8]。Stahl 等人研究还发现当番茄红素与叶黄素两种类胡萝卜素同时存在时,能够起到更好的清除自由基能力,表明类胡萝卜素清除自由基具有显著协同效应[17]。
1.2 类胡萝卜素的生物利用率
由于人体不能合成类胡萝卜素,只能通过饮食来补充,当其被人体从食物中摄入后,类胡萝卜素参与到其他膳食脂溶性成分的消化、吸收和代谢过程中。消化开始时,类胡萝卜素从食物基质中释放,通过进一步溶解在膳食的脂质中,乳化成胃液中的脂滴;然后在肠道中被转移至由脂质水解产物(主要是游离脂肪酸(FA)和单酰基甘油)、磷脂、胆固醇和胆汁盐(BS)组成的混合胶束(MMs)中。MMs 所含类胡萝卜素比例称为生物可及性(bioaccessibility),计算公式如下:
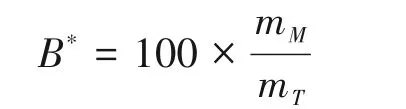
B*为类胡萝卜素生物可及性(%),mM是膳食混合胶束相中存在的类胡萝卜素的质量(g),mT是小肠中存在类胡萝卜素的总质量(g)。通过脂质转运蛋白或被动扩散过程,类胡萝卜素被小肠上皮细胞吸收,并以乳糜微粒的形式代谢和分泌到淋巴液中,血浆中类胡萝卜素浓度的比例通常称为类胡萝卜素生物利用率(bioavailability)[18]。生物利用率(BA)主要取决于三个因素,即生物可及性、吸收和转化:

S*是递送体系中类胡萝卜素的稳定性,指除去递送体系在加工及贮藏过程中损失的部分,即在摄入时以潜在保有活性保留的部分;T*是转化参数(指类胡萝卜素在通过胃肠道,达到吸收位点或者严格地说达到作用位点后仍留有活性的部分);B*为类胡萝卜素生物可及性,即从递送体系中释放并以适合吸收的形式溶于胃肠液的部分;A*是实际上可被上皮细胞吸收且能够被生物利用的类胡萝卜素的一部分[19]。基于对上述三个关键性因素的分析,可将影响类胡萝卜素生物利用率的因素进行分类研究,从而实现对其生物利用率的调控。
1.3 影响类胡萝卜素的生物利用率的因素
从上述可知,人体吸收利用食物中类胡萝卜素的过程极为复杂,涉及不同的理化与生理过程,不但受到类胡萝卜素自身性质与食物基质的组成、结构和性质的影响,还受到个体差异如肠道生理状态等综合因素的影响[18]。
1.3.1 类胡萝卜素理化特性 类胡萝卜素的吸收利用程度及其向靶细胞的传递均受到自身生理化学特性的影响[20],如部分类胡萝卜素的两端各含有羟基(如叶黄素、玉米黄质),分子中羟基极易与脂肪酸相互作用形成酯化形式的类胡萝卜素,从而导致其疏水性增强,进一步影响类胡萝卜素的生物利用率[19]。Charlotte 等人研究发现类胡萝卜素的生物利用率与其疏水性成反比关系,即类胡萝卜素的生物利用率可排序为虾青素>叶黄素>β-胡萝卜素>番茄红素,其内在分子机理可能是由于类胡萝卜素从脂滴转移到胶束的过程依赖其自身极性,极性相对较强的类胡萝卜素(叶黄素)与非极性类胡萝卜素(番茄红素和β-胡萝卜素)相比更容易通过脂滴外表面,也更容易转化为混合胶束,因此更容易被吸收,从而具有更高的生物利用率[21]。
Schweigger 等人在模拟消化过程中,芒果和木瓜中以脂溶性液晶形式积累的β-胡萝卜素和叶黄素的释放与胶束化率(即生物可及性)超过了番茄和胡萝卜中以固态结晶形式存在的类胡萝卜素[22],这说明类胡萝卜素的晶体状态对其生物利用率影响较大,液晶形式的类胡萝卜素比固态结晶态具有更高的生物可及性,同时进一步研究发现这四种植物食品中的类胡萝卜素胶束化的效率也与它们的亲水性呈正相关,即生物可及性排序为叶黄素>β-隐黄质>β-胡萝卜素>番茄红素,说明存在于复杂食品基质中的类胡萝卜素晶体状态与亲水性对其生物可及性均有显著影响[23]。二十几年前,West 和Castenmiller 首次对影响膳食类胡萝卜素吸收的众多因素进行了分类研究[24],时至今日越来越多的国内外研究均表明,除了类胡萝卜素自身分子结构的影响之外,还有更多外部环境因素亦会对类胡萝卜素的生物利用率产生影响。
1.3.2 食品加工 在食品加工过程中,食品基质理化性状、烹饪方式均会对类胡萝卜素生物利用率产生影响,植物中类胡萝卜素的生物可及性与其结构差异及其理化性质相关,进而影响其生物利用率。富含类胡萝卜素的天然基质(蔬菜、水果)内部单个细胞壁和相邻细胞簇起着天然屏障的作用,限制类胡萝卜素在消化期间从膳食脂滴中释放。因此通过多种加工方式对蔬菜水果类天然食品基质进行处理,利用破坏细胞壁/膜和细胞器的加工方式促进类胡萝卜素从基质中释放,提高类胡萝卜素的生物可及性,同时补偿其在加工与消化过程中氧化降解造成的损失,从而提高类胡萝卜素的生物利用率。
国内外多项研究结果表明,在热加工(烘烤或蒸煮)或非热加工(超声波处理或高压均质)之后,类胡萝卜素的生物可及性受到影响(表1)[25~33]。研磨和蒸煮可通过破坏细胞壁结构来增强β-胡萝卜素从植物结构中释放,提高其生物利用率[29,30]。Yonekura 和Nagao 研究发现,将胡萝卜加工成胡萝卜汁或煮熟胡萝卜食用,β-胡萝卜素能较好的从食物基质中释放,有利于其在肠道内被人体吸收利用,因而具有更高的生物利用率;而生食的胡萝卜进入胃部后,胃液酶不足以破坏胡萝卜完整的细胞结构,从而影响β-胡萝卜素的释放和吸收[33]。另外一项体内实验发现,人体服用含有类胡萝卜素的营养补充剂后,其类胡萝卜素的生物利用率高于水果和蔬菜天然基质中的类胡萝卜素,进而表明经过破壁提取等加工方法能有效提高类胡萝卜素生物利用率[32]。Castenmiller 等人研究食用三种加工方式(整叶,切碎和酶液化形式)的菠菜产品后血清类胡萝卜素的含量,发现三种方式加工的菠菜均会显著增加血清β-胡萝卜素和叶黄素的浓度;摄入切碎的菠菜可显著增加血清β-胡萝卜素的含量(6.4%),而食用酶液化的菠菜则进一步增加至9.5%,结果显示切碎或酶液化过程是提高β-胡萝卜素生物利用率的有效加工方式[24]。
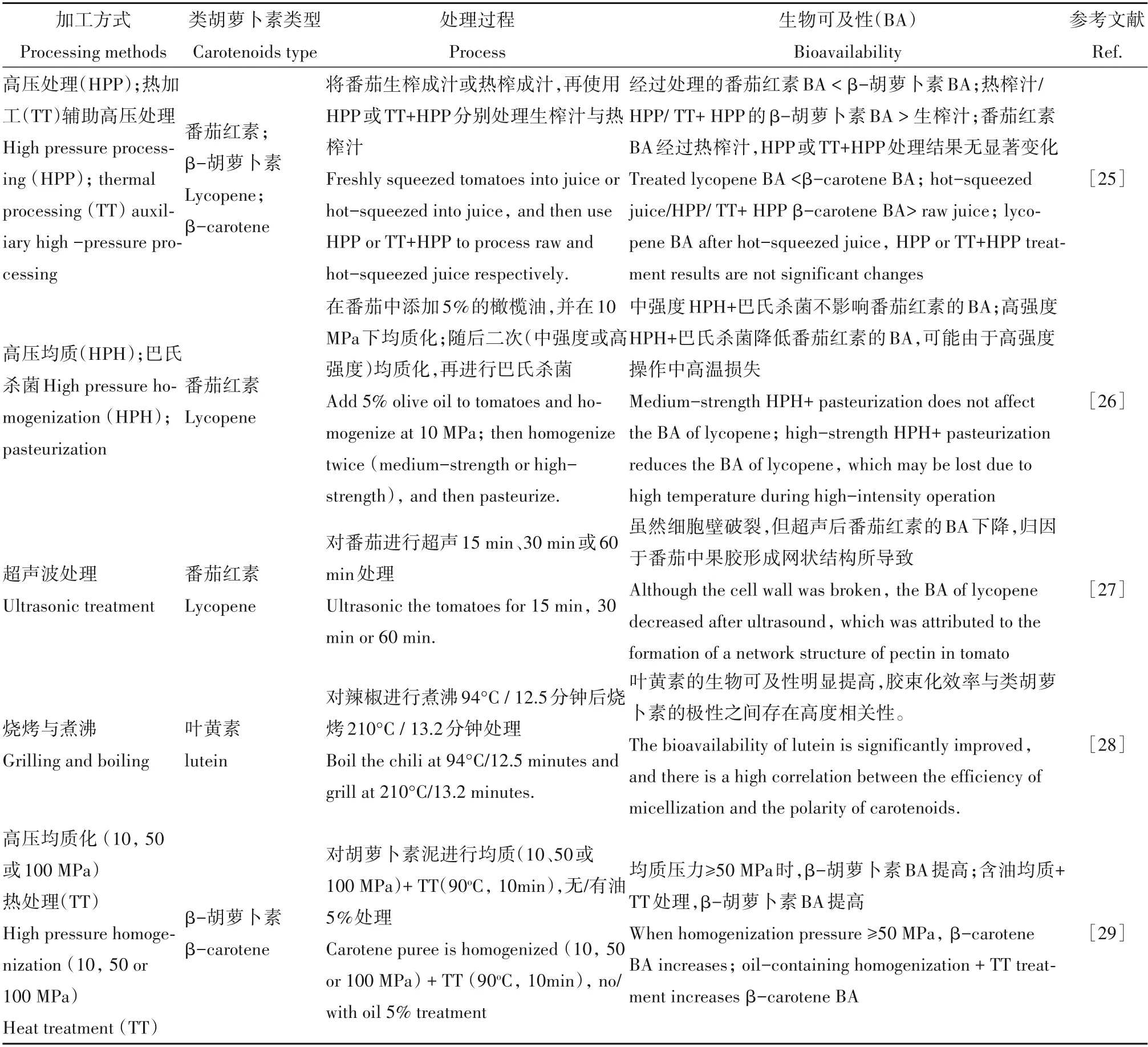
表1 食物加工方式对类胡萝卜素生物可及性的影响Table 1 Effects of food processing methods on the bioavailability of carotenoids
1.3.3 脂质 与膳食脂肪共同摄入能提高类胡萝卜素生物利用率与消化吸收[30]。脂质可以通过以下几种机制调节类胡萝卜素的吸收利用:膳食脂肪作为载体,其中从食物基质中释放的类胡萝卜素和其他亲脂成分被溶解;膳食脂肪刺激脂肪酶、胆汁盐和磷脂分泌到肠腔中,类胡萝卜素以消化脂滴的方式形成混合胶束,溶解在肠腔环境中[31];膳食中较高的脂肪摄入延迟了胃排空与通过小肠的转移速率,从而为进入混合胶束中的脂肪酸(FA)、类胡萝卜素、单酰基甘油酯和溶血磷脂的释放以及溶解提供了额外的时间[32];通过肠细胞摄取脂质消化产物,特别是长链脂肪酸和线性乳酸诱导乳糜微粒的组装与基底物的分泌量,并将膳食亲脂性成分转移至淋巴细胞[33]。
大量关于饮食脂质的类型和数量对类胡萝卜素生物利用率的影响研究,证实了脂类在类胡萝卜素吸收利用过程中的重要作用。Goltz 等人设计的体内实验中,在同时摄入含有多种水果蔬菜以及脂质制作的西式沙拉后测量类胡萝卜素的吸收量,参试的健康人员分别摄入大豆油、黄油和菜籽油(3、8或20g 油脂)。当受试者同时摄入沙拉和20g 脂质时,其总类胡萝卜素吸收量与摄入3g或8g相比显著提高。尽管脂质来源对类胡萝卜素的吸收作用的影响小于脂质含量,但研究发现与黄油相比,菜籽油(富含不饱和脂肪酸FA)能更大程度地促进类胡萝卜素的吸收,这表明不饱和度较高的脂质可能更利于类胡萝卜素吸收[34]。为进一步研究类胡萝卜素在体内消化吸收的机制,研究者们使用相同的沙拉进行了相关体外实验。在模拟小肠消化过程中,富含不饱和脂肪酸的脂质增加了小肠消化过程中β-胡萝卜素(βC)和番茄红素(LYC)的胶束化作用和细胞摄取率(排序为:大豆油>橄榄油>菜籽油>黄油)。Faill 等人测定饮食中甘油三酸酯类型对类胡萝卜素摄取和基底外侧分泌的影响,模拟实验将不同饱和与不饱和FA 比例的游离脂肪酸(分别模拟黄油(70∶30),橄榄油(7∶93)和大豆油(11∶89)与β-胡萝卜素,α-生育酚(α-TC)形成的混合胶束,与Caco-2 细胞混合温育,结果表明与富含饱和FA 的混合物相比,含有较多不饱和FA 的混合胶束培养物中,亲脂性成分的刷状缘膜吸收量更大,这与不饱和FA 诱导乳糜微粒组装的能力有关;该研究指出摄入富含不饱和脂肪酸的膳食脂质能够通过增强消化和肠道转运过程中的胶束化作用,来提高类胡萝卜素和α-生育酚的生物利用率[35]。Xavier等人研究发现在半脱脂和全脂牛奶的模拟消化过程中,添加在几种全脂乳制品中的叶黄素酯水解程度大于脱脂乳及其酸奶制品中,这类游离叶黄素的产生可有助于提高叶黄素的生物利用率[36]。
1.3.4 膳食纤维 膳食纤维可以作为功能性成分添加到乳液体系中,改变其理化特性(作为增稠剂、胶凝剂或稳定剂)或营养特性(作为益生元,改善便秘或降低血胆固醇)。膳食纤维是影响胶束化阶段的因素之一,其可能通过以下几种机制影响类胡萝卜素的吸收:(1)通过螯合胶束组分,影响胶束的形成;(2)通过抑制胰腺脂肪酶,可能会减少类胡萝卜素从脂滴中释放;(3)通过增加肠内容物的粘度,削弱富含类胡萝卜素的胶束向刷状边缘的扩散[37]。
膳食纤维中代表性的果胶可通过不同的机制对类胡萝卜素生物可及性产生较大影响,例如果胶可与钙离子结合,同时增加胃肠介质的粘度,也可改变油滴的界面特性以及抑制脂肪酶的活性,还能够通过空间位阻降低脂肪酶接触底物的几率。这些相互作用通常会对类胡萝卜素的生物可及性产生负面影响,减少胶束的形成,或将类胡萝卜素吸附到果胶中。果胶与类胡萝卜素相互作用的程度主要取决于果胶的浓度、分子量(MW)和甲基酯化程度[38,39]。果胶浓度越高,类胡萝卜素的胶束化程度随之显著减少,而低浓度果胶可通过酯化的方式结合胆汁盐,减少脂解作用促进类胡萝卜素的胶束化[40]。其他类型的膳食纤维,例如纤维素、瓜尔胶和藻酸盐,也会通过增加肠内容物的粘度来降低类胡萝卜素的生物利用率,但其相关机制仍待进一步研究[41]。
1.3.5 蛋白质 使用蛋白质作为表面活性剂已经应用于乳液及递送体系的构建,但除了对乳制品的研究以外,仍然缺乏有关蛋白质作为食物成分影响的相关数据。乳清蛋白可能对类胡萝卜素的生物可及性具有积极影响,因为乳清蛋白消化产生的磷酸肽能够降低界面张力,并防止胶束聚结[42]。由于β-乳球蛋白能够与疏水性化合物类胡萝卜素相结合,可将它们转运到肠细胞的刷状缘膜,增强其生物利用率[43]。同时,蛋白质对类胡萝卜素消化吸收可能具有双刃剑作用,因为它们的存在可能会阻碍消化酶进入脂滴,对类胡萝卜素的释放造成不利影响。
1.3.6 二价矿物质 近期研究表明影响类胡萝卜素生物可及性和细胞摄取的另一个饮食因素是二价矿物质,其在膳食补充剂中的浓度通常为推荐的膳食允许摄入量(RDA)的一半以上。过量的膳食二价矿物质可能会通过与胆汁酸结合,并在消化过程中与FA 相互作用而减少胶束的形成,降低类胡萝卜素的生物可及性[44]。人体试验也表明了二价矿物质对类胡萝卜素吸收的潜在负面影响,通过血浆含量测定,含500 mg 钙的膳食补充剂可显著降低番茄酱中番茄红素的吸收量(最多可减少83%)[45]。人体试验也表明了二价矿物质对类胡萝卜素吸收的潜在负面影响,通过血浆含量测定,含500 mg 钙的膳食补充剂可显著降低番茄酱中番茄红素的吸收量,最多可减少83%[46]。矿物质的作用具有浓度依赖性,与不含二价矿物质相比,低浓度的二价矿物质可加强类胡萝卜素的增溶作用[47]。虽然在目前多数研究中,关于体内测定实验的结果暂时不能排除其他因素,如类胡萝卜素的结构和基质组合物等的影响,但结果表明低浓度的二价矿物质能够起到增强类胡萝卜素溶解性的效果[48]。
1.3.7 个体消化过程 从食物基质中释放出的类胡萝卜素与混合胶束结合后,被人体肠上皮细胞吸收。在口腔中,被咀嚼的食物通过食道运输到胃部,全过程对脂质消化和类胡萝卜素的生物利用率有重要影响。由于该途径促进了食物的机械破坏及与消化酶的接触,进一步加速食物中类胡萝卜素的释放,使脂质的消化效率提高,从而增加类胡萝卜素的生物利用率。咀嚼包括用唾液润滑、软化和稀释,以及形成粘性丸的过程,其能够破坏类胡萝卜素的有色体膜并决定其释放。口腔中牙齿同时大力挤压和温柔挤压具有差异性,研究发现咀嚼对蔬菜细胞结构有较大的影响。另一方面,可以通过咀嚼改变食物的质地来影响饮食,从而影响水果和蔬菜的摄入量,进一步影响生物利用率。口腔的唾液淀粉酶水解食物中的淀粉,而胃液中的酸与胃蛋白酶主要促进蛋白质的消化,从而增加了食物基质中脂质和类胡萝卜素的释放。经过口腔和胃消化阶段后,脂肪的消化率不足10%[49]。在此阶段释放的类胡萝卜素进入脂滴,而脂滴的理化性质易受到在口腔和胃部的脂质与盐、酸、粘蛋白、胃脂肪酶和胃蛋白酶等其他分子之间相互作用的影响而改变,导致类胡萝卜素在消化过程中受损。
吸收过程根据β-胡萝卜素加氧酶1和2(BCO1和BCO2)的细胞定位表明,类胡萝卜素的主要吸收部位在十二指肠(肠道上半部)[50]。类胡萝卜素可在肠上皮细胞中代谢,或跟其他新吸收的脂质(脂肪酸,甘油单酸酯,胆固醇等)一起进入乳糜微粒中,再分泌到淋巴中,这些过程均会造成类胡萝卜素损失,进而导致生物利用度降低(图2)。人体内还可能存在另一种类胡萝卜素的代谢途径,研究证实,由于在HDL(高密度脂蛋白)中发现了一些类胡萝卜素,并且由于小肠合成了HDL,HDL 可以转运其他新吸收的脂质分子,即胆固醇和维生素E ,因此可以假设一部分类胡萝卜素分泌到淋巴或门静脉中HDL(载体脂蛋白A 依赖性途径),该途径涉及基因ABCA1(人类转运蛋白亚家族1 号成员)。在小鼠体内模型中,分别通过上调与下调基因ABCA1 的表达(使用他汀类药物),结果发现血液中HDL 形式的血浆叶黄素和玉米黄质的浓度随之发生增加或降低的变化趋势[51]。
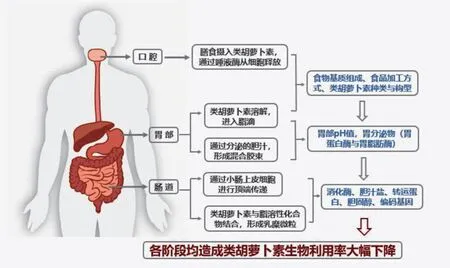
图2 从食物基质中摄入类胡萝卜素至类胡萝卜素吸收的全过程中对类胡萝卜素生物利用率产生影响的途径[52]Fig.2 The pathways that affect the bioavailability of carotenoids from the intake of carotenoids to the absorption of carotenoids in the food matrix[52]
2 乳液递送体系对类胡萝卜素生物利用率的影响
2.1 乳液组成对类胡萝卜素生物利用率的影响
2.1.1 油相组成与含量 食物中的脂质会影响消化后小肠中产生混合胶束的数量,从而影响胃肠液的溶解能力,乳液的制备可涉及多种食品级脂质,包括三酰基甘油(TAGs)、二酰基甘油(DAG)、单酰基甘油(MAG)、矿物油、调味油等,它们的极性、增溶能力、粘度、物理状态和消化特性各不相同。乳液组成中油相的含量会一定程度影响其中类胡萝卜素的溶解量,以及其在胃肠道(GIT)中的保留、释放和胶束化[53]。即使在固定含量的脂质中,油相性质也可能存在较大差异,进而影响类胡萝卜素的生物利用率。类胡萝卜素原本存在于不同种类的水果或蔬菜(例如胡萝卜、木瓜或菠菜)中,通过添加不同含量的橄榄油混合后进入胃中形成乳液,类胡萝卜素的生物可及性随含油量增加至2.5%而提高5 倍,这是由于从膳食中能够利用更多的类胡萝卜素进入混合胶束来使其溶解。当油相含量同为2.5%的情况下,含有橄榄油、大豆油、葵花籽油、花生油、棕榈油和椰子油的乳液中,β-胡萝卜素乳液的生物利用率分别为22.6%、24%、22.6%、16.0%、15.0%和7.8%,含椰子油(主要包含中链脂肪酸MCT)的乳液中类胡萝卜素的生物利用率始终比其他油更低,是由于椰子油中脂肪酸烃链的长度相对较短,脂质消化后形成的混合胶束的疏水域相对较小,无法包埋较长的类胡萝卜素分子所导致[54]。
2.1.2 水相组成 用于制备水包油乳液的水相可能包含多种组分,如矿物质、多元醇、糖类、肽、蛋白质和表面活性剂等。这些成分可能会通过改变胃肠道中的液滴特性(如界面特性或聚集状态),干扰消化酶及消化中涉及的胆汁盐或钙离子等其他成分与类胡萝卜素的相互作用,也可通过改变胃肠道中的表面电势等液滴特性来改变其生物利用率。
乳液递送体系通常使用的乳化剂之一蛋白质,主要溶解于水相并影响类胡萝卜素的消化及生物利用率。通常蛋白质在消化过程中能够被胃液中的胃/胰蛋白酶全部或部分水解并进一步被消化吸收;另一方面,蛋白质和肽易在胃肠道的不同区域内聚集,或者吸附到脂质液滴表面并改变其界面特性,与非蛋白类表面活性剂包裹的脂滴相比,蛋白包裹的脂滴消化速度较慢,这是由于蛋白脂滴在模拟胃液条件下会大量聚集,从而降低了脂肪酶到达内部脂滴的能力,因此影响脂滴中类胡萝卜素的消化效率[55]。
水相中最常见的碳水化合物之一膳食纤维,能够通过不同的机制影响乳液中类胡萝卜素的胃肠道消化情况。首先,它们可能会使胃肠液增稠或凝胶化,从而减慢分子扩散并阻碍各组分混合,导致胆汁盐和消化酶等胃肠道成分更难以接触脂滴表面。其次,膳食纤维可能通过静电吸引等方式在脂滴周围形成界面层,抑制胆汁盐和消化酶附着在液滴表面的能力,降低了乳液中脂质消化的速率,从而对类胡萝卜素的消化产生负面影响[56]。Xu 等人研究表明将甜菜果胶添加到乳清蛋白稳定的乳液中,会降低包埋β-胡萝卜素的生物可及性[57]。Zhang 等人研究发现大豆蛋白乳液中添加壳聚糖能够降低脂质消化及类胡萝卜素的生物可及性[58]。表2 总结了类胡萝卜素乳液组成差异对其生物可及性影响的现有研究,进一步阐述乳液水/油相组成对类胡萝卜素生物利用率的影响。

表2 类胡萝卜素乳液组成及生物可及性Table 2 Carotenoids emulsions composition and bioaccessibility
2.2 乳液性质对类胡萝卜素生物利用率的影响
2.2.1 乳液粒径 根据不同的乳化成分与方法可制备出不同粒径的乳滴,而乳液粒径可以通过多种机制改变类胡萝卜素与脂质的消化及其生物利用率,因为粒径会改变油滴暴露于胃肠液中涉及消化的成分,如胆汁盐,脂肪酶和蛋白酶等的表面积。同时乳液脂滴可能在口腔或胃内聚集(凝结或絮凝),形成较大尺寸的脂滴从而减少小肠中脂肪酶与脂质接触的表面积,不利于类胡萝卜素的消化[64]。对负载β-胡萝卜素的酪蛋白酸盐水包油乳液研究发现,脂质消化率和类胡萝卜素的生物可及性随粒径的减小而增加[61]。吐温20 作为乳化剂且负载β-胡萝卜素乳液研究也表明,脂质消化的程度和类胡萝卜素的生物可及性随着乳液粒径的减小而增加[65]。
2.2.2 液滴状态 水包油乳液中的脂滴可以是液体、半固体或固体,具体取决于所用油相的理化特性。油相的物理状态可对脂质消化和生物利用率产生显著影响。研究表明,在模拟的小肠条件下,固体或半固体脂滴的消化速度比液体脂滴的消化速度慢[66],因为晶体结构的高度有序性使得脂肪酶更难以接触油滴表面三酰基甘油(TAGs)中的酯键[67]。另一种可能的解释是由于部分结晶的脂滴易于发生聚集,从而导致在胃肠道(GIT)中形成聚集的脂滴簇,导致胃肠液中的脂肪酶分子更难以接触内部的脂滴[68]。两种非离子表面活性剂Poloxamer 188 和Tween 20 制备的类胡萝卜素乳液,当脂滴为液体时,消化速率比固体更快,且其中类胡萝卜素具有更高的生物利用率[69],以上研究均表明通过改变乳液中脂滴的物理状态可调控脂质的消化与类胡萝卜素的生物利用率[70]。
2.2.3 界面性质 乳液中脂滴被界面层覆盖,界面层特性随着乳化剂和其他表面活性物质的类型而变化。例如组成、厚度、流变性、凝聚性、疏水性和电荷可能会发生很大变化,从而影响其在胃肠道的吸收利用。界面性质可以通过使用不同种类的乳化剂或使用界面工程方法来改变,例如结合、逐层沉积或颗粒吸附等方式[71]。如果液滴被表面活性高的乳化剂包覆,那么胆汁盐和脂肪酶可能难以取代原始的乳化剂并进入脂滴。根据所用表面活性剂的性质,脂质消化的速率和程度存在显著差异,表明其对于控制脂质消化是有效的。Zhang 等研究乳化剂类型对胃肠道中脂滴的影响发现,在含有三种不同乳化剂即酪蛋白酸钠、乳铁蛋白和吐温80的乳液中,脂质消化表明酪蛋白酸钠液滴的脂质消化速率最慢,归因于酪蛋白酸钠包覆的脂滴在胃部高度聚集,从而抑制了脂肪酶进入液滴的能力[72]。Amelia 等人比较了表面活性剂Pluronic F68 和卵磷脂乳液的脂质消化率,发现吸附到液滴表面的Pluronic F68 更有效地抑制脂质消化,可能是由于其抑制胆汁盐和脂肪酶的结合造成[73]。另一方面,如果液滴被牢固交联的界面层覆盖时,也可能很难与胆汁盐和脂肪酶结合,因此,通过控制油滴周围覆盖的界面层性质可实现对脂质消化以及类胡萝卜素生物利用度的调控。Liu 等人研究在模拟的GIT 条件下,多酚-蛋白质-碳水化合物络合物包裹的脂滴比单独蛋白质包裹的液滴更稳定,这些络合物通常通过共价连接的方式将两个或多个分子组成两亲性分子来控制脂滴在胃肠道的转运,同时三元体系有效防止类胡萝卜素降解,并能够提高其生物可及性[74]。利用静电沉积方法形成乳液可以改变脂滴的界面性质,将带电荷的生物聚合物沉积在带相反电荷的脂滴表面,可重复多次此过程,在脂滴周围形成多层生物聚合物膜,从而可以控制界面性质。Zhang 等人研究表明通过静电沉积将阴离子海藻酸盐和阳离子壳聚糖组成的生物聚合物与大豆分离蛋白形成较厚的界面层,与制备出的负载类胡萝卜素的大豆蛋白单层乳液相比,生物聚合物层的厚度增加,乳液的理化稳定性增强,保护类胡萝卜素在胃肠道的降解,进一步提高其生物可及性[58]。
2.3 常见类胡萝卜素乳液递送体系的构建与其生物利用率研究
2.3.1 β-胡萝卜素乳液递送体系 β-胡萝卜素这类碳氢类胡萝卜素生物利用率一般低于含氧类胡萝卜素(如叶黄素和玉米黄质),这主要由于后者极性更大,更容易进入胃肠道内的胶束,从而更容易被肠细胞吸收,为提高不含氧类胡萝卜素生物利用率,需要通过利用亲脂性类胡萝卜素从乳液递送体系的释放动力学原理、溶解度和界面特性来实现β-胡萝卜素的靶向高效释放[75]。
Cheng 等人利用高压均质法,分别使用β-乳球蛋白与Tween 20 为乳化剂,橙油作为油相的条件下,制备出β-胡萝卜素纳米乳液,其粒径较小且稳定性良好,β-乳球蛋白纳米乳液中的β-胡萝卜素降解速率比Tween 20 纳米乳液缓慢[76]。SALVIATRUJILLO 等人研究通过将0.5%(m/m)β-胡萝卜素分散到载体脂质MCT 或LCT 中,使用超声辅助加热制备油相,将1.5%(m/m)Tween 20乳化剂分散在缓冲液中来制备水相。使用高速剪切机混合,以10 000 r/min将油相(4%,m/m)和水相(96%,m/m)混合制备粗乳液。最后使粗乳液以9000 psi 压力,循环三次通过微射流。结果成功制备出富含β-胡萝卜素的食品级纳米乳液,在模拟消化过程中,油相中含有不同比例的中链脂肪酸(MCT)和长链脂肪酸(LCT)的纳米乳液的结果类似,消化后粒径和负电荷显著增加。随着LCT 含量的增加,β-胡萝卜素生物利用率提高,整个消化液和混合胶束中乳滴负电荷增加,这归因于长链脂肪酸在乳滴表面的积累[77]。
Rao 等人使用蔗糖单酯和卵磷脂作为混合乳化剂,玉米油、柠檬油作为脂质消化阶段的油相,通过高压均质法制备β-胡萝卜素乳液。所有的乳液在口腔、胃和小肠条件下都发生液滴聚集,随着可消化乳滴的增加,小肠中游离脂肪酸含量增加,β-胡萝卜素的生物可及性随着含油量的增加而提高[78]。Meng等人制备出茶多酚-β-胡萝卜素(TP-BC)水包油(O/W)纳米乳液,其油相含β-胡萝卜素(BC),水相含茶多酚(TP)。在三种不同温度(4、25 和35℃)存储期间,TP-BC 纳米乳液比BC 纳米乳液具有更好的稳定性及更高的β-胡萝卜素保留率。体外模拟消化试验表明,在消化阶段TP-BC纳米乳液的β-胡萝卜素回收率与BC 纳米乳液相比显著增加,结果表明含有TP 的乳液能够有效防止β-胡萝卜素降解,改善了模拟口腔和胃消化后BC 的保留率。在体内吸收研究表明,与BC 纳米乳液相比,TP-BC 纳米乳液对维生素A 的转化效率更高,结果表明茶多酚可作为提高BC 乳液口服生物利用率的有效成分[79]。
2.3.2 虾青素乳液递送体系 虾青素作为亲脂性类胡萝卜素,在非极性溶剂中的溶解性较低。由于虾青素结构中每个末端都有两个羟基,每个羟基都能够连接一个脂肪酸相互作用形成酯,因此具备较强的疏水性,另外由于含多个不饱和共轭双键的结构,极易受到加工与储存过程中光、温度和氧气含量的变化引起降解和褪色,导致其原有的生物活性丧失,生物利用率降低。因此通过合理设计乳液递送体系的水相与油相类型、比例,调节乳液粒径、界面特性等因素,实现对虾青素包埋的同时,可提高其稳定性与生物利用率。
研究发现,Shu 等人使用天然表面活性剂人参皂苷,制备了一种热稳定负载虾青素的纳米乳液,粒径约125 nm,发现增加表面活性剂浓度和均质压力能够提高虾青素的稳定性[80]。Liu 等人成功地将虾青素包埋在乳化剂为酪蛋白酸钠(SC)、油相为长链甘油三酯(LCT:亚麻籽油,橄榄油和玉米油)的纳米乳液。与含有虾青素的传统粗乳液相比,负载虾青素纳米乳液形成粒径更小且带强负电荷的稳定体系,具有较高的生物可及性。另外,通过LCT 消化产生的混合胶束中虾青素的比例即生物可及性更高[81]。Pan 等通过膜分散超声波方法设计了一种包埋虾青素的纳米乳液,其包封率高达97.5%,粒径为80.3nm 的纳米乳液体系结构完好,且有效地提高了负载虾青素的脂质载体的耐热性和分散性[82]。
Khalid 等研究乳化剂类型对负载虾青素纳米乳液的稳定性和生物可及性的影响。使用改性卵磷脂(ML)和酪蛋白酸钠(SC)分别制备纳米乳液,在高浓度NaCl 溶液中储存一个月期间,与ML 纳米乳液相比SC 纳米乳液理化稳定性更好,在改性卵磷脂(ML)纳米乳液中虾青素的生物可及性为33%显著高于在酪蛋白酸钠(SC)纳米乳液中虾青素的生物可及性(6%)[83]。
Affandi 等研究了不同表面活性剂对负载虾青素的纳米乳液在储藏90 天时间内的稳定性及物理化学特性的影响,从而获得优化的制备方法;上述纳米乳液的粒径分布取决于均质压力或循环次数以及所选表面活性剂(卵磷脂或吐温80)的类型和浓度,以上研究中制备虾青素乳液的最优条件为2%虾青素和4%表面活性剂在9000 r/min 均质(约5 min),在ML 纳米乳液中虾青素的生物可及性为33%[84]。
2.3.3 番茄红素乳液递送体系 番茄红素含有11个共轭双键和多个不饱和烯烃的直链结构,因此它对加工条件非常敏感,易于氧化降解或顺反异构化,从而导致番茄红素生物利用率较低。由于番茄红素亲脂性较强,化学稳定性差且生物利用率低,其主要以微结晶的形式存在于细胞中,因此细胞壁是阻止番茄红素释放的结构性屏障,而乳液递送体系利用高压均质或微射流技术,机械破坏细胞壁的同时添加油相促进番茄红素的吸收,进一步提高其生物利用率。
Ax K 等人研究了番茄红素在乳液中的降解动力学,在不同的贮藏温度与氧气浓度下,番茄红素的降解均遵循一级动力学反应模型;高温会显著增加番茄红素的降解;同时研究发现与油相含50%的玉米油乳液相比,100% 橙油乳液中番茄红素生物利用率显著更高[85]。Salvia-Trujillo 等人将胡萝卜制成泥与不同粒径的赋形剂乳液(0.17 μm,0.46 μm,10 μm)混合,结果表明,赋形乳液能够显著提高番茄红素的生物利用率,且类胡萝卜素的生物利用率随着乳液粒径的增大而降低[86]。
Jain 等人研究中使用改性大米淀粉合成了两种不同的递送体系,即水包油乳液和海藻酸盐珠,用以改善番茄红素的稳定性。在不同温度(4~70℃)下存储15d 期间,发现番茄红素的降解速率随温度升高而增加,将递送体系通过模拟胃肠道(GIT)模型以研究脂质消化的程度和番茄红素的生物可及性。结果表明脂质消化的速率和程度与番茄红素的生物可及性之间呈正相关。乳液(20.2%)比海藻酸盐珠(15.6%)的番茄红素具有更高的生物可及性[87]。
Jain 和Ho 等人研究通过植物来源蛋白质(大豆蛋白、豌豆蛋白等)、改性淀粉、乳制品蛋白以及植物蛋白-多糖复合物等制备负载番茄红素的赋形剂乳液,改善番茄红素的理化稳定性以及提高其生物利用度,结果发现改性淀粉、乳清蛋白等做乳化剂产生的乳液稳定性更好,动物模型显示其形成的包埋番茄红素的乳液能提高番茄红素的生物利用率[87,88]。
Tvah 等人采用乳化蒸发技术制备番茄红素纳米乳液,通过测定从食物基质中释放的番茄红素含量以及形成胶束形式的番茄红素含量,来确定其生物可及性,结果发现未形成乳液的番茄红素体外生物可及性仅为0.01%;而粒径为150nm和69nm的番茄红素纳米乳液的生物可及性分别为0.53%和0.77%[89]。
2.3.4 叶黄素乳液递送体系 与大多数类胡萝卜素相同,叶黄素也存在疏水性强,化学稳定性差和口服生物利用率较低的问题,因此可通过乳液包埋递送技术,减少叶黄素与食物和胃肠液中的酸、酶或促氧化剂等反应性物质之间的接触,有效防止叶黄素在胃肠道中乳液递送体系的物理与化学降解。叶黄素的颜色降解还可以通过向乳液中添加抗氧化剂或界面特性的方法来抑制,同时乳液中脂质促进叶黄素的吸收利用,从而达到提高生物利用率的目的。
Vishwanathan 等人研究通过采用微射流高压均质的方式将叶黄素水包油乳液转化为纳米乳液,制备出粒径为150 nm 的稳定纳米乳液体系;健康受试者先服用叶黄素补充剂,然后再将叶黄素纳米乳液加入橙汁中服用(两项独立研究中叶黄素摄入量分别为6 mg/d 和2 mg/d),每一周为1 个周期,两次服用之间有2 周为洗脱期。第一个实验周期,在补充6 mg 片剂或纳米乳液阶段后,平均血清叶黄素浓度(n=9)分别增加104%(P<0.001)和167%(P<0.001)。第二个实验周期中,在补充2 mg 片剂和叶黄素纳米乳液后,平均血清叶黄素浓度(n=11)分别增加了37%(P<0.05)和75%(P<0.001),尽管使用微射流处理器的制备过程造成叶黄素的部分损失,即纳米乳液分别出现31%(6mg/d 乳液,P <0.05)和28%(2mg/d 乳液,P<0.05)的叶黄素损失,导致事实上纳米乳液中叶黄素的实际浓度(6 mg 或2 mg)分别比补充片剂形式低10%和40%,但总的来说,叶黄素的纳米乳液的生物利用率明显高于补充片剂[90]。
使用食品级非离子表面活性剂(Tween 80)制备的微乳液已被证明可以有效地将叶黄素和玉米黄质包埋在饮料中,并提高其食用后的生物利用率[91]。Feng 等人利用玉米胶纤维制备负载叶黄素乳液,所得乳液能够较好稳定叶黄素且提高其生物利用率[92]。
Yan 等人研究使用牛血清白蛋白(BSA),绿原酸(CA)和葡聚糖(DEX)制备的三元共聚物被用作新型乳化剂,维生素E(VE)作为脂溶性抗氧化剂,探究在不同的环境应力,pH 和温度条件下,不同乳化剂制备的叶黄素乳液特性。结果表明,三元共聚物可有效制备在等电点附近高物理稳定性的叶黄素乳液,对叶黄素乳液的化学稳定性的提高更为显著。模拟胃肠道(GIT)实验表明,上述乳液体系能够提高叶黄素生物利用率,其中添加维生素E 的叶黄素乳液其生物可及性相对最高且达到64.5%[93]。
3 类胡萝卜素乳液作为递送体系的应用
3.1 不同类胡萝卜素乳液应用受限的因素
由于类胡萝卜素水溶性差、高熔点、易结晶,化学稳定性差,导致其口服生物利用度较低。因此在掌握了上述限制因素后,有必要开发可保护其免于化学降解、生物利用率较高的递送体系。然而乳液作为一种经典的口服递送体系,有效递送类胡萝卜素的同时也会受到内部组成及环境等因素的影响。如就不同乳化方式而言,低能乳化法所需能量、成本较低,但需较高浓度的表面活性剂和助表面活性剂才能形成均匀稳定的乳液;高能乳化法初始设备和操作成本高,存在设备故障的可能性,以及难以符合食品添加成分的要求。一方面pH 值、光、温度会影响乳液的包埋效率[94],另一方面类胡萝卜素可能与乳液体系中的其他成分发生相互作用,导致整个体系不稳定。因此设计合理的乳液递送体系,将两种成分间隔开,避免相互作用产生影响非常必要[95]。
3.2 目前类胡萝卜素递送体系的市场应用
β-胡萝卜素、叶黄素、番茄红素、虾青素等类胡萝卜素已加入食品添加剂、营养强化剂等目录,市场上开发了大量软胶囊、硬胶囊、口服液、片剂等功能食品,为提升不同年龄段人群、亚健康人群、需要重点改善营养人群的健康水平起到了重要作用,据调研机构统计,2018 年全球类胡萝卜素市场规模约100 亿元(约13.8 亿美元),具有巨大的市场效益规模和发展空间。但类胡萝卜素对体内外环境敏感,极大地影响了其生物利用率,对于提升其吸收利用效率为目标的研究与应用技术亟待开展。目前国内外市场常见的类胡萝卜素功能产品大多数以片剂、胶囊和口服液的形式作为递送体系,但研究发现服用此种类胡萝卜素产品其结晶与溶解状态可能影响胃肠道的吸收利用,最终导致其生物利用率较低。
Stinc 等人研究通过对西班牙市售的22 个牛奶果汁饮料产品(MFJBs)进行分析,探究其营养成分含量及类胡萝卜素生物可及性影响,类胡萝卜素主要为β-胡萝卜素,其次是α-胡萝卜素,β-隐黄质和玉米黄质。含有牛奶的果汁饮料其类胡萝卜素生物可及性均高于不含牛奶的果汁饮料,表明牛奶这种天然乳液能够提高类胡萝卜素的生物可及性[96]。María 等人研究食品基质和食品加工对类胡萝卜素饮料的生物可及性影响发现,总类胡萝卜素生物利用度由高到低为:牛奶(MB)饮料>豆浆(SB)饮料>水(WB)饮料。与未经处理的产品相比,牛奶为基质(MB)与高强度脉冲电场(HIPEF)加工相结合,其类胡萝卜素的生物利用度提高了15%[97]。因此作为具有改善疏水性植物化学物质(类胡萝卜素)的稳定性及其生物利用率的乳液口服递送体系应运而生。乳液递送体系因其结构组成、理化性质的可控范围广、实际应用空间大等优势,在加工过程中,将负载类胡萝卜素的乳液添加到饮料、酸奶等食品中形成具有功能性的产品。
4 总结与展望
类胡萝卜素对人类健康有很多益处,但由于其自身稳定性与水溶性较差,研究多以增加类胡萝卜素生物利用率和扩大其在工业上的应用为目的。将其包埋在基于乳液这种经典的口服脂质递送体系能有效控制类胡萝卜素递送效率的同时,可有效提高类胡萝卜素的溶解性,促进类胡萝卜素与食物基质结合并保持其在胃肠道内的稳定性。虽然目前很多研究致力于构建高载量的营养素递送体系,但对乳液口服后实际吸收量与乳液制备过程中重要条件粒径、温度、pH 值、压力等因素,包括油相中脂溶性维生素对体系的影响并没有深入的研究。乳液中高载量与微量成分均可能对负载类胡萝卜素乳液的稳定性及功能活性造成一定影响,类胡萝卜素的负载量必须参考每日膳食推荐摄取量,不可一味追求高载量而忽略实际吸收利用效率,由于高浓度条件下类胡萝卜素容易形成聚集体,对脂质膜结构存在潜在的破坏性;且另一方面,乳液体系中多组分之间易产生协同或拮抗作用,对其发挥生物活性至关重要。总而言之,未来对于不同极性类胡萝卜素乳液口服递送体系的体内吸收以及乳液体系中营养素相互作用对其功能活性的影响仍有待开展。
