基于LXRs/NF-κB通路探讨壮骨健膝方对兔膝骨关节炎滑膜组织炎症的影响
2022-03-16郭洁梅王建辉苏友新
陈 鹏,郭洁梅,肖 艳,王建辉,苏友新*
1 福建中医药大学,福建 福州 350122;
2 中医骨伤及运动康复教育部重点实验室,福建 福州 350122;
3 福建卫生职业技术学院,福建 福州 350101
膝骨关节炎(knee osteoarthritis,KOA)患者中约90%伴有滑膜组织炎症表现,其严重程度与KOA 病程发展正相关[1]。KOA滑膜组织炎症可通过加剧软骨退化、加速膝关节边缘骨赘形成及软骨下骨增生硬化进一步加重KOA 的病理进程[2-4]。核因子κB(nuclear factor-kappaB,NF-κB)通路激活可诱导相关下游炎症因子的表达以加重炎症反应[5],在KOA滑膜组织炎症的发生、发展中扮演重要角色[6]。研究表明,滑膜组织内滑膜巨噬细胞中肝X 受体(liver X receptors,LXRs)可通过募集核受体辅助抑制因子(nuclear receptor co-repressor,N-CoR),间接抑制NF-κB 通路中P50、P65 参与的白介素-1β(Interleu⁃kin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子表达[7-8],从而减轻KOA滑膜组织炎症。壮骨健膝方是课题组根据KOA 病机特点总结的效验方,前期已开展该方延缓软骨退化系列研究及减轻KOA 滑膜组织炎症的动物在体研究[9-10]。本研究拟进一步从体外兔滑膜组织培养观察角度,阐明壮骨健膝方对KOA 滑膜组织炎症的干预效应及机制,为其临床推广应用打下基础。
1 材料与仪器
1.1 实验动物
34 只健康新西兰大白兔(简称兔),雌雄各半,体质量(2.0±0.3)kg,由上海市松江区松联实验动物场提供[许可证编号:SCXK(沪)2017-0008],委托福建中医药大学实验动物中心代购并饲养[许可证号:SYXK(闽)2019-0007]。
1.2 实验药物
壮骨健膝方(骨碎补∶杜仲∶川牛膝∶生地黄∶独活∶鸡血藤∶秦艽∶徐长卿∶䗪虫=5∶3∶4∶5∶2∶5∶3.3∶3.3∶2),均购于福建中医药大学国医堂,并经福建中医药大学药学院中药鉴定教研室鉴定。按既定工艺浓缩至含生药1 g/mL的药液[10]。
1.3 试剂
木瓜蛋白酶(美国Sigma 公司,SLBR9817V);乌拉坦(上海源叶生物科技有限公司,Z28N10Y10450 6);兔IL-1β、TNF-α、基质金属蛋白酶(matrix metal⁃loproteinase,MMP)-3、MMP-13 ELISA 试剂盒(江苏酶免实业有限公司,MM-030501、MM-024001、MM-018701、MM-148601);LXRα 多克隆抗体、P65 多克隆抗体(北京博奥森生物技术有限公司,BJ01036276、AI07086414);N-CoR 单克隆抗体(美国Santa Cruz Biotechnology 公司,A1819);P50 多克隆抗体(美国Abcam 公司,ab194729);LXRα 抑制剂5CPPSS-50(日本Wako 公司,WDM6507);N-CoR 抑制剂ML-792(美国Santa Cruz Biotechnology 公司,66065);DMEM 培养基(美国Hyclone 公司,AE2916 3339);胎牛血清(fetal bovine serum,FBS)(澳大利亚ExCellBio 公司,11G292);D-Hank's 平衡盐溶液(上海麦克林生物科技有限公司,C10878521);增强型BCA 蛋白浓度测定试剂盒(080719191115)、SDSPAGE 蛋白上样缓冲液(081519191016)均购自上海碧云天生物科技研究所。
1.4 仪器
电子天平(上海精密科学仪器有限公司,YP202N);切片机(德国LEICA 公司,RM2235);摊片机(亚光医用电子技术有限公司,YF-7FB);旋转蒸发仪(上海亚荣生化仪器厂,RE-52AA);电热恒温培养箱(上海掌动网络科技有限公司,PYX-DNS);光学显微镜(德国LEICA 公司,DM4000B-LED);超纯水装置(德国MILLIPORE 公司,MILLI-Q);低温高速离心机(美国BECKMAN 公司,64R);CO2培养箱(德国Herarus,E163302);倒置式系统显微镜(日本Olympus,BX41);全自动酶联免疫检测仪(美国BIO-TEK,ELX800);垂直电泳仪(美国Bio-Rad 公司,Mini-PROTEAN Tetra);化学发光成像系统(美国Bio-Rad公司,ChemiDoc XRS)。
2 实验方法
2.1 兔含药血清、空白血清的制备
采用随机数字表法将12 只兔分为空白血清组和含药血清组,每组6 只。根据前期研究并参照人与兔千克体质量换算[11],含药血清组给予4.58 mL/(kg·d)壮骨健膝方药液灌胃,每日分2次灌胃,空白血清组给予等量生理盐水灌胃,连续灌胃3 d。于末次灌胃1 h 后,行腹腔麻醉(20%乌拉坦5 mL/kg)后腹主动脉采血。静置2 h后,离心25 min(4 ℃,2 500 r/min),水浴灭活(56 ℃,30 min),微孔滤膜(0.22 μm)过滤,分装于无菌50 mL 离心管并封口,-20 ℃保存备用。
2.2 动物模型的制备及鉴定
将22 只兔采用随机数字表法分为空白组和造模组,每组分别6 只和16 只。造模组采用兔膝关节腔内注射木瓜蛋白酶法[12]造模,于造模的第1、4、7天对兔右后肢膝关节腔注入0.5 mL 2%木瓜蛋白酶水溶液。空白组同法注入0.5 mL 生理盐水。于造模第14 天,观察兔造模前后膝部皮温、髌上周径、Lequesne MG 量表评估情况[13],并随机选取空白组与造模组兔各3 只处死,无菌操作下切取右后肢膝关节内滑膜组织行HE 染色,以对模型进行鉴定。以造模后兔膝部皮温明显升高、髌上周径明显增大及Lequesne MG>4分为KOA模型鉴定成功标准。
2.3 滑膜组织的采集及分组
模型鉴定成功后,将空白组剩余3 只兔及造模组剩余13 只兔无菌操作下切取右后肢膝关节内的滑膜组织,浸入装有无菌D-Hank's 液的无菌EP 管中保存。随即转移至超净工作台下,将无菌EP管中所有滑膜组织经D-Hank's 液漂洗3 遍后,使用眼科手术剪仔细剔除滑膜周围可见的脂肪组织,将滑膜组织剪碎成肉眼可见的大小约1~2 mm3小块,收集60 小块,随机分为4 组,即模型组、壮骨健膝方组、LXRα 抑制剂组、N-CoR 抑制剂组,每组15 个组织块,每孔3块,每组5孔,置于6孔板中培养。同法取正常兔滑膜组织制备空白组,5孔。
2.4 滑膜组织体外培养、观察与干预
将造模组滑膜小块均匀排列置于无菌6 孔板中,视组织块附着程度倒置1~2 h 后,沿孔壁缓缓加入适量含10%FBS 的DMEM 培养液,每日更换培养液1 次,置于37 ℃、5% CO2的条件下培养。倒置显微镜下观察滑膜组织状态,第3 天分别用10%空白血清、10%含药血清、10%含药血清+5 μg/mL LXRα 抑制剂5CPPSS-50、10%含药血清+5 μg/mL N-CoR抑制剂ML-792进行干预,每2 d换液1次,置于37 ℃、5%CO2下培养,空白组给予10%空白血清培养。根据预实验确定的干预时间为7 d,干预7 d后采集标本。
2.5 样本处理及指标检测
每组随机选取6 个滑膜组织,4%多聚甲醛固定24 h 后脱水、包埋、切片以用于HE 染色观察。剩余的组织块采用移液枪移除培养液,滤纸吸干余下水分后,各组使用电子天平称重取0.2 g 滑膜组织,放入玻璃匀浆管,加入1.8 mL PBS缓冲液,冰上研磨充分后收集匀浆液,离心10 min(4 ℃,3 000 r/min),取匀浆的上清液,冰箱-20 ℃保存备用,以供ELISA 检测;其余的滑膜组织置于研钵中,加入液氮研磨成粉状后转移至1.5 mL EP管,加入提前配制好的含有蛋白酶抑制剂的裂解液(裂解液∶蛋白酶抑制剂=100∶1),冰上裂解5 min,然后离心20 min(4 ℃,12 000 r/min),收集上清液,-80 ℃冰箱保存备用,以供Western blot检测。
2.5.1 兔滑膜组织HE 染色及评分 将包埋好的兔膝滑膜组织切片后进行HE 染色,用LEICA 光学显微镜拍片观察滑膜组织形态,每个滑膜切片选取5个视野(×200),进行滑膜组织形态学评分,标准参照巫桁锞等[14]的方法,分别从4 个指标进行评分。见表1。

表1 滑膜病理学评分标准Table 1 Synovial pathology scoring criteria
2.5.2 兔膝滑膜组织中相关炎症指标的ELISA 检测 采用ELISA检测兔膝滑膜组织匀浆的上清液中IL-1β、TNF-α、MMP-3 和MMP-13 的含量。具体步骤按试剂盒说明书操作,于450 nm 处检测吸光度,根据说明书绘制标准曲线,由标准曲线公式计算细胞上清液中IL-1β、TNF-α、MMP-3 及MMP-13含量。
2.5.3 兔膝滑膜组织中相关蛋白的Western blot 检测 采用BCA 法测定蛋白浓度,Western blot 法检测各蛋白表达。一抗稀释比例为LXRα(1∶300)、NCoR(1∶500)、P50(1∶500)、P65(1∶300)、β-actin(1∶8 000);二抗稀释比例为1∶10 000。将PVDF 膜置于化学发光成像仪上,滴加工作液,拍照,并记录分析各目的蛋白相对表达量。
2.6 统计学方法
使用SPSS 26.0 软件对数据进行分析。计量资料符合正态分布,数据采用(±s)表示,组间比较采用方差分析,两两比较采用Bonferroni法,不符合正态分布则采用秩和检验。P<0.05 为差异具有统计学意义。
3 结 果
3.1 兔KOA模型鉴定
造模前后造模组兔右后肢膝关节皮温、关节周径、Lequesne MG 评分比较,差异具有统计学意义(P<0.05);光镜下观察发现空白组滑膜呈半透明,滑膜层较薄且滑膜细胞呈单层整齐排列。造模组滑膜出现滑膜增生且滑膜细胞呈多层紊乱排列、炎性细胞大量浸润等改变。见表2和图1。
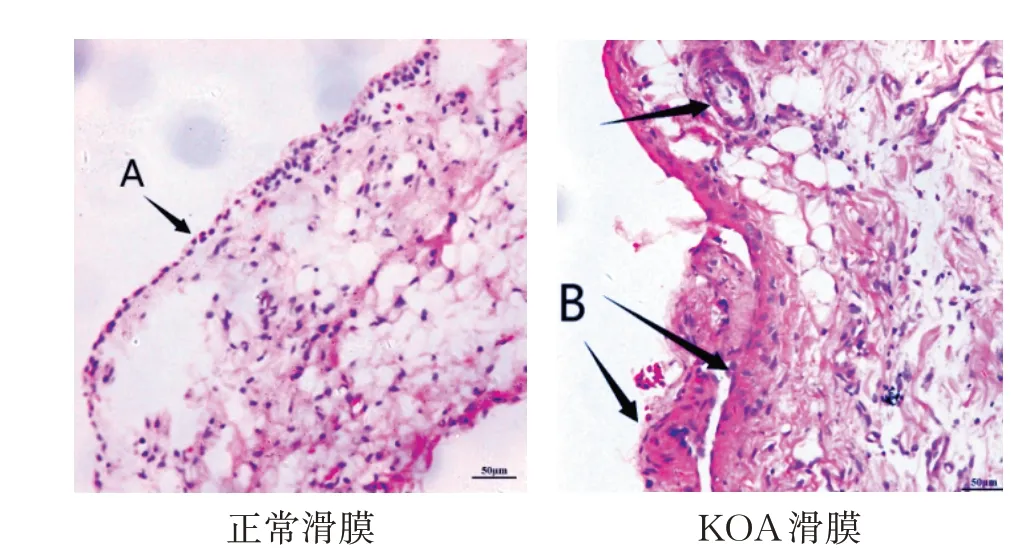
图1 光镜下KOA兔膝滑膜组织病理HE染色图(×200)Figure 1 Pathological observation of synovial tissue of KOA rabbits by HE staining under light micro⁃scope(×200)
表2 造模前后兔膝关节皮温、关节周径及Lequesne MG 得分等指标比较(±s)Table 2 Rabbit knee joint skin temperature,circumference,Lequesne MG scores and other indicators before and after modeling(±s)
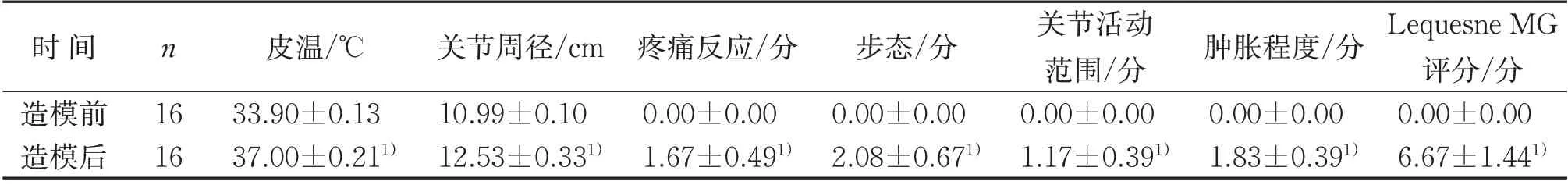
表2 造模前后兔膝关节皮温、关节周径及Lequesne MG 得分等指标比较(±s)Table 2 Rabbit knee joint skin temperature,circumference,Lequesne MG scores and other indicators before and after modeling(±s)
注:与造模前比较,1)P<0.05。Notes:Compared with that before modeling,1)P<0.05.
时间造模前造模后Lequesne MG评分/分0.00±0.00 6.67±1.441)n 16 16皮温/℃33.90±0.13 37.00±0.211)关节周径/cm 10.99±0.10 12.53±0.331)疼痛反应/分0.00±0.00 1.67±0.491)步态/分0.00±0.00 2.08±0.671)关节活动范围/分0.00±0.00 1.17±0.391)肿胀程度/分0.00±0.00 1.83±0.391)
3.2 5 组干预后滑膜组织HE 染色及形态学评分的变化情况
滑膜组织块在整个培养及干预期间未出现明显萎缩及色泽晦暗等表现。与空白组比较,模型组HE 染色可见滑膜内衬层细胞增生且排列紊乱明显、大量炎性细胞浸润及纤维组织增生等改变,形态学评分显著升高(P<0.05);与模型组比较,壮骨健膝方组可见滑膜内衬层细胞轻度增生排列紊乱、稀疏散在炎性细胞浸润及少量纤维组织增生等改变,形态学评分显著降低(P<0.05);分别与LXRα抑制剂组及N-CoR 抑制剂组比较,壮骨健膝方组病理改变形态学评分显著降低(P<0.05)。见表3和图2。
表3 5组干预后滑膜组织形态学评分变化(±s)Table 3 Changes of synovial tissue morphology scores in five groups after intervention(±s)

表3 5组干预后滑膜组织形态学评分变化(±s)Table 3 Changes of synovial tissue morphology scores in five groups after intervention(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与壮骨健膝方组比较,3)P<0.05。Notes:Compared with the blank group, 1) P<0.05; compared with the model group, 2) P<0.05; compared with the Zhuanggu Jianxi decoction group,3)P<0.05.
积分/分0.67±0.52 9.00±0.631)4.33±0.522)7.01±0.412)3)7.14±0.632)3)组别空白组模型组壮骨健膝方组LXRα抑制剂组N-CoR抑制剂组n66666

图2 5组干预后滑膜组织HE染色图(×200)Figure 2 HE staining of synovial tissue in five groups after intervention(×200)
3.3 5组干预后滑膜组织匀浆上清液IL-1β、TNFα、MMP-3和MMP-13含量变化
干预后与空白组比较,模型组IL-1β、TNF-α、MMP-3、MMP-13 含量显著升高(P<0.05);与模型组比较,壮骨健膝方组、LXRα 抑制剂组、N-CoR 抑制剂组上述指标含量均显著降低(P<0.05);分别与LXRα 抑制剂组和N-CoR 抑制剂组比较,壮骨健膝方组上述指标含量均显著降低(P<0.05)。与干预前比较,干预后壮骨健膝方组IL-1β、TNF-α 含量显著降低(P<0.05)。见表4和表5。
表4 5组干预后滑膜IL-1β、TNF-α、MMP-3及MMP-13含量比较(±s)Table 4 Comparison of IL-1β,TNF-α,MMP-3 and MMP-13 contents in synovial tissue of five groups after intervention(±s)

表4 5组干预后滑膜IL-1β、TNF-α、MMP-3及MMP-13含量比较(±s)Table 4 Comparison of IL-1β,TNF-α,MMP-3 and MMP-13 contents in synovial tissue of five groups after intervention(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与壮骨健膝方组比较,3)P<0.05。Notes:Compared with the blank group, 1) P<0.05; compared with the model group, 2) P<0.05; compared with the Zhuanggu Jianxi decoction group,3)P<0.05.
MMP-13/(μg/L)152.72±3.56 267.30±3.021)185.63±2.332)207.03±3.472)3)211.92±1.872)3)组别空白组模型组壮骨健膝方组LXRα 抑制剂组N-CoR 抑制剂组n33333 IL-1β/(ng/L)23.06±2.10 46.86±1.801)30.16±0.422)37.91±0.822)3)39.82±0.582)3)TNF-α/(pg/mL)112.58±7.67 348.98±5.541)187.46±10.442)248.07±8.532)3)242.53±7.562)3)MMP-3/(μg/L)20.03±0.63 31.58±1.181)20.09±1.762)26.51±0.742)3)26.95±0.032)3)
表5 壮骨健膝方组干预前后滑膜组织IL-1β和TNF-α含量比较(±s)Table 5 Comparison of IL-1β and TNF-α in synovial tis⁃sue in the Zhuanggu Jianxi decoction group be⁃fore and after intervention(±s)

表5 壮骨健膝方组干预前后滑膜组织IL-1β和TNF-α含量比较(±s)Table 5 Comparison of IL-1β and TNF-α in synovial tis⁃sue in the Zhuanggu Jianxi decoction group be⁃fore and after intervention(±s)
注:与干预前比较,1)P<0.05。Notes:Compared with that before intervention,1)P<0.05.
TNF-α/(pg/mL)349.55±3.07 187.46±10.441)时间干预前干预后n33 IL-1β/(ng/L)47.23±2.15 30.16±0.421)
3.4 5 组干预后滑膜组织LXRα、N-CoR、P50 和P65蛋白表达的变化
与空白组比较,模型组LXRα、N-CoR 蛋白表达明显下降(P<0.05),P50、P65蛋白表达明显上升(P<0.05)。与模型组比较,壮骨健膝方组LXRα、N-CoR蛋白表达显著升高(P<0.05),P50、P65 蛋白表达明显下降(P<0.05);LXRα 抑制剂组LXRα、N-CoR 蛋白表达差异无统计学意义(P>0.05),P50、P65 蛋白表达均显著下降(P<0.05);N-CoR 抑制剂组LXRα蛋白表达显著升高(P<0.05),N-CoR 蛋白表达差异无统计学意义(P>0.05),P50、P65 蛋白表达显著降低(P<0.05)。分别与LXRα抑制剂组及N-CoR抑制剂组比较,壮骨健膝方组LXRα、N-CoR 蛋白表达均显著升高(P<0.05),P50、P65 蛋白表达均显著降低(P<0.05)。见图3和表6。
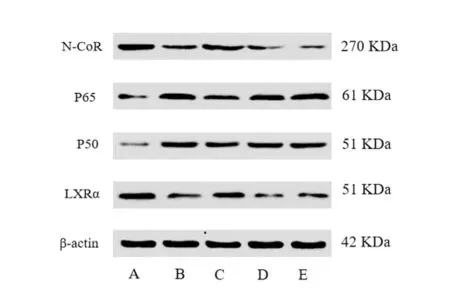
图3 5组干预后滑膜组织蛋白电泳图Figure 3 Protein electrophoresis of synovial tissue in five groups after intervention
表6 5组干预后滑膜组织中LXRα、N-CoR、P50及P65蛋白表达比较(±s)Table 6 Comparison of LXRα,N-CoR,P50 and P65 protein expression in synovial tissue in five groups after intervention(±s)
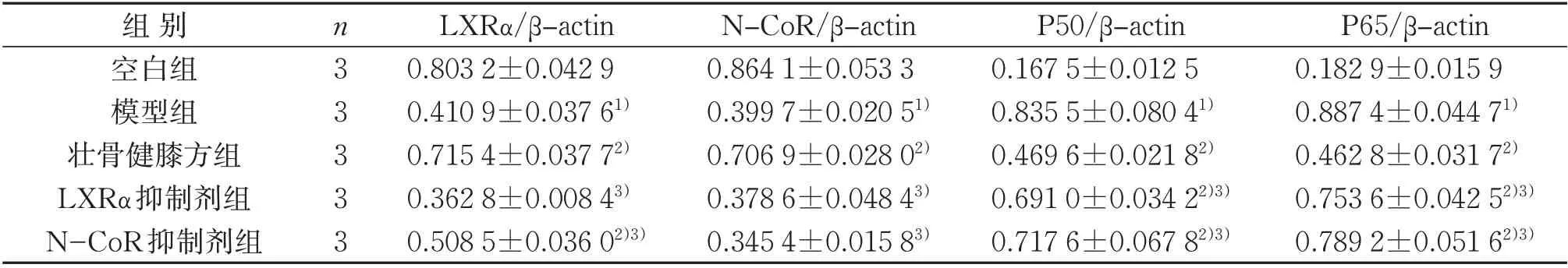
表6 5组干预后滑膜组织中LXRα、N-CoR、P50及P65蛋白表达比较(±s)Table 6 Comparison of LXRα,N-CoR,P50 and P65 protein expression in synovial tissue in five groups after intervention(±s)
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与壮骨健膝方组比较,3)P<0.05。Notes:Compared with the blank group, 1) P<0.05; compared with the model group, 2) P<0.05; compared with the Zhuanggu Jianxi decoction group,3)P<0.05.
P65/β-actin 0.182 9±0.015 9 0.887 4±0.044 71)0.462 8±0.031 72)0.753 6±0.042 52)3)0.789 2±0.051 62)3)组别空白组模型组壮骨健膝方组LXRα抑制剂组N-CoR抑制剂组n33333 LXRα/β-actin 0.803 2±0.042 9 0.410 9±0.037 61)0.715 4±0.037 72)0.362 8±0.008 43)0.508 5±0.036 02)3)N-CoR/β-actin 0.864 1±0.053 3 0.399 7±0.020 51)0.706 9±0.028 02)0.378 6±0.048 43)0.345 4±0.015 83)P50/β-actin 0.167 5±0.012 5 0.835 5±0.080 41)0.469 6±0.021 82)0.691 0±0.034 22)3)0.717 6±0.067 82)3)
4 讨 论
滑膜组织炎症贯穿KOA 病程的各个时期[15]。KOA 滑膜组织炎症不仅可加速膝关节的退变,还可导致疼痛、肿胀及僵硬等症状的发生及迁延。故抑制滑膜组织炎症反应以延缓膝关节病理改变、改善患者症状是目前KOA治疗的重要环节之一[16]。
4.1 LXRs/NF-κB 通路对KOA 滑膜组织炎症的调控作用
KOA 滑膜组织炎症的病理表现包括滑膜内衬层细胞增生及排列紊乱、炎性细胞浸润及纤维组织增生等。一方面IL-1β、TNF-α等炎症因子及MMPs可刺激滑膜组织导致其病理表现的加剧,另一方面滑膜组织炎症反应的加重可促使上述炎症指标含量的进一步升高,最终形成恶性循环。研究显示滑膜组织中滑膜细胞NF-κB 通路的活化在KOA 滑膜炎的发病过程中扮演着重要角色[17-18]。正常情况下,P65 和P50 与IκBα 以共聚体形式存在于胞质内,当受到外界刺激后,IκBα 发生磷酸化并降解,P65 和P50 进入细胞核,促进IL-1β、TNF-α 等炎症因子及MMPs 的表达[19]。研究表明,滑膜巨噬细胞胞浆内LXRα 的活化可抑制巨噬细胞中的TLR3 或TLR4 从而参与调控炎症介质或MMPs 的分泌,抑制机体炎症反应,具有较强的抗炎活性[20]。LXRα 激活后从胞浆转移至细胞核,在被SUMO 修饰的同时募集NCoR,启动“转录抑制”机制,从而间接抑制NF-κB通路的活化,最终缓解机体的炎症反应。由此可见,LXRs/NF-κB 通路上的关键节点蛋白可能是调控KOA滑膜组织炎症的有效作用靶点。
4.2 壮骨健膝方可改善KOA滑膜组织炎症
本研究认为,“痹痿并见”是KOA 的主要特点之一,KOA 滑膜组织炎症所致膝关节疼痛、肿胀及僵硬等症状属“痹”,行走或登梯无力、运动控制下降等症状属“痿”,应“痹痿并治”以除痹起痿[21]。壮骨健膝方经多年临床实践总结而来,方中骨碎补、杜仲合用可补肝肾,强筋骨;独活、秦艽、䗪虫、鸡血藤四药合用,可祛风除湿,舒筋止痛,祛瘀生新;徐长卿、川牛膝合用,则有强化补肝肾、祛风湿的效果;生地黄清热滋阴,养血活血,全方共奏补肝肾、强筋骨、祛风湿、通经络之功效,痹痿同治。本课题组临床研究证实,该方可改善KOA 患者膝关节疼痛、肿胀、僵硬及行走无力等“痹”“痿”症状[22],据此围绕“痹痿”,基于壮骨健膝方的疗效及机制开展了系列基础研究。体外研究发现,该方可能通过延缓软骨细胞退变而发挥治痿的作用[9];体内研究发现,该方可显著改善KOA 滑膜组织炎症模型兔膝关节滑膜组织炎症细胞浸润及纤维组织生成等病理表现,降低组织形态学评分而治痹[10],但治痹作用的具体机制尚不明确。
4.3 壮骨健膝方对兔KOA 滑膜组织炎症LXRs/NF-κB通路的影响
本研究结果表明,模型组滑膜组织在炎性反应的刺激性下出现了显著的滑膜细胞增殖能力升高现象[23],与文献中慢性炎性反应下成纤维细胞被激活、细胞表型改变、增殖能力升高并具备侵袭能力的报道类似[24]。滑膜组织HE 染色及形态学积分显示,壮骨健膝方可有效减轻兔KOA 滑膜组织炎症的病理表现,而当LXRα、N-CoR 被抑制后则导致该病理表现加重。与空白组相比,模型组LXRα、N-CoR表达显著下降,P50、P65 蛋白表达升高,IL-1β、TNF-α、MMP-3 及MMP-13 含量显著升高,提示NF-κB 通路被激活。当使用含药血清干预后,与模型组相比,壮骨健膝方组LXRα、N-CoR 蛋白表达显著升高,P50、P65蛋白表达显著降低,提示NF-κB通路受到抑制。当含药血清中分别加入LXRα 及NCoR 抑制剂后,LXRα 及N-CoR 抑制剂组P50、P65蛋白表达显著上升,导致下游相关炎症指标含量显著升高,提示NF-κB 通路被激活,也证实壮骨健膝方对NF-κB 通路的抑制作用,可能是通过上调LXRα表达、募集N-CoR而实现的。
综上,本研究结果从兔滑膜组织水平证实,壮骨健膝方可有效改善兔KOA 滑膜组织炎症的病理表现,其机制可能与其上调滑膜组织中滑膜细胞LXRs/NF-κB 通路LXRα、N-CoR 蛋白表达,从而下调P50、P65 蛋白,进而减少下游IL-1β、TNF-α、MMP-3、MMP-13的含量有关。然而,动物滑膜组织与人滑膜组织存在一定的组织差异性,故含药血清干预体外培养的兔滑膜组织仅能部分解释壮骨健膝方对人KOA 滑膜组织炎症的作用机制。因此,有必要进一步开展人滑膜组织及滑膜细胞的实验研究以印证本次实验的结论,从而多层次、多角度丰富该方治痹的内涵。
