步行模式的功能性电刺激不同治疗时间对脑卒中患者下肢功能影响的随机对照研究
2022-03-16薛晶晶孔慧敏廖美新薛允莲肖灵君
薛晶晶,孔慧敏,廖美新,薛允莲,肖灵君*
1 中山大学孙逸仙纪念医院,广东 广州 510120;
2 广东省人民医院(广东省医学科学院),广东 广州 510080
脑卒中具有高发病率、高致残率和高复发率的特点,并有逐年递增的趋势[1-2]。脑卒中后患者的下肢运动功能尤其是行走能力丧失是最常见的运动障碍之一,直接影响患者的生活自理能力和生活质量。因此,脑卒中康复的主要目标之一在于重建行走能力,以提高患者的日常生活质量[3-5]。基于行走模式的功能性电刺激(functional electrical stimula⁃tion,FES)是按照一定的顺序,应用一定强度的脉冲电流刺激脑卒中后受损的神经肌肉组织,诱发肌肉收缩,产生特定的功能性动作,从而促进运动恢复[6-7]。大量研究表明,FES 有利于加强肌肉力量、提高步行能力[8-11]。目前临床上此类FES 治疗的常规治疗时间一般为20~30 min/次,但按照“无错法”运动再学习的原则,增加治疗时间和重复次数有助于提高治疗效果[8-11]。本研究的目的是探讨使用基于正常行走模式的智能化、多通道FES 的治疗时间对脑卒中患者下肢康复的疗效、疗效保持时间的影响,为步行模式FES的临床应用提供依据。
1 临床资料
1.1 病例选择条件
1.1.1 纳入标准 ①符合1995 年全国第四届脑血管病学术会议拟定的《各类脑血管病诊断要点》[12]中的相关诊断标准,并经颅脑CT 或MRI证实;②年龄25~80 岁;③初次发病,生命体征稳定,无进展性病征;④单侧肢体偏瘫,在无辅助下能够行走50 m;⑤愿意参加本研究,并签署知情同意书。
1.1.2 排除标准 ①进展型或再发脑卒中;②有感觉障碍;③有认知功能障碍(AMT总得分<7[13]);④双侧肢体均存在功能缺失;⑤有影响行走功能的其他疾患;⑥有电刺激治疗的禁忌证(如心脏起搏器、局部金属内固定等);⑦合并严重心、肝、肾等疾病;⑧近期发生癫痫或有癫痫发作史。
1.2 一般资料
于2018 年4—12 月在中山大学孙逸仙纪念医院招募符合纳入标准的脑卒中患者,共筛选脑卒中患者54 例,33 例不符合入选标准,3 例拒绝签署知情同书,最终入组18 例。以年龄、性别、病因、病程作为分层依据,采用Minimize 随机分组软件将患者随机分为60 min步行模式FES组(60 min组)、30 min步行模式FES 组(30 min 组),每组9 例。2 组一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经中山大学孙逸仙纪念医院伦理委员会批准,审批号:〔2017〕快审第(23)号。
表1 2组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
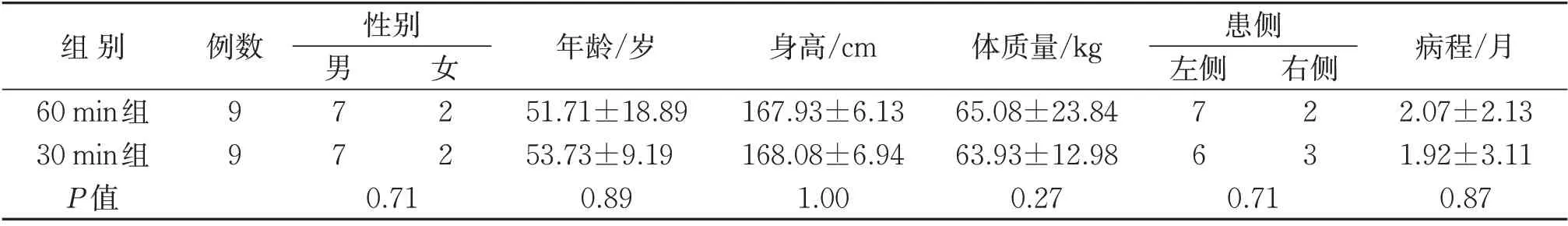
表1 2组一般资料比较(±s)Table 1 Comparison of general data between two groups(±s)
组别60 min组30 min组P值例数性别患侧左侧右侧99男77女22 76 23 0.71年龄/岁51.71±18.89 53.73±9.19 0.89身高/cm 167.93±6.13 168.08±6.94 1.00体质量/kg 65.08±23.84 63.93±12.98 0.27 0.71病程/月2.07±2.13 1.92±3.11 0.87
2 方 法
2.1 治疗方法
2 组的常规物理治疗是依据评估结果,基于神经发育疗法、运动控制原理制定的个体化治疗方案,30 min/次,1 次/d,5 d/周。在常规物理治疗基础上,2组分别给予相应的基于步行模式FES治疗。
2.1.1 电刺激设备 采用P2-9632型多功能电疗综合治疗仪-易善行(广州市凡科医疗设备有限公司)进行步行模式FES治疗。
2.1.2 电刺激部位 选择治疗仪的定位模式,使用其自带的定位笔分别刺激患侧股四头肌、腘绳肌、胫前肌、腓肠肌的肌腹,肌肉收缩最明显的部位为该肌肉的运动点。治疗时2对6 cm×9 cm 的电极分别并置于股四头肌、腘绳肌运动点上,2 对4 cm×4 cm的电极分别并置于胫前肌、腓肠肌的运动点上。
2.1.3 刺激参数 双向对称方波,脉宽200 μs,频率30 Hz,强度为刺激肌肉有明显的肌肉收缩。
2.1.4 60 min组电刺激治疗 接受基于正常步行模式的智能化、多通道FES治疗60 min,包括电刺激辅助步行30 min+卧位电刺激30 min。治疗时患者先在电刺激辅助下行走30 min(为防止疲劳,每行走8 min,休息2 min),然后在卧位下电刺激30 min。电刺激辅助步行时,以足底触发开关启动刺激,并按照人体行走时肌肉正常收缩的顺序进行周期性刺激。卧位下电刺激(卧床模式)时,患者取健侧卧位,2 个悬吊带分别置于患侧膝关节近端、踝关节近端,使患侧髋、膝、踝关节处于同一高度,踝关节中立位。在该体位下,患者在电刺激辅助下可以进行基于正常步行动作的髋、膝、踝关节的活动。治疗每天1次,5次/周,共计15次。
2.1.5 30 min组电刺激治疗 接受基于正常步行模式的智能化、多通道FES 辅助步行30 min+卧位安慰刺激30 min。治疗方法与60 min 组相同,但安慰刺激时,治疗仪仅指示灯亮,无电流输出。每天1次,5次/周,共计15次。
2.2 观察指标
分别在治疗前、治疗7 次后、治疗15 次后、治疗结束1 个月后,由专门的治疗师对患者进行改良Ashworth 量表(modified Ashworth scale,MAS)、徒手肌力检查(manual muscle test,MMT)、Fugl-Meyer 下肢评定(Fugl-Meyer assessment-lower extremity,FMALE)、Berg平衡评定(Berg balance scale,BBS)、10 m步行测试(10 meter walk test,10MWT)步速以及改良Barthel 指数(modified Barthel index,MBI)评估,以判断患侧下肢运动功能、平衡功能、日常生活活动能力的变化。所有评估在到达时间节点的1天内由专人完成,患者分组对评估者设盲。
2.3 统计学方法
采用EpiData 软件录入数据,SPSS 25.0 软件数据分析。计量资料服从正态分布用(±s)表示,计数资料用率表示;正态分布的数据比较采用两因素重复测量方差分析,计数资料采用χ2检验。P<0.05表示差异有统计学意义。
3 结 果
组内比较发现,60 min 组在治疗前、治疗7 次后、治疗15 次后和随访时MAS[F(2,18)=1.255,P=0.031<0.05]、MMT[F(2,18)=3.212,P=0.011<0.05]、FMA-LE[F(2,18)=1.238,P=0.015<0.05]、BBS[F(2,18)=2.230,P=0.026<0.05]、MBI[F(2,18)=4.176,P=0.005<0.05]和10MWT 步速[F(2,18)=3.742,P=0.009<0.05]的评估差异均有统计学意义;两两比较发现,MAS、MMT、FMA-LE、BBS、MBI在治疗7 次后、治疗15 次后和随访时比治疗前差异有统计学意义(P<0.05),10MWT 步速在治疗7次后和治疗15 次后较治疗前差异有统计学意义(P<0.05),其他各时间点间的组内对比差异无统计学意义(P>0.05)。见表2 和表3。30 min 组在治疗前、治疗7 次后、治疗15 次后和随访时MAS[F(2,18)=0.727,P=0.042<0.05]、MMT[F(2,18)=1.743,P=0.031<0.05]、FMA-LE[F(2,18)=0.314,P=0.009<0.05]、BBS[F(2,18)=1.027,P=0.015<0.05]、MBI[F(2,18)=2.350,P=0.025<0.05]和10MWT步速[F(2,18)=1.019,P=0.037<0.05]的评估差异均有统计学意义;两两比较发现,MAS、MMT、FMA-LE、10MWT、BBS 在治疗7 次后、治疗15 次后和随访时比治疗前差异有统计学意义(P<0.05),MBI在治疗7次后和治疗15次后较治疗前差异有统计学意义(P<0.05),10MWT 步速在治疗15 次后较治疗前差异有统计学意义(P<0.05),其他各时间点间的组内对比差异无统计学意义(P>0.05)。见表2和表3。
组间比较发现,治疗前2 组患者MAS、MMT、FMA-LE、BBS、MBI 和10MWT步速得分差异均无统计学意义(P>0.05),具有可比性。治疗7次后,60 min组的MAS、10MWT步速改善更加明显(P<0.05);治疗15 次后,MAS、FMA-LE、MBI 的组间差异均有统计学意义(P<0.05);随访时,MAS、MBI 的组间差异有统计学意义(P<0.05)。见表2和表3。
表2 2组基本运动功能比较(±s)分Table 2 Comparison of basic motor function between two groups(±s)Scores

表2 2组基本运动功能比较(±s)分Table 2 Comparison of basic motor function between two groups(±s)Scores
注:与治疗前比较,1)P<0.05;与30 min组比较,2)P<0.05。Notes:Compared with that before treatment,1)P<0.05;compared with the 30 min-stimulation group,2)P<0.05.
FMA-LE 22.18±4.32 23.71±3.971)25.79±4.151)2)25.21±3.871)22.28±3.61 22.89±4.261)24.01±4.641)25.03±3.971)组别例数60 min组9 30 min组9时间治疗前治疗7次后治疗15次后随访治疗前治疗7次后治疗15次后随访MAS 10.42±1.81 8.91±1.361)2)8.03±2.601)2)7.98±1.231)2)10.41±4.93 9.83±4.061)9.58±4.481)9.01±4.061)MMT 50.33±15.12 55.87±13.381)61.32±11.511)59.81±12.631)51.32±7.48 55.33±9.141)60.81±12.101)61.01±10.521)
表3 2组平衡、生活自理能力和步速比较(±s)Table 3 Comparison of balance,self-care ability and walking speed between two groups(±s)

表3 2组平衡、生活自理能力和步速比较(±s)Table 3 Comparison of balance,self-care ability and walking speed between two groups(±s)
注:与治疗前比较,1)P<0.05;与30 min组比较,2)P<0.05。Notes:Compared with that before treatment,1)P<0.05;compared with the 30 min-stimulation group,2)P<0.05.
10MWT步速/(m/s)0.51±0.35 0.69±0.601)2)0.73±0.481)0.62±0.46 0.51±0.29 0.62±0.30 0.73±0.371)0.61±0.35组别例数60 min组9 30 min组9时间治疗前治疗7次后治疗15次后随访治疗前治疗7次后治疗15次后随访BBS/分43.36±6.88 46.42±5.031)49.71±3.541)48.78±3.801)45.83±5.92 48.57±3.071)50.13±2.231)49.76±3.371)MBI/分72.61±13.87 79.67±12.771)88.32±6.501)2)89.03±10.541)2)70.48±13.17 74.42±11.051)77.51±10.921)74.88±12.34
4 讨 论
4.1 恢复行走功能是脑卒中患者的第一需求
步行是脑卒中患者能否恢复日常生活活动能力、回归社会、最终全面康复的关键因素[14-16]。寻求改善下肢运动功能和步行功能的有效治疗手段已经成为康复领域的关注热点。FES作为改善脑卒中患者下肢运动功能和步行的实用治疗技术,其临床应用正进一步关注于强化肌肉力量、提高自主运动控制能力、促进中枢神经重塑等方面[17-19]。
随着科技发展,FES 已经能够协助肢体完成行走的功能性活动[20]。本研究所采用的多通道FES具有4 个输出通道,工作时按照人体正常的行走模式分别刺激股四头肌、腘绳肌、胫前肌、小腿三头肌,使下肢产生行走样动作。步行模式FES 更加强调正常步行模式的输入,能够诱导患侧下肢产生重复、具有任务导向性、接近于正常模式的步行动作,是一种“无错法”的运动再学习过程。
4.2 步行模式FES治疗方案的确定
“运动再学习”疗法认为中枢神经损伤后运动功能恢复是一种再学习过程,为了最大限度地发挥“运动再学习”的优势,患者需要进行有针对性的、足够重复次数的功能性活动,使重组中的大脑皮质通过反复体验来学习和储存正确的运动模式[21-23]。既往关于强制性使用(constraint induced movement therapy,CIMT)的研究也发现,CIMT 疗法总体是有效的,但疗效并不优于同等剂量的其他疗法,这提示影响疗效的关键因素或许是治疗时间和重复次数[24-25]。临床上,FES的治疗时间多采用20~30 min/次,也有少量研究采用60 min/次的治疗时间[26-27],且FES 治疗后患者步行速度增加,步态协调性改善。基于“无错法”的运动再学习理念,推测延长步行模式FES的治疗时间及增加步行动作的重复次数有助于提高治疗效果,延长疗效保持时间。
近年来,李春镇等[28]发现急性期脑卒中患者FES辅助下行走10 min后开始出现疲劳,刺激15 min时步态参数与治疗前比较,差异无统计学意义。因此,为了增加步行模式的重复次数,同时避免肌肉疲劳,本研究在电刺激辅助步行时每行走8 min,休息2 min。
4.3 步行模式FES 改善脑卒中患者行走功能的疗效
研究结果表明,2 组受试者均在治疗7 次后、治疗15 次后评估时肌张力、肌力、平衡功能、自理能力,均得到显著改善,说明步行模式FES能够有效降低脑卒中患者的肌张力,提高肌力、平衡功能和生活自理能力。FERRANTE等[29]对2名轻度步态障碍的患者进行了为期4 周的个性化多通道FES 治疗,治疗后患者的肌肉协调性和动态平衡取得显著的改善。其可能机制是智能化、多通道FES通过反复、特定的刺激激活患侧下肢瘫痪肌肉,同时将刺激信号传入中枢,促进中枢神经系统的重塑[30-32]。陈丹凤等[33]通过核磁共振弥散张力成像也证实了多通道FES可以促进脑卒中早期患者的脑功能重组。
在随访中发现,与治疗前相比,2 组受试者肌力、肌张力、平衡功能均有显著改善;60 min 组生活自理能力仍有显著改善,而30 min 组生活自理能力差异无统计学意义。但与治疗15次后评估相比,随访时2组受试者的所有评估指标均有所下降。这提示步行模式FES对脑卒中患者运动功能的改善可保持到治疗后1个月,但效果会逐渐减弱。因此,脑卒中患者出院后需通过居家康复训练、电刺激治疗维持治疗效果,进一步提高运动和步行功能。
4.4 步行模式FES 改善脑卒中后行走功能的可能机制
“强制性使用”理念强调高强度、多次重复的功能性活动有利于大脑相应功能区域的重组,促进脑卒中患者肢体运动,特别是功能性活动的恢复[34-35]。本研究发现,治疗时间从30 min 增加到60 min 时,患者肌张力、运动功能和生活自理能力的改善效果显著提高。此外,60 min 组患者在治疗7 次后和治疗15次后步速均有显著改善,而30 min组仅在治疗15 次后步速较治疗前有显著改善。因此,延长治疗时间能够提高功能性电刺激的疗效,加快治疗效率。其可能原因为延长治疗时间从而增加了步行动作的重复次数,“重复动作记忆”的正确输入和输出能够提高患者的运动学习能力,使大脑形成模式化记忆,重建正常行走模式。燕铁斌教授在动物实验中也证实FES治疗促进下肢功能恢复的可能机制是促进脑梗死半影区突触素、胶质纤维酸性蛋白的表达,改善突触的可塑性,促进内源性神经干细胞的增殖、迁移、分化,参与神经再生[36-38]。
基于正常行走模式的智能化多通道FES注重整体、模式化的引导,重点关注脑卒中患者患侧下肢的运动控制,通过运用正常运动模式改善下肢运动功能,恢复步行能力。本研究从多项反映脑卒中患者下肢运动功能的临床评估出发,观察智能化、多通道FES 的疗效,并探讨治疗时间和疗效的关系。除此之外,本研究还观察治疗结束1 个月后随访跟踪的结果,关注电刺激的长期治疗效果。然而,本研究也存在一定的局限性,如各组的样本量较少,长期随访跟踪的周期较短等,这些问题都有待进一步深入研究。
5 小 结
在常规治疗的基础上,使用基于步行模式的智能化、多通道FES 能够高效地改善脑卒中患者的肌张力、肌力、平衡功能、步行功能和自理能力,且延长治疗时间能够加快患者的恢复,延长疗效的保持时间。临床上可依此有针对性地制定脑卒中患者的FES治疗方案,以达到患者康复结局的最优化。
