香石竹DcSKP1基因克隆及表达分析
2022-03-16周旭红赵雪艳杨晓密吴学尉瞿素萍
周旭红 赵雪艳 杨晓密 吴学尉 瞿素萍

摘 要: SKP1基因是SCF E3泛素连接酶蛋白复合物的核心成分,参与多种生物过程。然而,香石竹SKP1基因还未被克隆,该文利用RT-PCR结合 RACE技术,从香石竹(Dianthus caryophyllus)的花药中分离克隆了1个减数分裂相关基因SKP1的全长cDNA序列,命名为DcSKP1(GenBank登录号为MK931293)。结果表明:(1)DcSKP1基因cDNA 全长序列为 962 bp,含有1个长度为567 bp 的ORF,该基因编码188个氨基酸。(2)蛋白序列比对显示,DcSKP1中存在一个高度保守TPEE基序,还具有Skp1_POZ结构域和Skp1结构域,并与拟南芥的SKP1聚集在一个分支上。(3)利用荧光定量PCR对香石竹DcSKP1基因表达模式进行研究,发现DcSKP1基因在各个组织部位都有表达,在花药中的表达量高于茎、叶组织,且在幼小的花药中表达量最高,随着花药发育的进程表达量下降。由此推测,DcSKP1基因可能在香石竹减数分裂中具有重要作用。
关键词: 香石竹, DcSKP1, 减数分裂, 生物信息学分析, 基因表达分析
中图分类号: Q943
文献标识码: A
文章编号: 1000-3142(2022)02-0286-08
Clone and expression analysis of DcSKP1 in Dianthus caryophyllus
ZHOU Xuhong1,2, ZHAO Xueyan3, YANG Xiaomi2, WU Xuewei3, QU Suping1*
( 1. Flower Research Institute, Yunnan Academy of Agricultural Sciences, Kunming 650205, China; 2. Yunnan University of Chinese Medicine,
Science and Technology Department, Kunming 650500, China; 3. School of Agriculture, Yunnan University, Kunming 650500, China )
Abstract: SKP1 gene is the core component of the SCF (Cul1-Rbx1-Skp1-F box) E3 ubiquitin ligase protein complex and is involved in many different biological processes. However, the SKP1 gene of carnation has not been cloned. In this study, a new DcSKP1 gene (the accession number in GenBank was MK931293) was isolated from the flower of Dianthus caryophyllus by using RT-PCR and RACE approaches. The results were as follows: (1) The full length cDNA sequence of DcSKP1 was 962 bp, and a ORF of 567 bp encoded 188 amino acids. (2) Protein sequence alignment showed that DcSKP1 had a highly conserved TPEE motif, Skp1_POZ domain and Skp1 domain, and clustered on a branch with Arabidopsis thaliana Skp1. (3) The DcSKP1 gene expression pattern of Dianthus caryophyllus was studied by qRT-PCR, and it was found that the DcSKP1 gene was expressed in all tissue sites, the expression level in anthers was higher than that in stem and leaf tissues, the expression level was the highest in young anthers, and the expression level decreased with the development of anthers. It is speculated that DcSKP1 gene may play an important role in carnation meiosis in D. caryophllus.
Key words: Dianthus caryophyllus, DcSKP1, meiosis, bioinformatics analysis, gene expression analysis
許多细胞事件,如信号转导、细胞周期调节和转录的机制主要由泛素介导的蛋白降解所调控 (Hershko &Ciechanover, 1998;Ning et al., 2016)。泛素化是一个三酶级联的过程,首先泛素被泛素激活酶(E1)激活,然后转移到泛素结合酶(E2)上,在泛素连接酶(E3)的帮助下与底物蛋白的赖氨酸残基结合,赋予底物特异性 (刘卫霞等,2002)。多个泛素分子可以附着在蛋白底物上已有的泛素分子上形成多泛素链,多泛素化的蛋白通常被26S蛋白酶体降解。SCF复合物形成已知最大的E3泛素蛋白连接酶 (Schulman et al., 2000),SCFs参与关键蛋白的泛素化,控制细胞周期进展和转录控制等基本生物学过程 (孙新艳等, 2017)。拟南芥SKP1-like-1 (ASK1),编码连接Cullin和F-box蛋白的SCF亚基 (Yang et al., 1999)。已有研究表明,ASK1可以与F-box蛋白相互作用 (Takahashi et al., 2004),由于这些F-box蛋白在不同的通路中发挥着重要作用 (郑鸿平和李逸平,2011),ASK1作为SCFs中的关键成分,在拟南芥中广泛地表达,且在许多发育和生理过程中可能具有重要功能 (叶佑丕,2014;Lu et al., 2016)。拟南芥ask1突变体在雄性减数分裂、花器官发育和营养生长方面存在缺陷。ask1-1最早检测到的缺陷发生在细线期到偶线期的转化过程中,核仁未能迁移到核外周,同源染色体不发生联会 (Wang et al., 2004),ASK1-1突变也导致拟南芥雄性减数分裂中重组频率的增加 (Wang & Yang, 2006)和雄性不育(Yang et al., 1999)。
香石竹是四大鲜切花之一,具有较高的产量和产值。目前,香石竹的育种主要还是采用传统的杂交育种,包括种间杂交和种内杂交育种方式;自然芽变或是采用辐射来诱导芽变也是香石竹育种方法之一;此外,也会利用转基因技术的方法培育蓝色香石竹 (Fukui et al., 2003)及抗衰老 (余义勋和包满珠, 2004)、抗枯萎病 (胡忠亮等, 2018)和耐热 (吴姗姗, 2014)等品系。但有关调控参与香石竹减数分裂的基因来创制优异香石竹品种的研究较少,这极大地阻碍了香石竹育种的进程。SKP1基因可调控花器官发育和减数分裂,但香石竹SKP1基因还未被克隆。本研究通过克隆香石竹SKP1基因,研究其在花药和茎叶的表达模式,为深入了解香石竹花发育的分子机制及运用于香石竹育种奠定基础。
1 材料与方法
1.1 试验材料
所用香石竹(Dianthus caryophyllus)‘罗加特’采集地点为云南集创园艺科技有限公司宝峰基地。2018年9月采集香石竹茎、叶组织和不同发育时期的花蕾,并用镊子取出幼嫩的花药,液氮速冻后置于-80 ℃冰箱保存备用。
1.2 试验方法
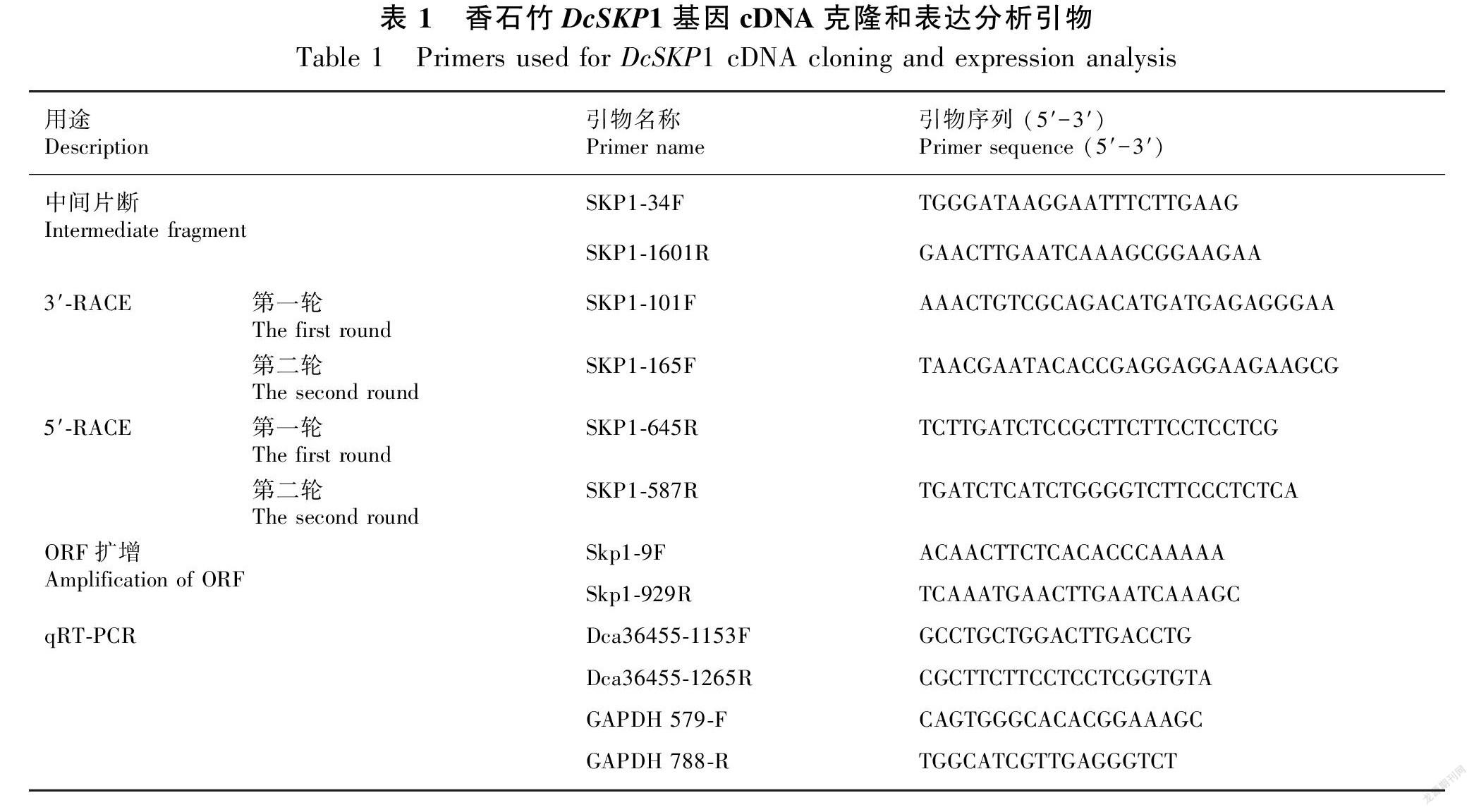
1.2.1 DcSKP1基因克隆与生物信息学分析 取-80 ℃冰箱保存的香石竹花药,加入磁珠,放入全自动样品快速研磨机中,研磨60 s。迅速倒出磁珠,快速加入1 mL Trizol试剂(Invitrogen 美国)于离心管中,RNA提取按Trizol试剂盒的说明书进行操作。合成cDNA第一链使用Takara 公司的PrimeScript-RT reagent Kit with gDNA Eraser试剂盒,按试剂盒的说明书进行操作。特异的引物根据已公布的香石竹基因组序列(http://carnation.kazusa.or.jp/blast.html)进行设计,先扩增中间片断,再根据中间片断的序列设计3′-RACE 和5′-RACE引物,按照SMARTer RACE 5′/3′Kit(Takara日本)试剂盒的操作扩增3′-RACE和5′- RACE cDNA序列,最后再设计全长引物,扩增全长cDNA序列。引物序列如表1。
使用NCBI网站(http://www. ncbi. nlm. nih.gov/BLAST)比对分析目的基因的同源序列,该基因及其他物种SKP1基因的氨基酸相似性比对分析用DNAMEN软件,并使用MEGA 6.0软件画系统进化树。蛋白的分子量和理论等电点预测采用ExPASy ProtParam分析,蛋白的亚细胞定位在线预测用PSORTII分析,蛋白的信号肽预测用Signal P 4.1分析,磷酸化位点预测采用Net Phos 2.0分析,蛋白跨膜结构预测用TMHMM 2.0分析,蛋白亲水性预测用Protscale 软件分析。
1.2.2 DcSKP1基因的表达分析 选取长度为1.1~1.2 cm的花蕾、1.3~1.4 cm的花蕾和1.5~1.6 cm的花蕾,取出花药,以及叶和茎的组织各三份,放入液氮中速冻。提取RNA并逆转录为cDNA,cDNA稀释10倍保存在-20 ℃的冰箱中备用,作为荧光定量PCR模板。GAPDH为内参基因,引物为GAPDH 579-F和GAPDH 788-R,DcSKP1引物为Dca36455-1153F和Dca36455-1265R(表1)。做三次生物学和实验重复,采用SPSS 12.0 软件分析数据并作图。
2 结果与分析
2.1 克隆DcSKP1基因全长cDNA序列
以提取的香石竹花药cDNA为模板进行PCR扩增。首先扩增中间片断,通过3′-RACE与5′-RACE技术扩增DcSKP1基因3′端和5′端序列,根据拼接后的cDNA全长序列设计引物扩增包括完整ORF在内的DcSKP1基因全长cDNA序列,扩增的产物见图1。DcSKP1基因中间片段扩增测序得到了500 bp的序列(图1:A),DcSKP1基因5′端和3′端序列测序后得到了长度分别为376 bp(图1:B)和567 bp(图1:C)序列,将以上克隆得到的3段序列拼接后得到一个长度为962 bp的DcSKP1全长cDNA序列。再设计引物扩增cDNA全长包括完整ORF在内的921 bp的序列(图1:D),该序列与拼接后序列的碱基完全一致。克隆结果表明,DcSKP1基因cDNA全长序列为 962 bp,含有1个长度为567 bp 的ORF,该基因编码188个氨基酸,命名为DcSKP1(GenBank登录号MK931293)。
2.2 DcSKP1氨基酸序列比对及进化分析
利用DNAMAN软件比对分析多个不同物种Skp1基因編码的氨基酸序列,发现DcSKP1基因存在一个高度保守TPEE基序(157~160氨基酸),基序很可能与糖基化翻译后修饰有关。该香石竹蛋白质还具有Skp1_POZ结构域(18~77氨基酸)和Skp1结构域(139~186氨基酸)(图2)。SKP1蛋白可分为两种类型的蛋白和三种类型的基因 (Kong et al., 2010)。I型蛋白由Ia型和Ib型基因编码,具有两个保守区域(Skp1_POZ和Skp1)和两个可变区域。Ⅱ型蛋白由Ⅱ型基因编码,与I型蛋白有很大不同。Ⅱ型蛋白含有一个额外的c端区域。Ia型基因包含单个内含子,而Ib型基因不包含任何内含子。Ⅱ型基因在多个位置有多个内含子 (Min et al., 2012)。本研究分离的DcSKP1基因包含一个内含子,归为I型蛋白和Ia型基因。
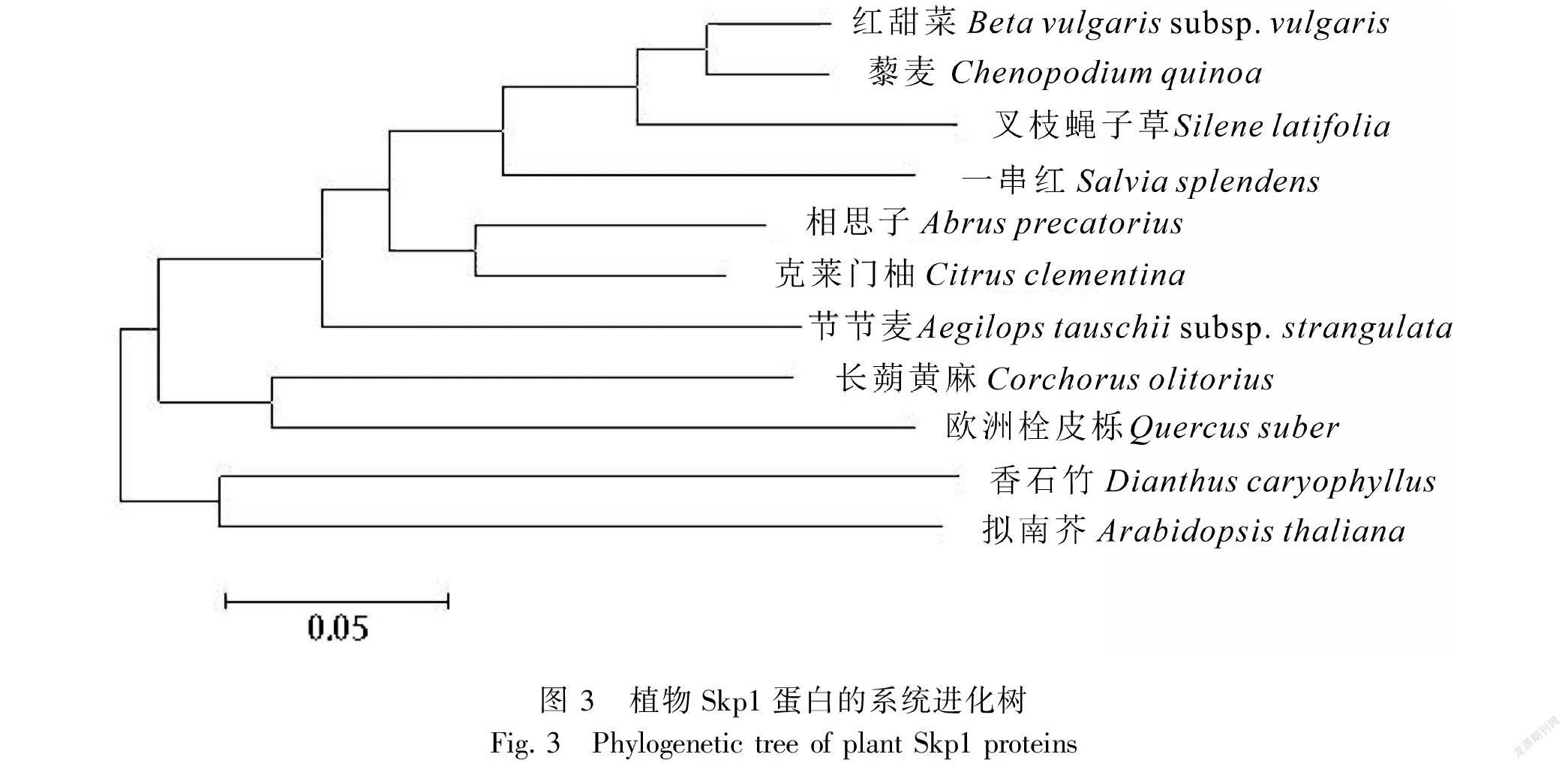
采用最大似然法 (maximum likelihood,ML)将其他物种的SKP1基因与香石竹DcSKP1氨基酸序列进行比对,建立系统进化树,结果显示其与拟南芥的SKP1聚集在一个分支上(图3),表明这两个基因的同源性最高。
2.3 香石竹DcSKP1生物信息学分析
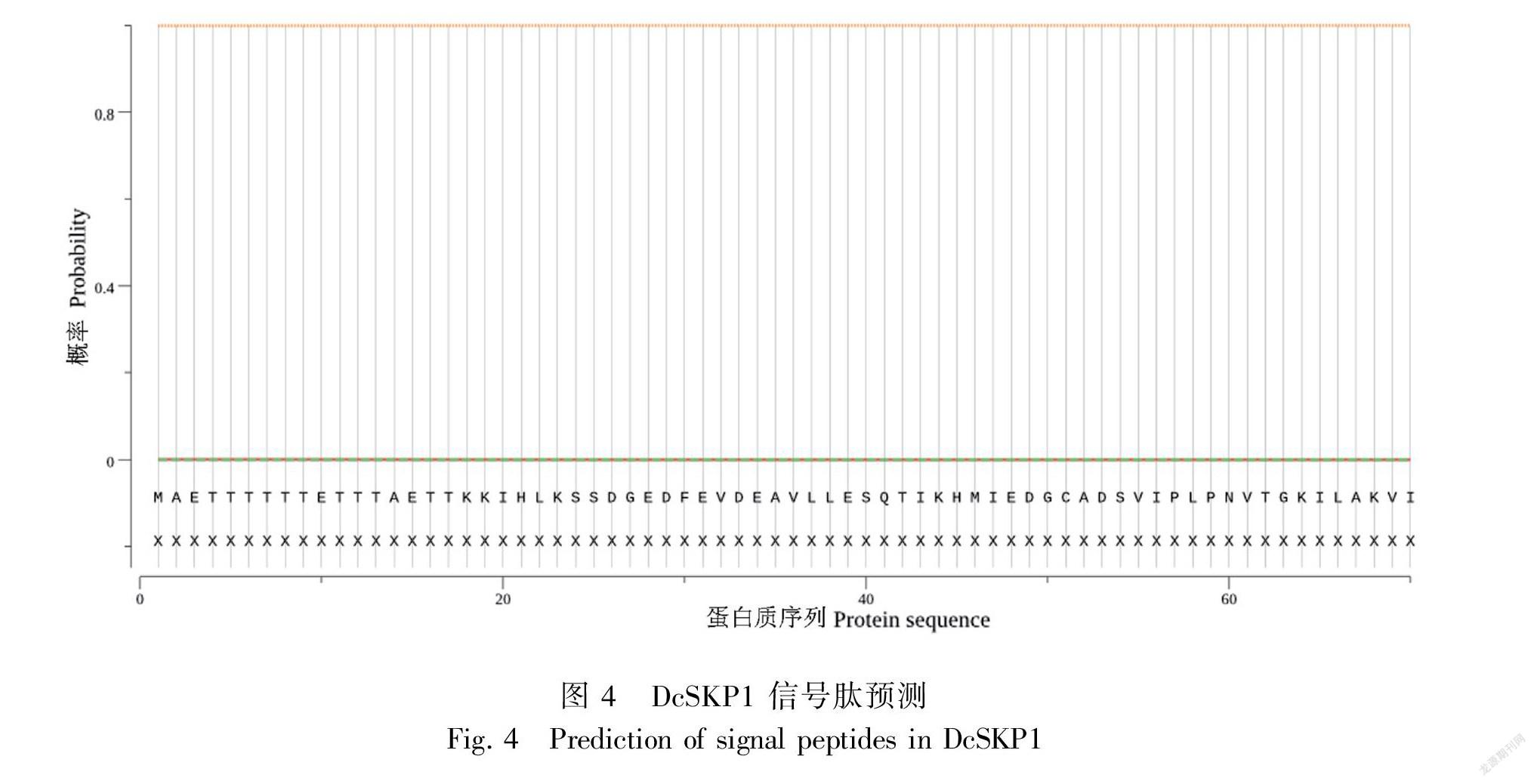
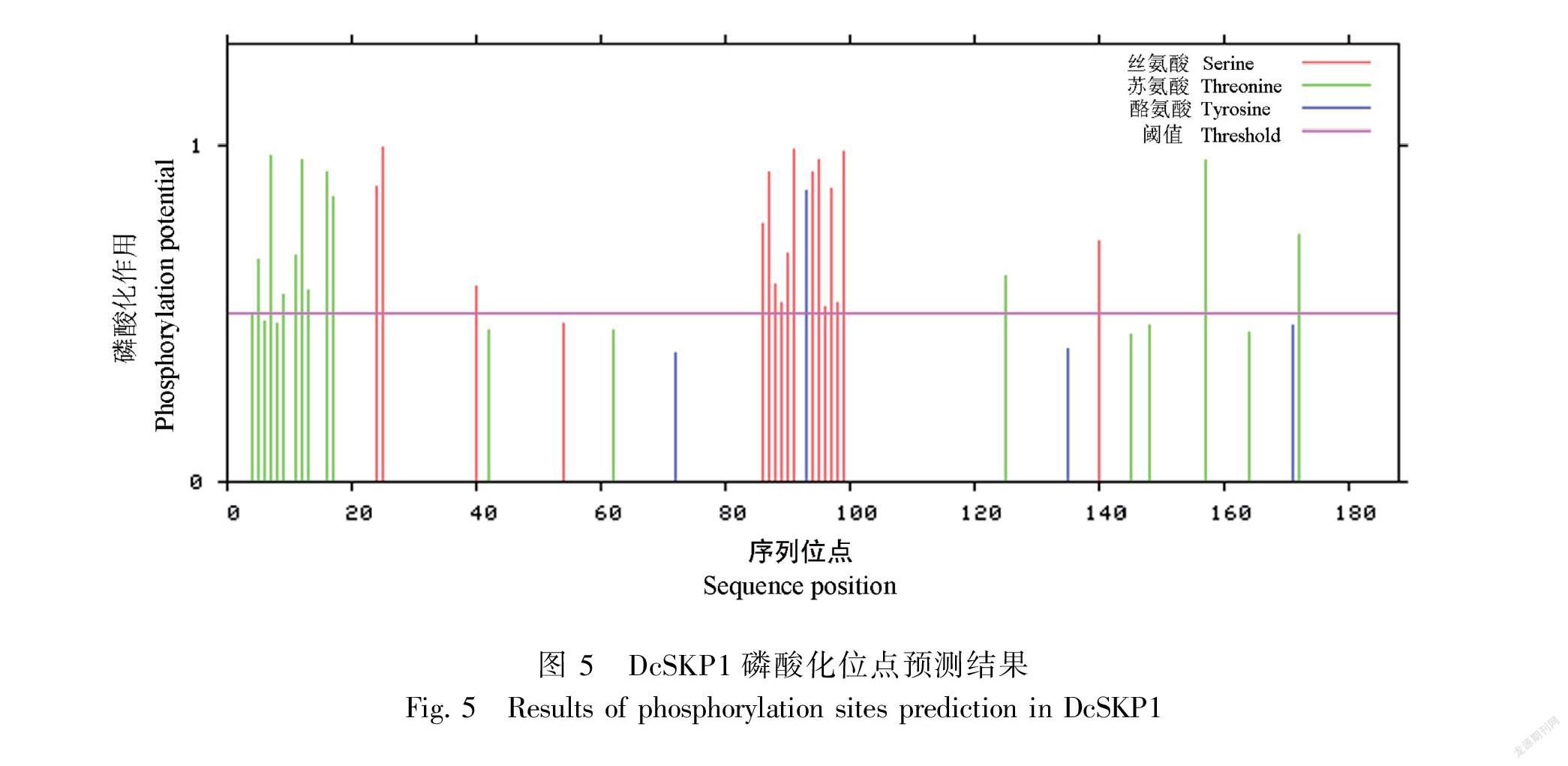
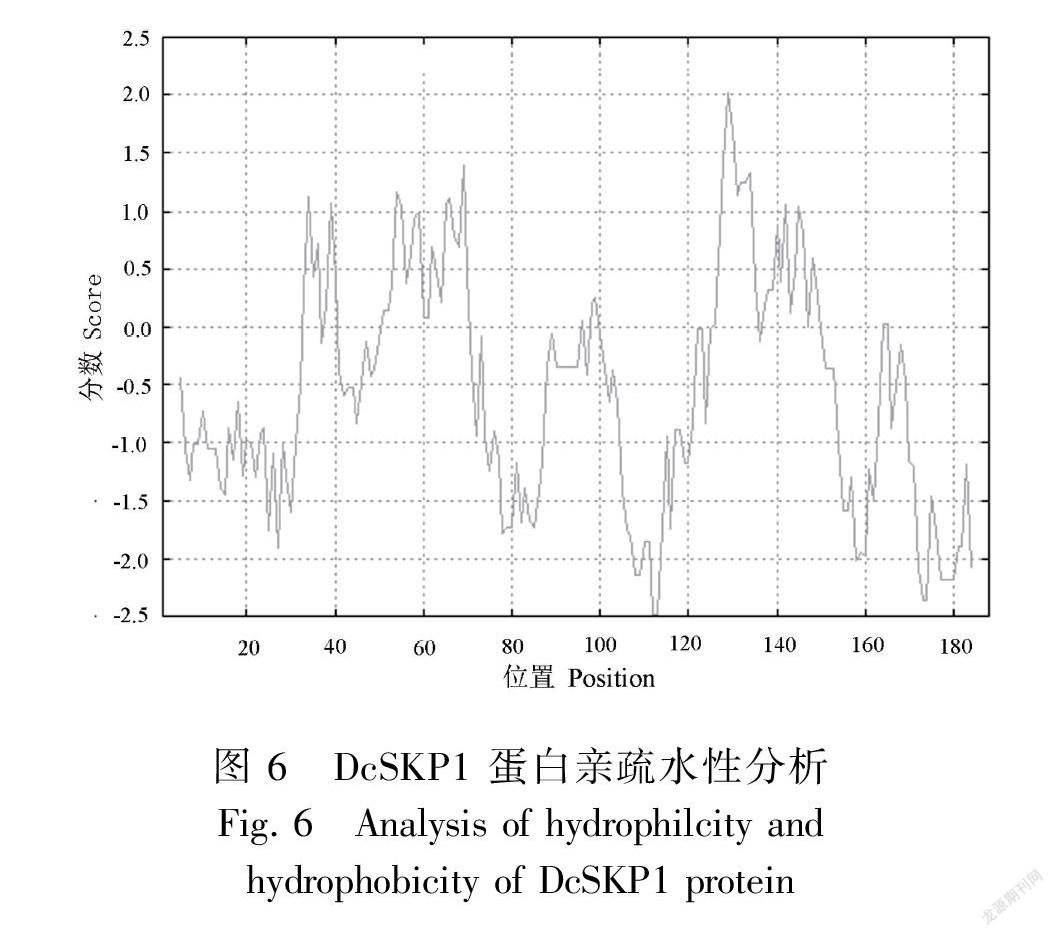
对DcSKP1进行氨基酸组成成分及理化性质分析,DcSKP1的分子式为C913H1443N237O317S7,理论等电点为4.52,分子量为21 036.32 Da。该蛋白正电荷残基为19,负电荷残基为38,预测不稳定指数为47.83,为不稳定蛋白。香石竹DcSKP1 氨基酸组成中主要为 Glu 和 Leu,其中 Glu 所占比例约为 11.7%,Thr 所占比例约为10.1%。预测DcSKP1蛋白的亚细胞定位可能 52.2%在细胞核中,26.1%在细胞质中,4.3%在高尔基体中,4.3%在细胞骨架中,4.3%在过氧化物酶体中,4.3%在质膜和4.3%在线粒体中。Dcskp1 蛋白的信号肽无峰值出现(图4),说明DcSKP1蛋白不存在信号肽,也说明该蛋白不属于分泌蛋白。蛋白跨膜结构预测DcSKP1没有跨膜螺旋,说明DcSKP1 是一个非跨膜蛋白。预测磷酸化位点发现在该蛋白质序列中可能含有 48 个磷酸化位点(score>0.5),包含 16 个丝氨酸位点,12 个苏氨酸位点和 1 个酪氨酸位点(图5)。蛋白质疏水性和亲水性预测,该蛋白最可能是亲水性蛋白(MIN:-2.489,MAX:2.011)(图6)。
2.4 DcSKP1基因的荧光定量表达分析
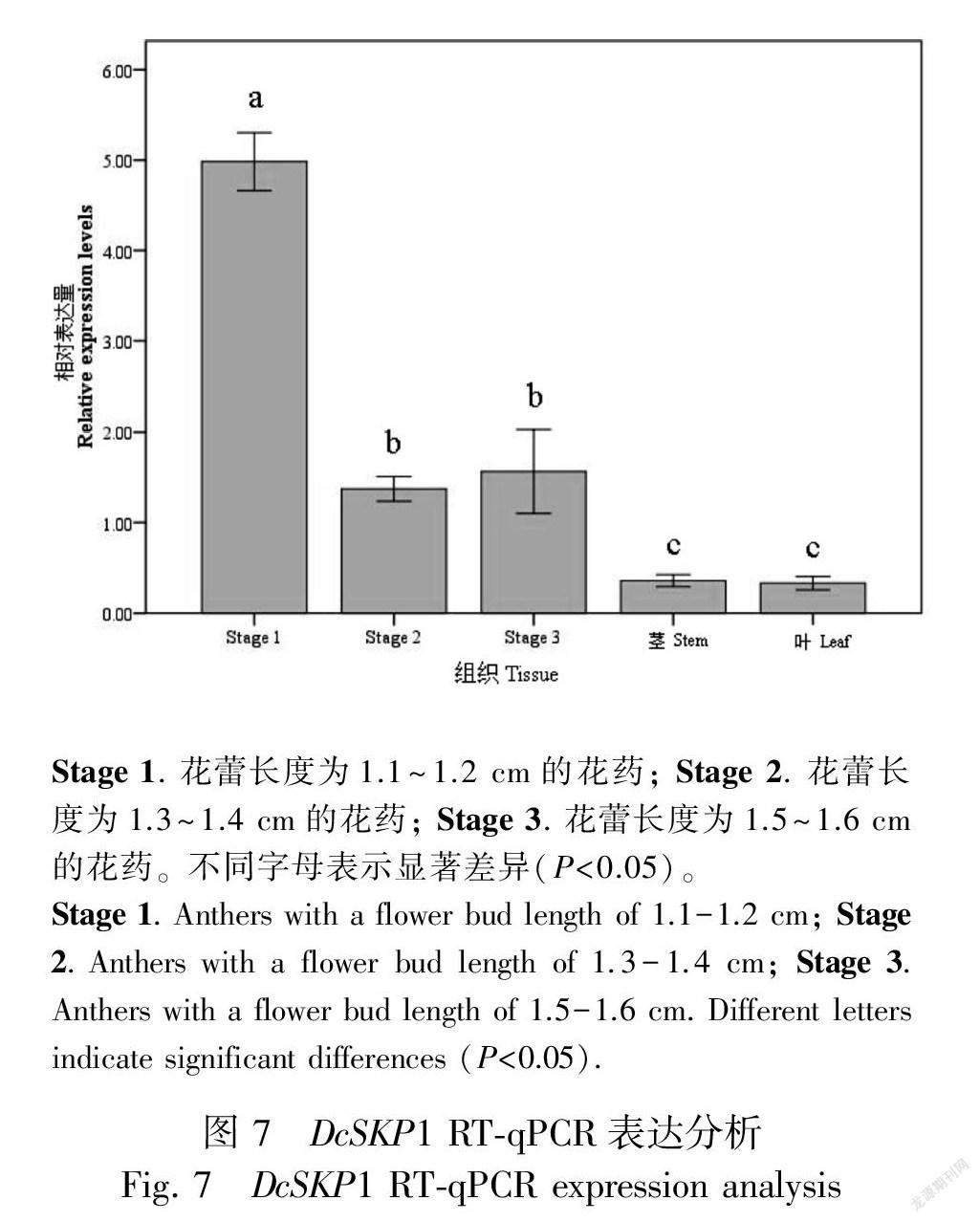
荧光定量PCR结果显示,DcSKP1基因在香石竹花药3个不同发育时期均有表达,但表达趋势逐渐下降,花蕾长度为1.1~1.2 cm(Stage 1)时的花药表达量最高,花蕾长度为1.3~1.6 cm(Stage 2 和Stage 3)时期的花药表达量低,且Stage 1与Stage 2和Stage 3有显著差异,在茎和叶中表达量更低,与花药中的表达量有显著差异(图7)。由此可见,DcSKP1基因可能与香石竹花药发育相关,尤其与减数分裂有关。
3 讨论和结论
SCF能参与一系列的生物学反应,包括信号转导、转录和细胞周期调控 (宋瑜龙, 2011; 孙新艳等, 2017)。SCF复合物在酵母系统中被发现,并且在细胞周期底物泛素化降解过程中发挥重要作用 (Feldman et al., 1997)。SCF复合物由三个亚基组成:Cullin(CDC53)、SKP1和F-box蛋白,SKP1是SCF E3泛素连接酶蛋白复合物的核心成分,参与多种生物过程。 在这个复合物中,SKP1是一种连接蛋白,与Cullin和F-box蛋白结合。SKP1可以与许多F-box蛋白相互作用,泛素化不同的底物特异性因子 (Vierstra & Smalle, 2004)。烟草SKP1基因具有Skp1结构域 (张付云等, 2007; 夏江宏等, 2015),亚细胞定位发现NtSKP1蛋白在胞浆和核部位均有表达 (张付云等, 2009)。香石竹DcSKP1基因存在Skp1_POZ结构域和Skp1结构域,还具有一个高度保守TPEE基序,很可能与糖基化的翻译后修饰有关,香石竹DcSKP1基因通过软件预测主要定位于细胞核。
拟南芥SKP1(atk1-1)突变体的雄性育性降低,有活力的花粉粒减少,雄配子减数分裂异常。atk1-1突变体中的雄性减数分裂产生反常数量的不同大小的小孢子,减数分裂纺锤体缺乏正常纺锤体的双极结构,这种异常的纺锤体可能是染色体异常分离和随后的孢子和花粉异常的原因,atk1-1染色体在中期I中不正确排列也可能与异常的纺锤体有关 (Chen et al., 2002)。此外,ASK1还抑制花粉减数分裂中的重组 (Wang & Yang, 2006)。宋瑜龙(2011)对小麦的研究表明,SKP1 表达量急剧下降,可能会使细胞分裂不能正常进行,从而导致小麦花粉粒的生长发育受到影响,过早地趋于死亡,同时,SKP1 蛋白也会大幅度下降,大量的SCF 复合体很难形成,泛素蛋白酶体途径受阻,导致一些细胞周期抑制蛋白降解不及时,进而影响花粉粒的活性,引起雄性不育的发生。本研究中香石竹DcSKP1基因在幼小的花药中表达量高,随着花药的不断发育表达量有所下降,而幼小的花药正在进行减数分裂,提示DcSKP1基因可能参与香石竹减数分裂过程。
水稻OmSKP1主要定位于细胞核,OmSKP1在营养组织(叶)和生殖组织(花)中都有表达,且花中的表达水平明显高于叶片,说明OmSKP1主要在花中进行表达 (范锡麟, 2013)。小麦TSK1基因在花药、幼根以及花顶端分生组织等分生较旺盛的组织中有较强的表达,暗示该基因可能参与植物细胞分裂相关的过程 (李驰峻, 2006)。小麦在可育和不育株中,随着花药生长时期(单核期、二核期、三核期)的推后,SKP1 基因的相对表达量都逐步降低。但在同一个发育期,可育花药中SKP1
基因的相对表达量比不育株花药中SKP1基因的相对表达量高 (宋瑜龙, 2011)。在拟南芥中,ASK1基因在生殖生长和营养生长整个过程中都有持续、广泛的表达,而在有丝分裂旺盛的部位以及減数分裂部位有更高的表达量 (Porat et al., 1998)。ASK1基因的表达量在减数分裂细胞周期中有波动,从细线期到粗线期出现一个峰值水平。因此,细线期到粗线期对于ASK1的功能似乎至关重要 (Wang & Yang, 2006)。草莓FaSKP1-1基因在植物的各个组织部位如根、叶、茎、花瓣、花柱、花托、花粉及果实中均有表达 (殷姗姗等, 2016)。本研究对香石竹DcSKP1基因表达模式进行研究,结果发现DcSKP1基因在各个组织部位都有表达,在花药中的表达量高于茎、叶组织,且表达量具有显著差异。这表明DcSKP1基因与花药的发育有关,可能参与香石竹减数分裂的过程。本研究结果为研究香石竹花粉败育的原因、减数分裂调控的信号通路和培育优异的植物新品种奠定了基础。
参考文献:
CHEN C, MARCUS A, LI W, et al, 2002. The Arabidopsis ATK1 gene is required for spindle morphogenesis in male meiosis [J]. Development, 129(10): 2401-2409.
FAN XL, 2013. Expression and purification of OmSKP1 with point mutations and primary analysis of protein interaction in vitro [D]. Changsha: Hunan Agricultural University. [范锡麟, 2013. 小粒野生稻OmSKP1的点突变蛋白表达纯化与体外互作的初步分析 [D]. 长沙: 湖南农业大学.]
FELDMAN RMR, CORRELL CC, KAPLAN KB, et al., 1997. A complex of cdc4p, skp1p, and cdc53p/cullin catalyzes ubiquitination of the phosphorylated cdk inhibitor sic1p [J]. Cell, 91(2): 221-230.
FUKUI Y, TANAKA Y, KUSUMI T, et al., 2003. A rationale for the shift in colour towards blue in transgenic carnation flowers expressing the flavonoid 3′, 5′-hydroxylase gene [J]. Phytochemistry, 63(1): 15-23.
HERSHKO A, CIECHANOVER A, 1998. The ubiquitin system [J]. Ann Rev Biochem, 67(1): 425-479.
HU ZL, ZOU DX, HAN ZM, et al., 2018. Identification and screening on wilt resistance of transgenic carnation seedlings [J]. Bull Sci Technol, 34(2): 62-65. [胡忠亮, 鄒东霞, 韩正敏, 等, 2018. 转基因香石竹抗枯萎病品系的鉴定及筛选 [J]. 科技通报, 34(2): 62-65.]
KONG H, LANDHERR LL, FROHLICH MW, et al., 2010. Patterns of gene duplication in the plant SKP1 gene family in angiosperms: Evidence for multiple mechanisms of rapid gene birth [J]. Plant J, 50(5): 873-885.
LI CJ, 2006. Cloning and functional analysis of TSK1, a SKP1 homologue from wheat [D]. Beijing: Institute of Botany, Chinese Academy of Sciences. [李驰峻, 2006. 小麦SKP1同源基因TSK1的克隆和功能分析 [D]. 北京: 中国科学院植物研究所.]
LIU WX, PENG XZ, YUAN JG, 2002. SCF ( Skp1- Cul1- F- box protein) complex and its function in cell cycle [J]. J Chin Biotechnol, 22(3): 1-3. [刘卫霞, 彭小忠, 袁建刚, 2002. SCF (Skp1-Cul1-F-box蛋白)复合物及其在细胞周期中的作用 [J]. 中国生物工程杂志, 22(3): 1-3.]
LU D, NI W, STANLEY BA, 2016. Proteomics and transcriptomics analyses of Arabidopsis floral buds uncover important functions of ARABIDOPSIS SKP1-LIKE1 [J]. BMC Plant Biol, 16(1): 61.
MIN JH, KIM DY, SEO YW, 2012. SKP1-like-related genes interact with various F-box proteins and may form SCF complexes with Cullin-F-box proteins in wheat [J].Mol Biol Rep, 40(2): 969-981.
NING Z, SCHULMAN BA, LANGZHOU S, et al., 2016. Structure of the Cul1-Rbx1-Skp1-F box Skp2 SCF ubiquitin ligase complex [J]. Nature, 416(6882): 703-709.
PORAT R, LU PZ, O′NEILL SD, 1998. Arabidopsis SKP1, a homologue of a cell cycle regulator gene, is predominantly expressed in meristematic cells [J]. Planta, 204(3): 345-351.
SCHULMAN BA, CARRANO AC, JEFFREY PD, et al., 2000. Insights into SCF ubiquitin ligases from the structure of the Skp1-Skp2 complex [J]. Nature, 408(6810): 381-386.
SONG YL, 2011. Cloning and expression analysis of SKP1 gene related to male sterility in wheat [D]. Yangling: Northwest A & F University. [宋瑜龙, 2011. 小麦雄性不育相关基因SKP1的克隆与表达分析 [D]. 杨凌: 西北农林科技大学.]
SUN XY, WEI Y, HAN XY, et al., 2017. Prokaryotic expression of cucumber Skp1 in Escherichia coli and preparation of Antiserum [J]. Acta Agric Boreal-Sin, 32(6): 73-77. [孙新艳, 魏莹, 韩晓玉, 等, 2017. 黄瓜S期激酶相关蛋白Skp1的原核表达及其多克隆抗体的制備 [J]. 华北农学报, 32(6): 73-77.]
TAKAHASHI N, KURODA H, KUROMORI T, et al., 2004. Expression and interaction analysis of Arabidopsis Skp1-related genes [J]. Plant Cell Physiol, 45(1): 83-91.
VIERSTRA RD, SMALLE J, 2004. The ubiquitin 26s proteasome proteolytic pathway [J]. Ann Rev Plant Biol, 55(1): 555-590.
WANG YX, WU H, LIANG GQ, et al., 2004. Defects in nucleolar migration and synapsis in male prophase [J]. Plant Reprod, 16(6): 273-282.
WANG YX, YANG M, 2006. The ARABIDOPSIS SKP1-LIKE1 (ASK1) protein acts predominately from leptotene to pachytene and represses homologous recombination in male meiosis [J]. Planta, 223(3): 613-617.
WU SS, 2014. Study on high temperature tolerance of transgenic carnation by PmHSP25.3 [D].Wuhan: Huazhong Agricultural University. [吴姗姗, 2014. 转PmHSP25.3基因香石竹植株耐热性研究 [D]. 武汉: 华中农业大学.]
XIA JH, ZENG B, LI WY, et al., 2015. Cloning and bioinformatics analysis of self-incompatibility gene SSK1 of wild almond in Xinjiang [J]. Chin Agric Sci Bull, 31(25): 107-112 [夏江宏, 曾斌, 李伟阳, 等, 2015. 新疆野扁桃自交不亲和基因SSK1的克隆及生物信息学分析 [J]. 中国农学通报, 31(25): 107-112.]
YANG M, HU Y, LODHI M, et al., 1999. The Arabidopsis SKP1-LIKE1 gene is essential for male meiosis and may control homologue separation [J]. Proc Natl Acad Sci USA, 96(20): 11416-11421.
YE YP, 2014. Research progress on ASK genes in Arabidopsis [J]. Plant Physiol J, 50(6): 683-690. [叶佑丕, 2014. 拟南芥ASK基因研究进展 [J]. 植物生理学报, 50(6): 683-690.]
YIN SS, LI MF, WANG H, et al., 2016. Cloning and expression analysis of FaSKP1-1 genes in strawberry (Fragaria ananassa Duch.) [J]. J Chin Agric Univ, 21(12): 28-34. [殷姗姗, 李茂福, 王华, 等, 2016. 草莓FaSKP1-1基因的克隆与表达分析 [J]. 中国农业大学学报, 21(12): 28-34.]
YU YX, BAO MZ, 2004. Prolonging the vase life of carnation ‘Mabel’ through integrating repeated acc oxidase genes into its genome [J]. J Plant Physiol Mol Biol, 30 (5): 541-545. [余义勋, 包满珠, 2004. 通过转重复结构的ACC氧化酶基因延长香石竹的瓶插期 [J]. 植物生理与分子生物学学报, 30(5): 541-545.]
ZHANG FY, BAI XF, DU YG, et al., 2007. Cloning and analysis of the full length cDNA of SKP1 gene from Nicotiana tabacum var. samsun NN and its expression in E. coli [J]. Acta Agron Sin, 33(4): 693-696. [张付云, 白雪芳, 杜昱光, 等, 2007. 烟草SKP1基因cDNA的克隆分析及原核表达 [J]. 作物学报, 33(4): 693-696.]
ZHANG FY, CHEN SY, ZHAO XM, et al., 2009. Construction of NtSKP1-GFP plant expression vector and subcellular location [J]. Acta Agric Boreal-Occident Sin, 18 (4): 144-148. [張付云, 陈士云, 赵小明, 等, 2009. NtSKPl-GFP植物表达载体的构建及亚细胞定位 [J]. 西北农业学报, 18(4): 144-148.]
ZHAO DZ, YANG M, SOLAVA J, et al., 2015. The ASK1 gene regulates development and interacts with the ufo gene to control floral organ identity in Arabidopsis [J]. Genesis, 25(3): 209-223.
ZHAO DZ, YANG XH, QUAN L, et al., 2006. ASK1, a SKP1 homolog, is required for nuclear reorganization, presynaptic homolog juxtaposition and the proper distribution of cohesin during meiosis in Arabidopsis [J]. Plant Mol Biol, 62(1-2): 99-110.
ZHAO DZ, YU QL, CHEN M, et al., 2001. The ASK1 gene regulates B function gene expression in cooperation with UFO and LEAFY in Arabidopsis [J]. Development, 128(14): 2735-2746.
ZHENG HP, LI YP, 2011. The essential regulator of cellular activities—F-box protein [J]. Chem Life, 31 (5): 619-624. [郑鸿平, 李逸平, 2011. 调控细胞活动不可或缺的重要分子——F-box蛋白 [J]. 生命的化学, 31(5): 619-624.]
(责任编辑 李 莉)
收稿日期: 2020-05-06
基金项目: 国家自然科学基金(31860570);云南省万人计划青年拨尖人才项目(YNWR-QNBJ-2018-389);教育部部省合建重点项目(2018BSHJ0108) [Supported by National Natural Science Foundation of China (31860570); Young Talents Project of Yunnan Ten Thousand Plan (YNWR-QNBJ-2018-389); Emphasis Project of Education Ministry and Provincial Cooperation (2018BSHJ0108) ]。
第一作者: 周旭红(1978- ),博士,研究员,主要从事花卉遗传育种研究,(E-mail) zhouxuhong7801@126.com。
*通信作者: 瞿素萍,硕士,研究员,研究方向为花卉标准制定,(E-mail)1035496319@qq.com。
2170501186212
