苦荞FtF5H基因克隆及表达分析
2022-03-16段迎杨晓琳蔡苏云贺润丽尹桂芳王艳青卢文洁孙道旺王莉花
段迎 杨晓琳 蔡苏云 贺润丽 尹桂芳 王艳青 卢文洁 孙道旺 王莉花





摘 要: 阿魏酸-5-羥基化酶(Ferulate 5-hydroxylase)是调控S型木质素合成的关键酶,为研究其在苦荞木质素生物合成途径中的分子机制,该文从苦荞转录组数据中筛选获得一个F5H基因,命名为FtF5H(GenBank登录号:MW455111),采用生物信息学方法对苦荞F5H蛋白的理化性质、信号肽、跨膜结构、亚细胞定位、亲疏水性、蛋白质二级结构、蛋白质三级结构、氨基酸结构、系统进化树等进行分析和预测,并运用实时荧光定量PCR(qRT-PCR)技术分析FtF5H基因在厚果壳苦荞与薄果壳苦荞的叶、花、茎、果壳中的差异表达。结果表明:(1)FtF5H基因序列包含1 395 bp的完整cDNA开放阅读框,编码464个氨基酸。(2)FtF5H蛋白具有P450超家族结构,为亲水性稳定酸性蛋白,不具有跨膜结构域,且为非分泌性蛋白。(3)FtF5H蛋白的二级结构主要由α-螺旋和无规则卷曲组成,三级结构预测显示FtF5H蛋白与5ylw.1.A的相似度较高。(4)系统进化分析显示FtF5H属于CYP84A亚家族。(5)qRT-PCR显示FtF5H基因在两种苦荞中的不同部位均有表达,且在厚果壳苦荞果壳中的表达量是薄果壳的5倍,表达具有极显著差异。该研究为进一步研究苦荞木质素合成的分子调控机制奠定了基础,对苦荞新品种的培育具有重要意义。
关键词: 苦荞, RT-PCR克隆, 阿魏酸-5-羟基化酶, 生物信息学分析, 基因表达
中图分类号: Q943
文献标识码: A
文章编号: 1000-3142(2022)02-0304-11
Cloning and expression analysis of FtF5H gene from
tartary buckwheat (Fagopyrum tataricum)
DUAN Ying1, YANG Xiaolin1, CAI Suyun1, HE Runli1*, YIN Guifang2,
WANG Yanqing2, LU Wenjie2, SUN Daowang2, WANG Lihua2
( 1. College of Traditional Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Taiyuan 030619, China; 2. Yunnan
Provincial Key Laboratory of Agricultural Biotechnology/ Key Laboratory of Southwestern Crop Gene Resources and Germplasm
Innovation, Ministry of Agriculture and Rural Affairs, Biotechnology and Germplasm Resources Institute,
Yunnan Academy of Agricultural Sciences, Kunming 650201, China )
Abstract: Ferulate 5-hydroxylase is a key enzyme that regulates the synthesis of S-type lignin. To study the molecular mechanism of ferulate 5-hydroxylase in lignin synthesis pathway of Fagopyrum tataricum, a FtF5H(GenBank accession number: MW455111) gene identified from F. tataricum RNA-seq data was screened and analyzed by bioinformatics methods including the physicochemical properties, signal peptide, transmembrane structure, subcellular localization, hydrophilicity, protein secondary structure and tertiary structure, amino acid structure, as well as phylogenetic tree. In addition, the real-time quantitative PCR (qRT-PCR) was applied to analyze the expression pattern of FtF5H gene in leaves, flowers, stems and husks of thick husk tartary buckwheat and thin husk tartary buckwheat. The results were as follows: (1) FtF5H gene sequence included completed open reading frame with 1 395 bp, coding for 464 amino acids. (2) The FtF5H protein was predicted to have P450 superfamily structure, and FtF5H protein, a non-secretory protein, was a hydrophilic, stable and acidic protein without transmembrane domain. (3) The FtF5H protein secondary structure was predicted to be mainly composed of α-helix and random coil, and its prediction of tertiary structure showed a high similarity with 5ylw.1.A. (4) Phylogenetic analysis showed that FtF5H belonged to the CYP84A subfamily. (5) In addition, qRT-PCR showed that the FtF5H gene was expressed in different parts of the two kinds of tartary buckwheat, and the expression level in the thick husk tartary buckwheat was four times higher than that in the thin husk,with extremely significant differences. The research establish a foundation for further study on the molecular regulation mechanism of lignin synthesis in tartary buckwheat, and has important research significance for the cultivation of new tartary buckwheat varieties.
Key words: tartary buckwheat, RT-PCR cloning, ferulate 5-hydroxylase, bioinformatics analysis, gene expression
苦荞(Fagopyrum tataricum)为药食两用作物,性味苦、平、寒,具益气力、续精神、利耳目、降气、宽肠健胃等作用,被誉为“五谷之王” “三降食品”(朱云辉和郭元新,2014)。栽培苦荞通常果壳较厚,壳比率为20%~30%,果壳坚韧,脱壳率从2%到6%不等(Song et al.,2019),难以脱壳生產整粒苦荞米,不易制得高芦丁含量麸皮层全营养苦荞米,一定程度上降低了苦荞的活性物质与营养功效(陈庆富等,2015);在苦荞种子直接磨粉加工中会有少量壳粉混入,导致适口性下降,也限制了苦荞产品的精深加工,严重影响苦荞产业的发展。‘小米荞’是我国云南、贵州等地的一种易脱壳地方品种,脱壳率最高达93%(Song et al.,2019),作为一种特殊资源,‘小米荞’对研究苦荞薄果壳特性的遗传规律、功能基因、品种培育及加工生产等方面均具有重要的理论和现实意义。
F5H属于细胞色素P450的单氧化物酶(Meyer et al.,1998),Meyer等人于1996年第一次从香枫中分离得到,是CYP84家族成员,具有重要的生物学功能,该基因能催化阿魏酸、松柏醇、松柏醛生成5-羟基阿魏酸、5-羟基松柏醇和5-羟基松柏醛,是调控S型木质素合成的关键酶(Humphreys & Chapple,2002)。目前,已经从拟南芥(Arabidopsis thaliana)(Franke et al.,2000)、当归(Angelica sinensis)(温随超,2015)、毛白杨(Populus tomentosa)(陈雪等,2015)、亚麻(Linum usitatissimum)(王进,2009)、油菜(Brassica campestris)(李扬等,2013)等植物中克隆到F5H基因,但尚未发现F5H基因在苦荞中被克隆的相关报道。
吴朝昕(2020)对厚果壳和薄果壳苦荞的果壳成分研究发现,不同品种厚果壳苦荞的果壳木质素平均含量均高于薄果壳苦荞。课题组前期在‘云荞1号’和‘小米荞’杂交F2代群体中,对厚果壳和薄果壳进行转录组测序比较分析(数据未发表),发现木质素生物合成途径大部分基因在苦荞厚果壳的表达量高于薄果壳,推测苦荞果壳厚可能由于积累了较多的木质素。转录组测序表明F5H基因在厚果壳的表达量显著高于薄果壳。为研究F5H基因在苦荞木质素合成中的作用,本研究采用RT-PCR法克隆‘云荞1号’和‘小米荞’的FtF5H基因,对其进行生物信息学分析、实时荧光定量PCR验证,为进一步研究该基因功能提供依据。
1 材料与方法
1.1 材料
苦荞厚果壳材料‘云荞1号’为云南省农业科学院生物技术与种质资源研究所选育品种,薄果壳材料‘小米荞’为云南省地方品种。剥离‘云荞1号’和‘小米荞’不同发育期的果壳,将剥离的果壳分别混合在一起作为基因克隆的材料;实时荧光定量PCR分析用‘云荞1号’、‘小米荞’不同组织部位材料(结实期的叶、花、茎、果壳)。
1.2 RNA提取与cDNA第一链合成
根据Trizol提取试剂盒说明进行总RNA提取,1.5%琼脂糖凝胶电泳检测所有样品RNA的完整性。cDNA第一链合成:在0.2 mL PCR管中加入5 μL总RNA、1 μL 随机引物、1 μL ddH2O,70 ℃温浴5 min,冰浴2 min,离心加入2.0 μL 5 × First-Strand Buffer、0.5 μL 10 mmol·L-1 dNTP、0.25 μL Rnase inhibitor、0.25 μL Reverse Transcriptase,总体系10.0 μL,42 ℃温浴60 min,72 ℃温浴10 min。
1.3 FtF5H基因克隆
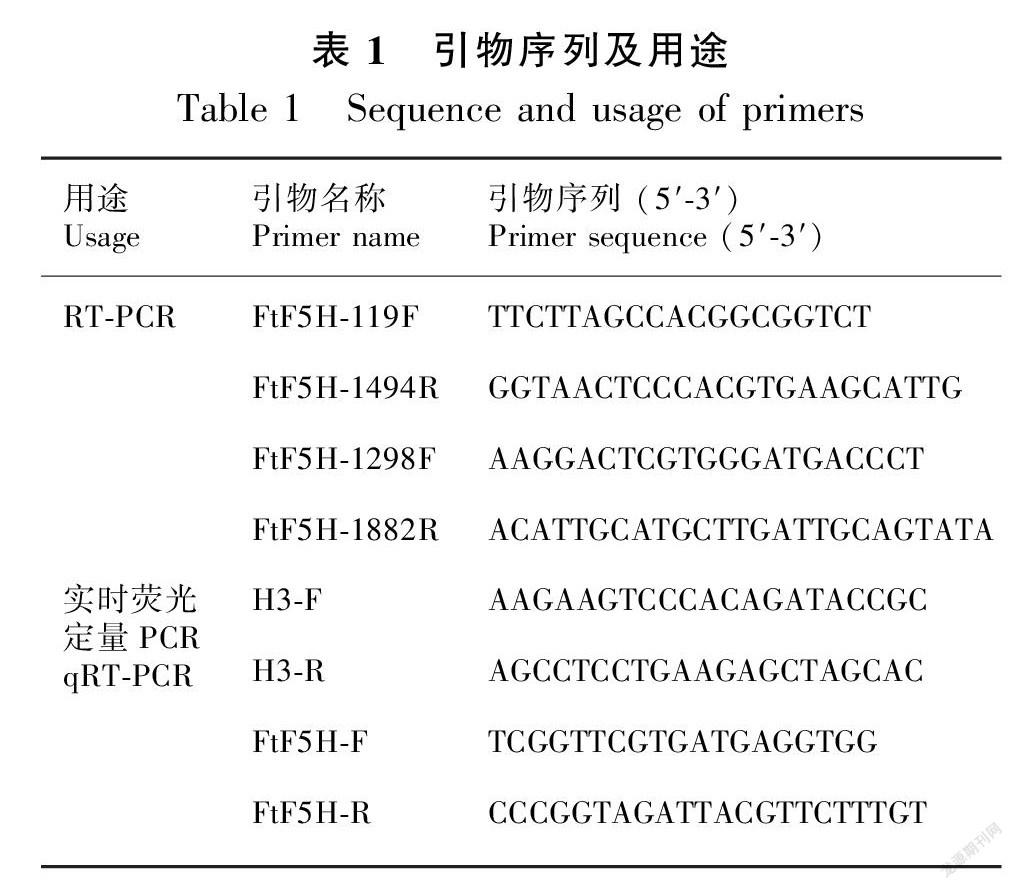
根据转录组测序获得的阿魏酸-5-羟基化酶(FtF5H)基因的核苷酸序列设计4条特异引物(表1)。RT-PCR反应体系如下:cDNA模板1 μL、dNTPs(10 mmol·L-1)0.2 μL、2×GC BufferⅠ12.5 μL、 TaqDNA 聚合酶(5 U·μL-1)0.2 μL、ddH2O 10.1 μL、F(10 μmol·L-1) 0.5 μL、R (10 μmol·L-1) 0.5 μL。PCR反应条件:95 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共循环33次;72 ℃修复延伸7 min。PCR产物用1%琼脂糖凝胶电泳检测,把目的条带切胶回收,送生工生物工程(上海)股份有限公司测序。
1.4 克隆基因的生物信息学分析
利用NCBI ORF finder在线程序及Conserved domains数据库对测序获得的cDNA序列进行开放阅读框及保守功能结构域分析;通过ProtParam对蛋白理化性质进行分析;利用ProtScale对蛋白亲疏水性进行分析;采用TMHMM Server v.2.0 分析编码氨基酸的跨膜结构域;利用SignalP 5.0 Server 预测信号肽;利用NetPhos 3.1 Server进行磷酸化位点预测;利用Psort分析亚细胞定位情况;通过SOPMA及SWISS-MODEL预测蛋白的二级和三级结构;编码蛋白多重序列比对采用DNAMAN软件;Neighbor-joining系统进化树用MEGA 6.0构建(陈媞颖等,2017)。
1.5 实时荧光定量PCR(qRT-PCR)分析
采用Trizol总RNA抽提试剂盒分别提取‘云荞1号’和‘小米荞’叶、花、茎、果壳8个组织的总RNA,反转录得到第一链cDNA,以其为模板进行qRT-PCR分析,每个样品设3次技术重复。实时荧光定量PCR反应体系:10 μL 2 × SG Fast qPCR Master Mix、2 μL cDNA模板、上下引物各0.4 μL、ddH2O 7.2 μL。扩增程序:95 ℃ 3 min ,95 ℃ 5 s,60 ℃ 30 s,循环45次。以苦荞H3(JF769134.1)为内参基因,采用2-ΔΔCt法计算FtF5H的相对表达量,反应所用引物见表1。
2 结果与分析
2.1 苦荞总RNA提取与FtF5H基因克隆
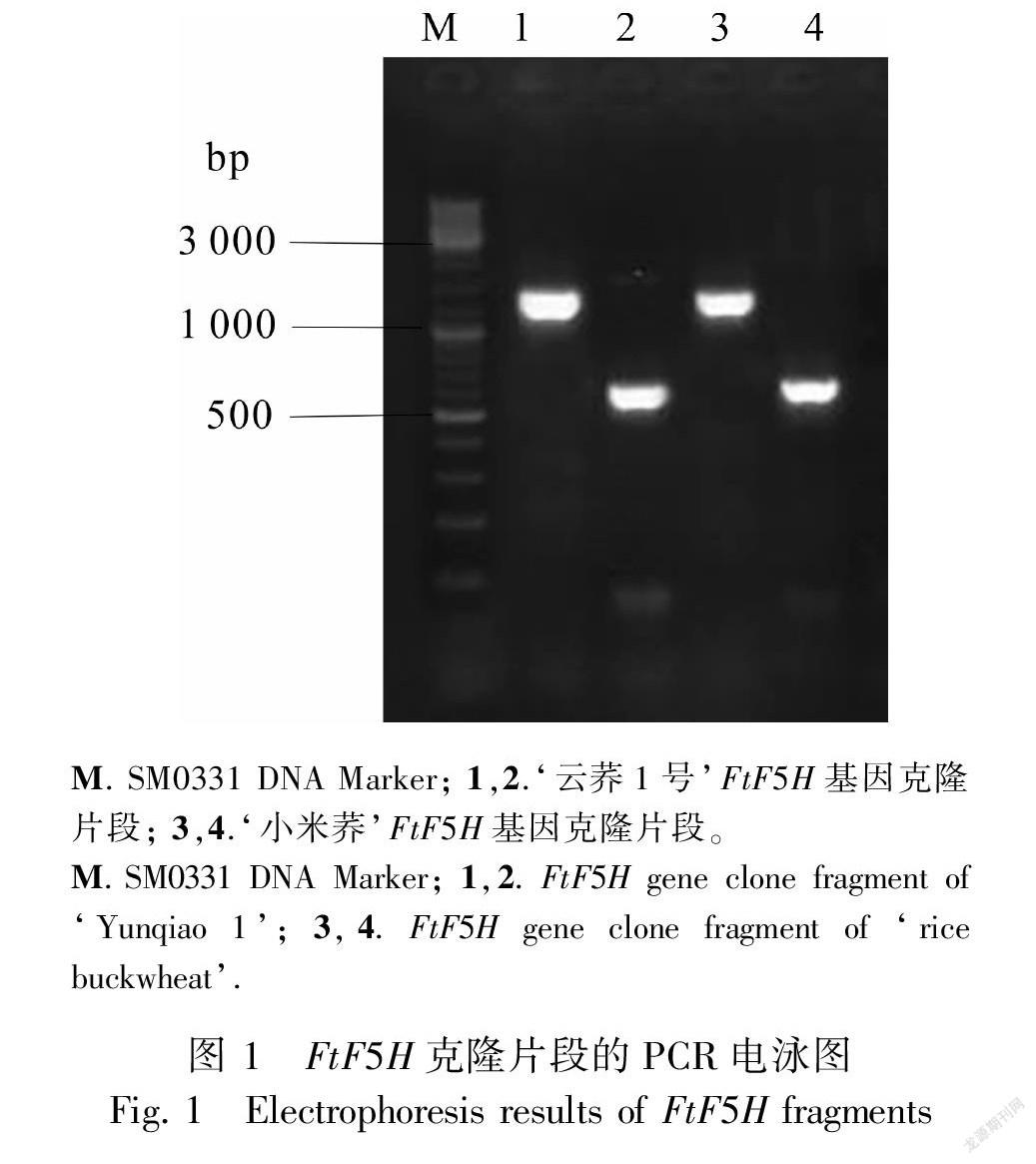
提取的总RNA经1.5%琼脂糖凝胶电泳,在紫外透射光下观察RNA条带清晰可见,亮度比在1∶1~2∶1之间,表明RNA基本未降解,可用于后续基因克隆。利用RT-PCR分别克隆获得‘云荞1号’和‘小米荞’的F5H基因,产物经1.0%琼脂糖凝胶电泳分析,电泳结果见图1。对qRT-PCR产物进行测序拼接,结果发现‘云荞1号’和‘小米荞’的F5H基因核酸序列完全一致,且与转录组测序序列相同。ORF finder分析结果表明,2条基因序列均含有一个完整的长度为1 395 bp的开放阅读框,编码464个氨基酸,将该基因命名为FtF5H(GenBank登录号:MW455111)。利用DNAMAN将核苷酸序列翻译成氨基酸,如图2所示。
2.2 FtF5H基因编码蛋白的生物信息学分析
2.2.1 理化性质分析 利用ProtParam软件对FtF5H蛋白理化性质进行预测,发现FtF5H蛋白分子式为C2346H3677N637O680S28,理论分子量52 583.54 Da,亲水性平均系数(GRAVY)为-0.234,不稳定系数(Ⅱ)为36.57,为稳定蛋白,脂溶指数为82.65,负电荷残基(Asp+Glu)63个,正电荷残基(Arg+Lys)56个,理论等电点5.76,偏酸性,推测该蛋白为亲水性稳定酸性蛋白。通过Conserved domains数据库对FtF5H保守结构域进行分析,发现该蛋白有一个P450保守域,属于P450超家族(图3)。
通过ProtScale在线软件,以Hphob./Kyte & Dodittle为标度,对苦荞FtF5H蛋白质进行了分析,以氨基酸序列为横坐标,氨基酸标度为纵坐标,亲水性越强,则分值越小。FtF5H最高分值1.967出现在多肽链中的第256位氨基酸,该位点的氨基酸疏水性最强;最低分值-2.856出现在362位氨基酸,证明该位点的氨基酸亲水性最强。NetPhos 3.1 Server预测显示,FtF5H整条多肽链中分值在阈值0.5以上的氨基酸位点共有36个,其中丝氨酸(Ser)22个,苏氨酸(Thr)13个,酪氨酸(Tyr)1个。这些位点可能发生磷酸化反应,从而对蛋白的活性与功能产生调控作用。
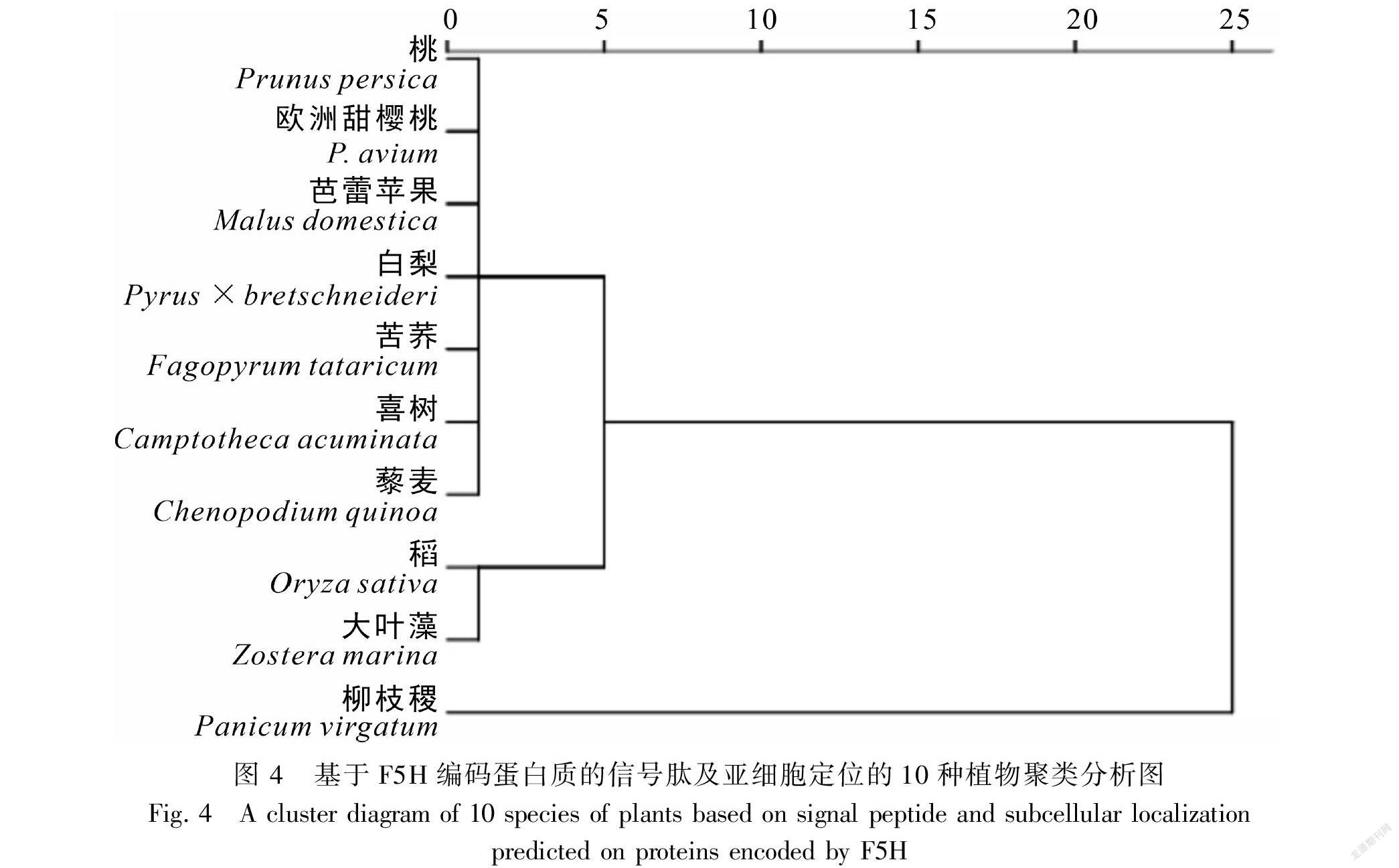
通过SignalP 5.0 Server在线软件对苦荞、芭蕾苹果(XP 008372753.2)、白梨(AGR44939.1)、喜树(AAT39511.1)、稻(BAF43423.1)、桃(XP 007203643.1)、柳枝稷(AFH89638.1)、欧洲甜樱桃(XP 021802881.1)、藜麦(XP 021718110.1)及大叶藻(KMZ63113.1)10種植物的F5H基因的蛋白质信号肽进行预测比对,结果均不存在信号肽,为非分泌性蛋白(表2)。因此,推测F5H基因可能在游离核糖体上合成后不经蛋白转运,直接在细胞质基质的特定部位中行使催化功能(张太奎等,2013)。利用Psort对该10种植物F5H蛋白进行亚细胞定位预测,发现除柳枝稷定位在细胞骨架外,其余均在叶绿体。基于F5H基因编码蛋白的信号肽和亚细胞定位进行SPSS聚类分析,结果见图4,双子叶陆生植物桃、欧洲甜樱桃、芭蕾苹果、白梨、苦荞、喜树、藜麦聚为一支,稻、大叶藻聚为一支,柳枝稷单独为一支,推测与F5H的作用机制有关。
TMHMM软件预测显示,苦荞、柳枝稷、大叶藻不具有跨膜结构域。芭蕾苹果、白梨、喜树、稻、桃、欧洲甜樱桃、藜麦均各含有1个跨膜结构域,说明植物种类不同,其F5H基因编码蛋白质的跨膜区域存在情况不同。
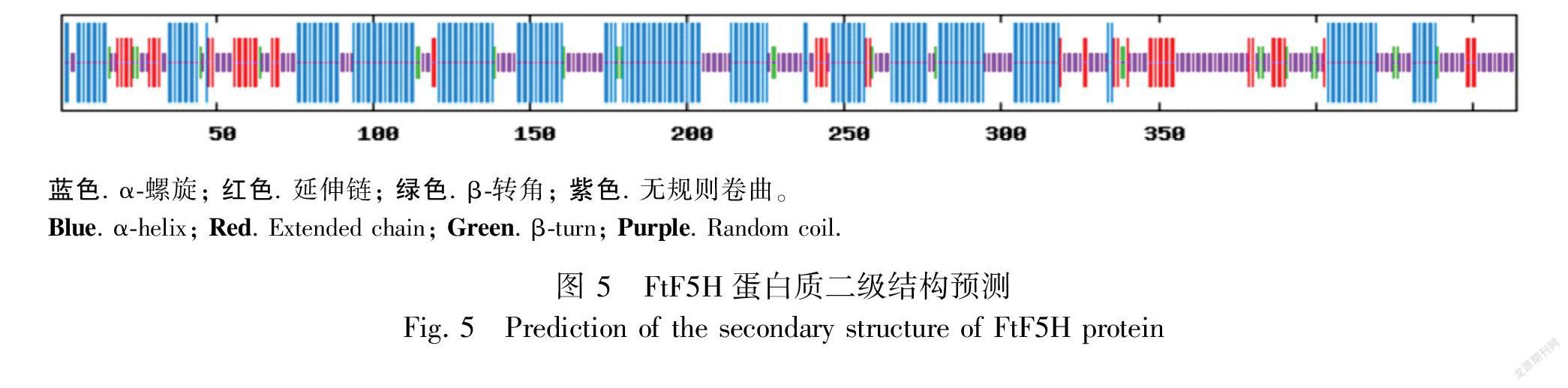
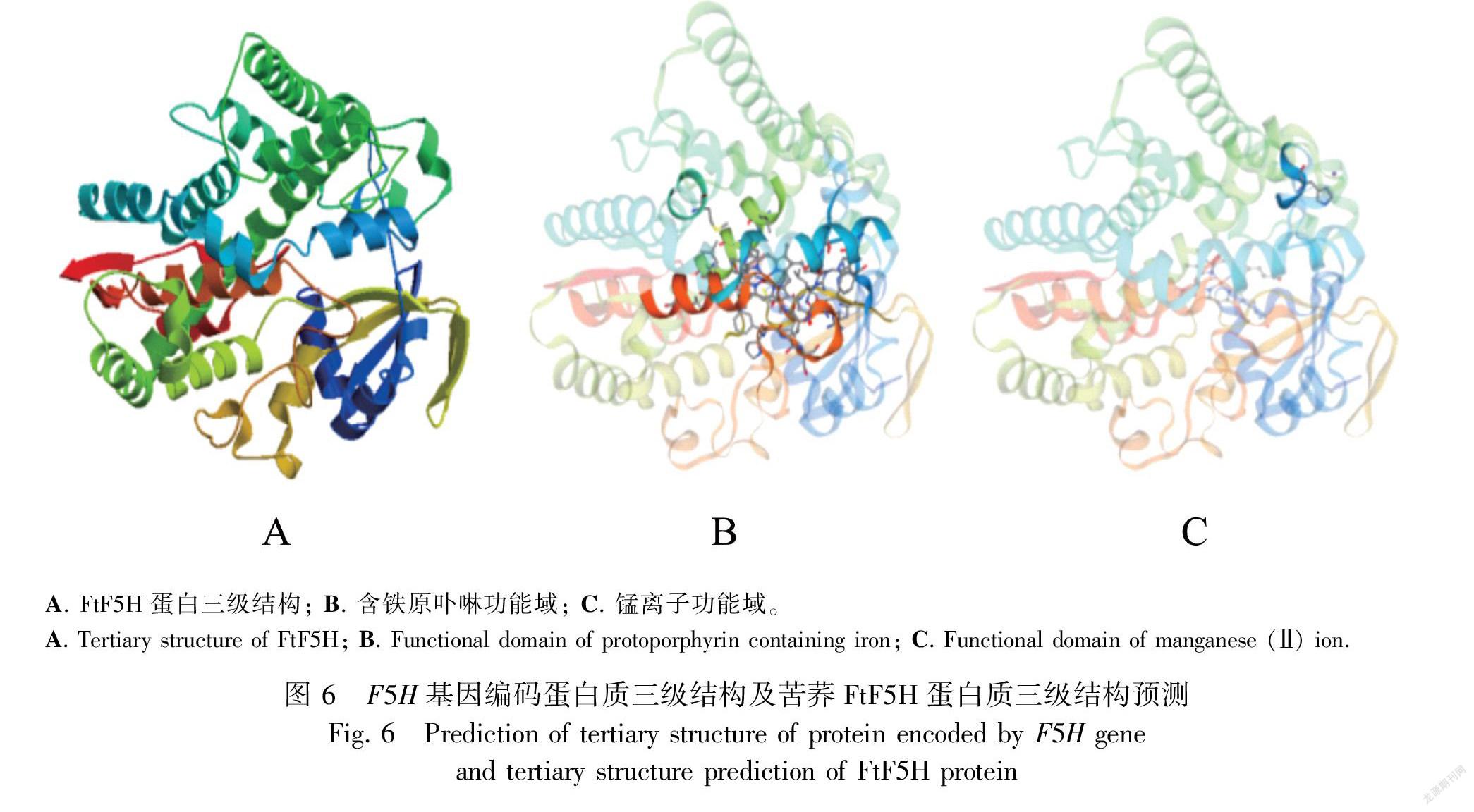
2.2.2 FtF5H的结构预测 通过SOPMA对蛋白质的二级结构进行在线预测,发现FtF5H含有丰富的二级结构,无规则卷曲占36.21%,α-螺旋占46.12%,延伸链占12.28%,β-转角占5.39%(图5)。利用SWISS-MODEL对蛋白质的三级结构进行预测,结果见图6:A。FtF5H蛋白第5位~455位氨基酸与数据库目标蛋白5ylw.1.A的序列相似度为33.49%。QMEAN值是-2.83。GMQE(global model quality estimation,全球性模型质量估测)值为0.71,GMQE值在0~1之间,越接近1,建模质量越好,表明建模可信度高。结合芭蕾苹果(XP 008372753.2)、白梨(AGR44939.1)、新疆梨(QHS84908.1)、喜树(AAT39511.1)、葡萄(XP 002272644.1)、桃(XP 007203643.1)、扁桃(BBH07995.1)、紫苜蓿(ABB02161.1)、欧洲甜樱桃(XP 021802881.1)的蛋白质三维结构骨架进行分析,发现该基因编码的蛋白质具有典型的结构域,即含铁原卟啉功能域(图6:B)和锰离子功能域(图6:C)(张太奎等,2015)。
2.2.3 氨基酸结构分析及系统进化树构建 采用NCBI的BlastP在线程序,查找FtF5H的同源氨基酸序列,比对结果表明FtF5H氨基酸序列与GenBank中相关序列同源性在73.12%~77.42%之间。利用DNAMAN进行多重序列比对, 发现苦荞FtF5H与参与比对植物的F5H氨基酸序列的相似性高达84.79%,含有血红素结合结构域FxxGxxxCxG(图7),其中保守的半胱氨酸充当血红素铁的第五个配体(Chapple,1998),证明FtF5H属于P450家族。
运用MEGA 6.0软件并采用邻接法构建系统进化树,结果显示苦荞FtF5H与藜麦的CYP84A1聚为一小簇,说明其同源性最高,相关研究报道拟南芥阿魏酸-5-羟化酶AtCYP84A1的表达与木质素生物合成的定量以及发育调控有关(Ruegger et al.,1999),本研究克隆得到的苦荞FtF5H与拟南芥及其他植物的CYP84A1聚在一支(图8),说明其可能与苦荞木质素合成及调控有关(Zhang et al.,2019)。
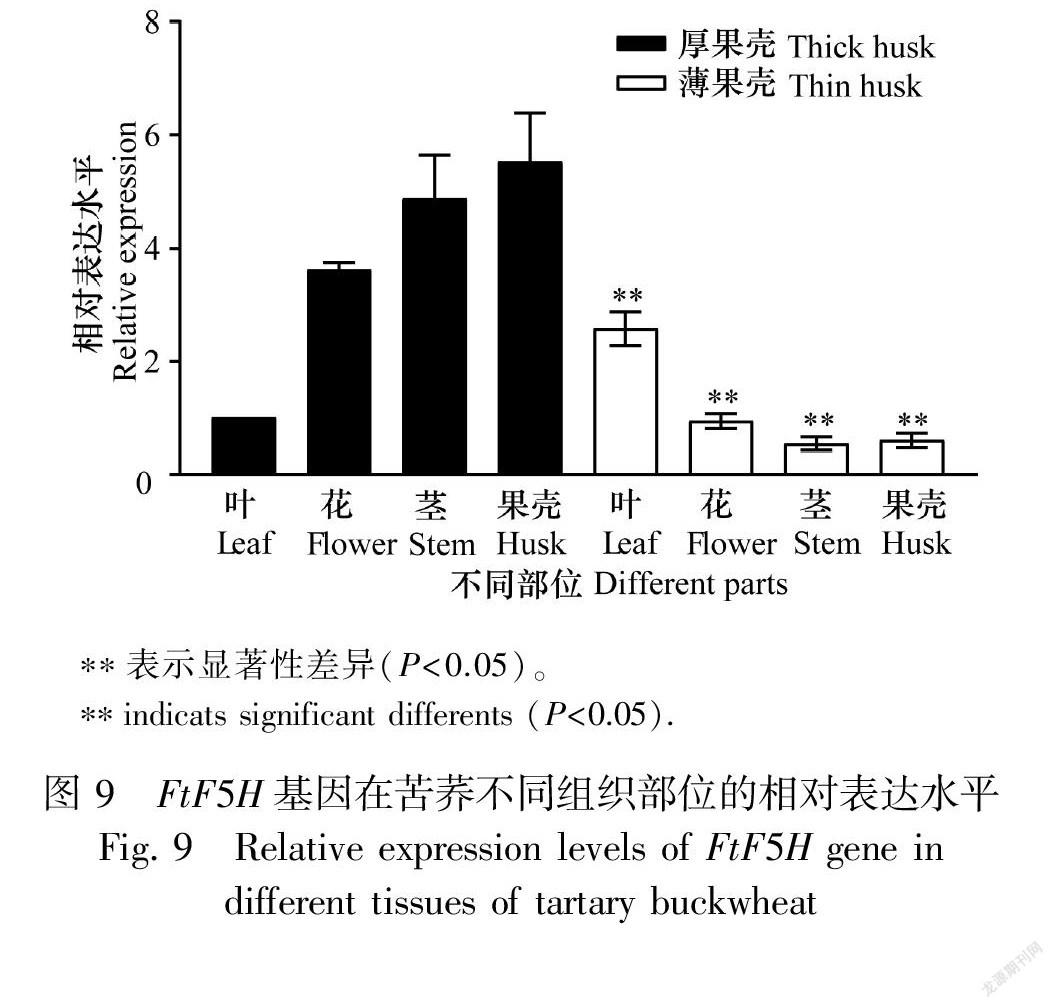
2.2.4 FtF5H基因相对定量分析 实时荧光定量PCR(qRT-PCR)分析FtF5H基因在厚果壳与薄果壳苦荞不同器官的表达水平,结果发现FtF5H
基因在苦荞不同器官的表达量不同, 在厚果壳‘云荞1号’中的相对表达量由小到大依次为叶、花、茎、果壳,而在薄果壳‘小米荞’中则是茎、果壳、花、叶。同一器官相比,除叶外,FtF5H在厚果壳‘云荞1号’各个部位的表达量均高于薄果壳‘小米荞’,且差异极显著(图9)。FtF5H在苦荞厚果壳中的表达量是薄果壳的5倍,与前期转录组实验结果基本一致。
3 讨论与结论
苦荞作为自然界中少见的药食两用作物,具有极高的药用价值及营养功效。如何将薄果壳性状转入栽培品种,育成既易脱壳又高产优质的苦荞新品种成为研究热点。Song等(2019)对厚壳苦荞和薄壳苦荞纤维素和木质素含量变化与脱皮效率之间关系进行研究,结果表明随着脱壳效率的降低(厚壳),木质素含量减少,纤维素含量增加;吴朝昕(2020)发现薄壳苦荞果壳纤维素和木质素含量显著低于厚壳苦荞,二者研究结果不同。本课题组通过转录组测序发现木质素生物合成途径大部分基因在苦荞薄果壳表达量低于厚果壳。为了进一步探究苦荞薄果壳形成的分子机制,本研究克隆了薄果壳和厚果壳的F5H基因,序列比对发现二者序列完全一致,且与转录组测序结果一致。
F5H是调控植物木质素合成的关键酶基因,在木质素形成过程中起重要作用,通过生物信息学分析,发现克隆的苦荞F5H蛋白有一个P450保守域,属于P450超家族,与石榴(冯立娟等,2018)、尾叶桉(肖玉菲等,2018)、毛白杨(王轶男等,2014)中的研究结果一致。苦荞F5H蛋白有数量不同的丝氨酸、蘇氨酸、酪氨酸3个磷酸化位点,与石榴(冯立娟等,2018)中的研究结果一致。F5H磷酸化后可以改变蛋白质活性,从而调节苦荞的生长发育过程。多重序列比对发现苦荞FtF5H与其他植物F5H氨基酸序列的相似性高达84.79%,证明该基因比较保守。系统进化分析结果表明,苦荞FtF5H基因与藜麦亲缘关系最近,且与其他双子叶植物的F5H基因亲缘较近,而与单子叶植物水稻、柳枝稷、稷、黄藤的亲缘关系较远,表明该基因在双子叶及单子叶植物纲之间同源性差异较大。
Shafrin等(2015)下调黄麻的F5H基因,发现与非转基因植物相比,整个茎中酸不溶性木质素含量降低约25%,纤维木质素降低12%~15%。肖玉菲等(2018)在对尾叶桉的研究中发现,EuF5H在半木质化茎中表达量最高,在嫩茎中最低。甘蓝型油菜植株根、根茎和茎中木质素含量高低与抗倒能力成正相关,且F5H基因在抗倒伏油菜薹期根部、茎部以及开花期根部表达量明显高于易倒伏材料(李尧臣和戚存扣,2011)。本研究FtF5H基因在厚果壳‘云荞1号’茎、花、果壳的表达量均高于薄果壳‘小米荞’,各器官之间的表达有极显著差异,且FtF5H在厚果壳中的表达量是薄果壳的5倍,推测FtF5H基因在薄果壳苦荞低表达与薄果壳的木质素合成和积累少有关。
Takeda等(2017)对水稻的研究发现,OsF5H1表达是控制水稻细胞壁中S/G木质素组成的主要因素。徐超等(2015)对砀山酥梨果实F5H基因的研究发现PbF5H参与调控梨果实S木质素单体的合成,影响木质素G/S比值。Tetreault等(2020)的研究发现,高粱F5H(SbF5H)的过表达增加了S-木质素含量。木质素合成有着复杂的代谢网络,多个基因共同调控它的代谢。F5H基因作为一个多基因家族,并非所有F5H基因均在G/S的转化中发挥作用。因此,本研究获得的FtF5H基因在薄果壳苦荞木质素生物合成途径的功能仍需进一步研究。
参考文献:
CHAPPLE C, 1998. Molecular-genetic analysis of plant cytochrome P450-dependent monooxygenases [J]. Ann Rev Plant Physiol Plant Mol Biol, 49(1): 311-343.
CHEN QF, CHEN QJ, SHI TX, et al., 2015. Inheritance of tartary buckwheat thick shell character and its relationships with yield factors [J]. Crops, 2 : 27-31. [陈庆富, 陈其饺, 石桃雄, 等, 2015. 苦荞厚果壳性状的遗传及其与产量因素的相关性研究 [J]. 作物杂志, 2 : 27-31.]
CHEN X, CHEN XM, GAI Y, 2015. Lignin biosynthesis in tobacco with regulated expression of poplar ferulate 5-hydroxylase [J]. Guangdong Agric Sci, 42(11): 42-47. [陈雪, 陈雪梅, 盖颖, 2015. 毛白杨阿魏酸-5-羟基化酶对烟草木质素的影响 [J]. 广东农业科学, 42(11): 42-47.]
CHEN TY, LIU J, YUAN Y, et al., 2017. Bioinformatics analysis and expressed level of Auxin response factor genes in Scutellaria baicalensis [J]. Acta Pharm Sin, 52(11): 1770-1776. [陈媞颖, 刘娟, 袁媛, 等, 2017. 黄芩ARF基因家族生物信息学及表达分析 [J]. 药学学报, 52(11): 1770-1776.]
FRANKE R, MCMICHA CM, MEYER K, et al., 2000. Modified lignin in tobacco and poplar plants over-expressing the Arabidopsis gene encodingferulate 5-hydroxylase [J]. Plant J, 22(3): 223-234.
FENG LJ,YIN YL,YANG XM, et al., 2018. Identification and Bioinformatics Analysis of F5H Gene Family in Pomegranate [C]//Pomegranate Branch of the Chinese Horticultural Society. Progress in Research on Pomegranate in China (3)—The 3rd Representative Conference of the Pomegranate Branch of the Chinese Horticultural Society and the First China Sihong Soft Seed Pomegranate Summit Forum, Proceedings of the National Pomegranate Industry Technology Innovation Alliance Preparatory Meeting. Sihong: Chinese Horticultural Society: 9. [馮立娟, 尹燕雷, 杨雪梅, 等, 2018. 石榴F5H基因家族的鉴定与生物信息学分析 [C]//中国园艺学会石榴分会.中国石榴研究进展(三)—第三届中国园艺学会石榴分会会员代表大会暨首届中国泗洪软籽石榴高峰论坛、 国家石榴产业科技创新联盟筹备会论文集 [C]. 泗洪: 中国园艺学会: 9.]
HUMPHREYS JM, CHAPPLE C, 2002. Rewriting the lignin roadmap [J]. Curr Opin Plant Biol, 5(3): 224-229.
LI YC, QI CK, 2011. Lignin content and key gene expression in lignin synthesis of Brassica napus L.with lodging resistance [J]. Jiangsu J Agric Sci, 27(3): 481-487. [李尧臣, 戚存扣, 2011. 抗倒伏甘蓝型油菜(Brassica napus L.)木质素含量及木质素合成关键基因的表达 [J]. 江苏农业学报, 27(3): 481-487.]
LI Y, GU H, QI CK, 2013. Expression of lignin synthesis key genes of F5H, 4CL and COMT on lodging resistance of Brassica napus L. [J].Chin J Oil Crop Sci, 35(1): 24-28. [李扬, 顾慧, 戚存扣, 2013. 甘蓝型油菜木质素合成关键基因F5H、4CL和COMT的定量表达 [J]. 中国油料作物学报, 35(1): 24-28.]
MEYER K, CUSUMANO JC, SOMERVILLE C, et al., 1996. Ferulate-5-hydroxylase from Arabidopsis thaliana defines a new family of cytochrome P450-dependent monooxygenases [J]. Proc Natl Acad Sci USA, 93(14): 6869-6874.
MEYER K, SHIRLEY AM, CUSUMANO JC, et al., 1998. Lignin monomer composition is determined by the expression of a cytochrome P450-dependent monooxygenase in Arabidopsis [J]. Proc Natl Acad Sci USA, 95 (12): 6619-6623.
RUEGGER M, MEYER K, CUSUMANO JC, et al., 1999. Regulation of ferulate-5-hydroxylase expression in Arabidopsis in the context of sinapate ester biosynthesis [J]. Plant Physiol, 119(1): 101-110.
SHAFRIN F, DAS SS, SANAN-MISHRA N, et al., 2015. Artificial miRNA-mediated down-regulation of two monolignoid biosynthetic genes(C3H and F5H) cause reduction in lignin content in jute [J]. Plant Mol Biol, 89(4-5): 511-527.
SONG C, MA CR, XIANG DB, 2019. Variations in accumulation of lignin and cellulose and metabolic changes in seed hull provide insight into dehulling characteristic of tartary buckwheat seeds [J]. Int J Mol Sci, 20(3): 524.
TAKEDA Y, KOSHIBA T, TOBIMATSU Y, et al., 2017. Regulation of CONIFERALDEHYDE 5-HYDROXYLASE expression to modulate cell wall lignin structure in rice [J]. Planta, 246(2): 337-349.
TETREAULT HM, GRIES T, PALMER NA, et al., 2020. Overexpression of ferulate 5-hydroxylase increases syringyl units in Sorghum bicolor [J]. Plant Mol Biol, 103(3): 269-285.
WANG J, 2009. Cloning and expression analysis of flax (Linum usitatissimum) critical lignin metabolism genes [D]. Beijing: Chinese Academy of Agricultural Sciences: 1-66. [王进, 2009. 亚麻(Linum usitatissimum)木质素合成关键酶基因的克隆及表达分析 [D]. 北京: 中国农业科学院: 1-66.]
WANG YN, CHEN X, GAI Y, 2014. Cloning and bioinformatics analysis on lignin synthetase gene Ferulate-5-hydroxylase of Populus tomentosa [J].Guangdong Agric Sci,41(20):131-135. [王轶男, 陈雪, 盖颖, 2014. 毛白杨木质素合成酶基因F5H克隆与生物信息学分析 [J]. 广东农业科学, 41(20): 131-135.]
WEN SC, 2015. Effect of potassium on related genes expression of ferulic acid biosynthesis in Chinese Angelica [D]. Lanzhou: Gansu University of Traditional Chinese Medicine: 1-87. [温随超, 2015. 钾素营养对当归阿魏酸生物合成相关基因表达的影响 [D]. 兰州: 甘肃中医药大学: 1-87.]
WU CX, 2020. Shell structure of ricetartary buckwheat and its transcriptome analysis during development [D]. Guiyang: Guizhou Normal University: 1-82. [吴朝昕, 2020. 薄壳苦荞果壳结构及其发育中的转录组学分析 [D]. 贵阳: 贵州师范大学: 1-82.]
XU C, FANG Z, YANG FM, et al., 2015. Analysis of F5H expression and stone cell development in Pyrus bretschneideri cv. Dangshan Su fruit [J]. Plant Physiol J, 51(5): 778-784. [徐超, 方志, 杨芳梅, 等, 2015. 砀山酥梨果实F5H表达与石细胞发育的分析 [J]. 植物生理学报, 51(5): 778-784.]
XIAO YF, LIU HL, LIU XS, et al., 2018. Cloning, expression and sequence analysis of F5H gene in Eucalyptus urophylla clone GLU4 [J]. Biotechnology, 28(3): 205-211. [肖玉菲, 劉海龙, 刘雄盛, 等, 2018. 尾叶桉GLU4无性系F5H基因的克隆表达及序列分析 [J]. 生物技术, 28(3): 205-211.]
ZHANG TK, LIU Z, ZHU FM, et al., 2013. Bioinformatics analysis of chalcone synzyme genes from ten kinds of ornamental plants [J]. J W Chin For Sci, 42(5): 62-68. [张太奎, 刘峥, 朱芳明, 等, 2013. 10种观赏植物查尔酮合成酶基因生物信息学分析 [J]. 西部林业科学, 42(5): 62-68.]
ZHU YH, GUO YX, 2014. Research progress in development and utilization of tartary buckwheat resource in China [J]. Sci Technol Food Ind, 35(24): 360-365. [朱云辉, 郭元新, 2014. 我国苦荞资源的开发利用研究进展 [J]. 食品工业科技, 35(24): 360-365.]
ZHANG TK, ZONG D, ZHU FM, et al., 2015. The marker gene ACO of fruits preservation [J]. J Yunnan Agric Univ(Nat Sci Ed), 30(2): 245-251. [张太奎, 纵丹, 朱芳明, 等, 2015. 果树果实保鲜力强弱标记基因ACO [J]. 云南农业大学学报(自然科学), 30(2): 245-251.]
ZHANG TK, LIU CY, HUANG XB, et al., 2019. Land-plantphylogenomic and pomegranate transcriptomic analyses reveal an evolutionary scenario of CYP75 genes subsequent to whole genome duplications [J]. J Plant Biol , 62 : 48-60.
(责任编辑 蒋巧媛)
收稿日期: 2021-03-11
基金项目: 国家自然科学基金地区科学基金(31460379);国家燕麦荞麦产业技术体系“荞麦病虫害防控”项目(CARS-07-C-2);山西省重点研发计划项目(201803D221012-6);阳泉市中药材产业专项(SZY-YQZX-2019005) [Supported by National Natural Science Foundation of China (31460379); National Technical System of Oat and Buckwheat “Plant Diseases and Insect Pests Control of Buckwheat”(CARS-07-C-2); Key Research and Development Project of Shanxi (201803D221012-6); Special Project of Traditional Chinese Medicine Industry in Yangquan City (SZY-YQZX-2019005)]。
第一作者: 段迎(1996-),硕士研究生,主要研究方向为中药资源开发与利用,(E-mail)18434376630@163.com。
*通信作者: 贺润丽,博士,教授,主要研究方向为中药资源开发与利用,(E-mail)herunli666@163.com。
2077501186393
