阿托伐他汀通过抑制ERK/MAPK信号通路改善H2O2诱导的血管内皮细胞损伤的机制研究
2022-03-15解小萌崔丽杰刘海涛
解小萌,崔丽杰,刘海涛
高血压和动脉粥样硬化严重威胁人类的生命健康[1]。作为组织和血液间的屏障,血管内皮细胞在血管生成及创伤修复等过程中起着重要作用,研究已证实,血管内皮细胞损伤和功能障碍与高血压和动脉粥样硬化有密切关系[2]。因此,寻找能够保护内皮细胞免受损伤的方法,对心血管疾病的预防及治疗具有重要意义。阿托伐他汀是常用的血脂调节药物,具有降低血脂含量,减少动脉斑块发生以及改善血管内皮、抑制血管炎症反应的作用[3]。目前,虽已证实阿托伐他汀对改善血管内皮炎症反应具有积极影响[4],但其对血管内皮细胞损伤保护作用的分子机制研究依然很少。Xu等[5]研究表明,氧化应激是导致内皮细胞损伤的主要病理因素。本研究利用H2O2诱导人脐静脉内皮细胞(HUVECs)氧化应激损伤[6]建立细胞损伤模型,探讨阿托伐他汀对血管内皮细胞损伤的保护作用,并进一步研究其可能的分子机制,以期为心血管疾病的机制研究及临床治疗提供新的可行性方案。
1 材料和方法
1.1 细胞和受试药物人脐静脉内皮细胞(HUVECs)购自中国科学院细胞库。阿托伐他汀由美国Sigma-Aldrich公司生产,使用前将4.2 mg阿托伐他汀药物溶于0.1 ml的95%乙醇中,滴加0.1 mol/L NaOH溶液调节PH值至7.2,50℃水浴中孵育2 h,得到浓度为1 mol/L的阿托伐他汀溶液,-20℃保存以待使用。
1.2 主要试剂及仪器ɑ-MEM培养基、新生胎牛血清购自美国Hyclone公司;四甲基偶氮盐(MTT)购自美国Sigma公司;H2O2溶液购自北京生物技术公司,4℃避光保存。乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所;RIPA细胞裂解液、蛋白定量试剂盒购自美国Thermo Fisher Scientific公司;免疫印迹一抗p-ERK1/2、ERK1/2、p38MAPK、p-p38 MAPK购自美国Cell Signaling Technology公司;垂直电泳仪购自美国Bio-Rad公司;全功能荧光酶标仪购自瑞士Tecan公司。
1.3 实验方法
1.3.1 细胞培养与分组HUVECs细胞用含有10%胎牛血清和1%青/链霉素双抗的ɑ-MEM培养基于37℃、5%CO2、饱和湿度环境中培养。将对数生长期的HUVECs细胞分为5组:空白对照组(常规培养)、模型组(100 μmol/L H2O2处理)、阿托伐他汀组(10 μmol/L阿托伐他汀+100 μmol/L H2O2)、U0126组(100 μmol/L ERK/MAPK信号通路抑制剂U0126+100 μmol/L H2O2)、阿托伐他汀+LM22B-10组(10 μmol/L阿托伐他汀和100 μmol/L ERK/MAPK信号通路激活剂LM22B-10+100 μmol/L H2O2)。待细胞密度约为80%时,改用无血清培养基饥饿培养2 h,阿托伐他汀组、U0126组、阿托伐他汀+LM22B-10组分别用相应药物处理6 h,100 μmol/L H2O2处理18 h。
1.3.2 细胞活性检测细胞分组处理后,每孔加入MTT 20 μl,于37℃、5%CO2的培养箱中继续培养4 h,离心弃上清液后,每孔加入二甲亚砜200 μl,振荡10 min,放入酶标仪在570 nm波长处测定吸光度A值。细胞存活率(%)=A实验组/A空白组×100% 。在研究前需要研究阿托伐他汀的细胞毒性,用不同浓度的阿托伐他汀(0.01、0.1、1、10、100 μmol/L)处理细胞6 h,用MTT法检测细胞活性。
1.3.3 吖啶橙(AO)/溴化乙锭(EB)核染色用AO/EB染色法观察了H2O2诱导的细胞核形态学变化。将细胞以密度为3×104/cm2的细胞接种在6孔板上,处理方式同1.3.1。加入5 μl AO/EB(g/ml)。在室温下培养10 min后,用荧光显微镜(Ix71型,日本奥林巴斯公司)观察。随机观察至少300个细胞,计算细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.3.4 细胞内LDH、MDA、SOD、GSH-Px含量检测收集各组细胞并离心(室温,3000 r/min离心5 min)。超声破碎细胞后获得匀浆,严格按试剂盒说明书方法,分别检测细胞内 LDH、MDA、SOD、GSH-Px含量。
1.3.5 ROS含量检测用2 μl 2’-7’-二氯荧光素二乙酸酯(DCFH-DA)测定细胞内ROS含量,收集各组细胞,置于无胎牛血清的ɑ-MEM培养基中,加入2 μl DCFH-DA,最终浓度为20 mmol/L,室温下孵育30 min。随后,采用流式细胞仪检测各组细胞DCF荧光强度。激发波长为485 nm,发射波长为530 nm。
1.3.6 ERK/MAPK信号通路相关蛋白检测收集细胞并用RIPA裂解液(4%十二烷基磺酸钠+2 mmol/L EDTA+50 mmol/L Tris-HCl,pH6.8)裂解细胞提取细胞总蛋白。Bradford法定量蛋白浓度。各组取40 μg蛋白样本进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,转移至聚偏氟乙烯膜上。用生理盐水/1% Tween-X缓冲液加5%脱脂奶粉在室温下培养1 h,阻断非特异性结合。用ERK1/2、p-ERK1/2抗体、p38 MAPK、p-p38 MAPK(1:1000)在4℃培养过夜,用辣根过氧化物酶结合的抗小鼠二抗(1:5000)室温培养2 h。ECL化学发光法显影,并用GAPDH为内参计算各组蛋白相对表达量。
1.4 统计分析使用SPSS 19.0统计分析软件进行数据分析。符合正态分布的计量资料以均值±标准差(±s)表示,多组间比较采用单因素方差分析,随后进行多重比较检验。P<0.05为差异有统计学意义。
2 结果
2.1 阿托伐他汀细胞毒作用不同浓度阿托伐他汀(0.01、0.1、1、10、100 μmol/L)作用于HUVECs 6 h后,细胞存活率分别为(99.47±2.69)%、(101.15±3.13)%、(97.56±2.35)%、(97.30±3.38)%、(92.45±3.45)%,均不低于90%,说明当浓度≤100 μmol/L时,阿托伐他汀对HUVECs均无明显毒性。考虑到阿托伐他汀100 μmol/L时,HUVECs存活率有降低趋势,我们选取10 μmol/L作为实验用浓度(图1A)。
2.2 阿托伐他汀对H2O2诱导的血管内皮细胞活性的影响与空白对照组相比,模型组细胞存活率为(67.42±3.39)%,较空白对照组显著降低(P<0.05);而阿托伐他汀组(85.40±5.51)%和U0126组(78.14±3.75)%细胞存活率均低于空白对照组,但均高于模型组(P<0.05);此外,阿托伐他汀+LM22B-10组细胞存活率(72.68±2.84)%同样高于模型组,但是低于空白对照组和阿托伐他汀组(P<0.05),图1B。

图1 阿托伐他汀对H2O2诱导的血管内皮细胞增殖活性的影响
2.3 阿托伐他汀对H2O2诱导的血管内皮细胞凋亡的影响经AO/EB染色观察细胞核形态变化。结果显示,与空白对照组比较,模型组细胞凋亡率显著增加[(39.26±5.35)% vs.(4.48±2.20)%,P<0.05];阿托伐他汀组(18.75±2.70)%和U0126组(23.82±3.30)%细胞凋亡率均较空白对照组高,但均较模型组低(P<0.05);此外,阿托伐他汀+LM22B-10组细胞凋亡率(32.76±4.48)%亦较模型组低,但高于空白对照组、阿托伐他汀组和U0126组(P<0.05),图2。
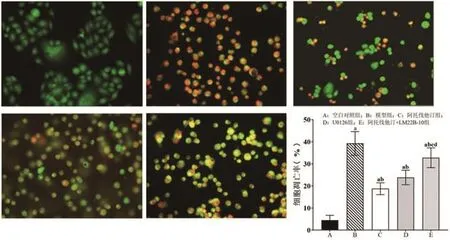
图2 阿托伐他汀对H2O2诱导的血管内皮细胞凋亡的影响(×400)
2.4 阿托伐他汀对H2O2诱导的血管内皮细胞氧化应激相关因子的影响与空白对照组比较,模型组细胞中LDH、MDA含量显著升高,SOD、GSH-Px含量显著降低(P<0.05);阿托伐他汀组和U0126组细胞中LDH、MDA含量较空白对照组高而较模型组低,SOD、GSH-Px含量较空白对照组低而较模型组升高(P<0.05);此外,阿托伐他汀+LM22B-10组细胞中LDH、MDA含量较模型组降低而较空白对照组和阿托伐他汀组高,同时SOD、GSH-Px含量较模型组高而较空白对照组、阿托伐他汀组和U0126组降低(P<0.05),表1。

表1 阿托伐他汀对HUVECs细胞中LDH、MDA、SOD、GSH-Px含量的影响
2.4 阿托伐他汀对H2O2诱导的血管内皮细胞ROS生成的影响细胞内ROS含量由细胞渗透性DCFH-DA光源的荧光2’,7’-二氯荧光素(7'-Dichlorofluorescein,DCF)确定。模型组的DCF荧光强度为5876.59±768.45,显著高于空白对照组(386.23±52.64)(P<0.05);阿托伐他汀组和U0126组细胞的ROS含量(DCF荧光强度分别为1870.43±236.20和2898.86±542.44)较空白对照组高但较模型组低(P<0.05);此外,阿托伐他汀+LM22B-10组细胞ROS含量(DCF荧光强度:4096.58±435.22)较模型组低,但较空白对照组、阿托伐他汀组和U0126组高(P<0.05),图3。
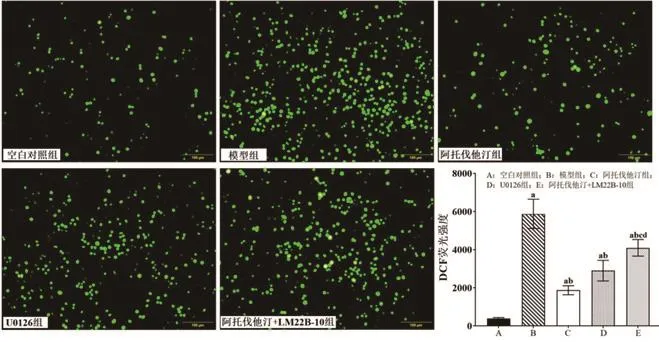
图3 阿托伐他汀对H2O2诱导的血管内皮细胞ROS生成的影响(×100)
2.5 阿托伐他汀对ERK/MAPK信号通路的影响与空白对照组比较,模型组中p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK蛋白表达比值上调;阿托伐他汀组和U0126组p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK蛋白表达比值高于空白对照组,但较模型组降低(P<0.05);此外,阿托伐他汀+LM22B-10组p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK蛋白表达比值则高于空白对照组、阿托伐他汀组和U0126组(P<0.05),表2及图4。
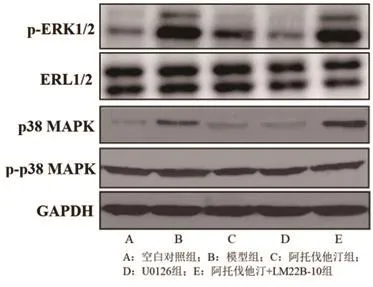
图4 阿托伐他汀对ERK/MAPK信号通路相关蛋白表达的影响

表2 Western blot法检测各组细胞中p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK比值差异
3 讨论
近年来,随着生活习惯及饮食文化的改变,心血管疾病的发病率急剧上升且呈年轻化趋势,研究心血管疾病的发病机制及开发新的心血管保护措施,对心血管疾病的预防与控制具有重大意义。农毅清等[2]研究证明血管内皮细胞损伤和功能的改变在心血管疾病发病过程中起着重要的作用。由于氧化应激可使细胞膜上不饱和脂肪酸发生脂质过氧化,进而使蛋白质和核酸变性,因而被认为是导致内皮细胞损伤的主要病理因素[7]。本研究以H2O2诱导的HUVECs细胞氧化损伤为模型,探讨阿托伐他汀对氧化损伤HUVECs细胞增殖、凋亡以及细胞氧化应激相关因子的影响,进一步探讨了其可能的分子机制。
之前的研究表明,氧化应激在激活细胞凋亡和神经元细胞死亡的调控中发挥基础性作用[8]。ROS是生物有氧代谢的产物,ROS的产生导致脂质过氧化作用,ROS的形成总是伴随着抗氧化酶系统的上调,如SOD[9]和GSH-Px[10]。本实验发现,H2O2诱导后血管内皮细胞存活率显著下降,ROS含量和LDH漏出明显增多,细胞凋亡率明显增加,SOD和GSH-Px含量则显著下降。这些结果表明H2O2能显著抑制血管内皮细胞的抗氧化能力,引发细胞发生氧化应激,导致细胞凋亡增加。而经阿托伐他汀处理后,H2O2诱导的HUVECs细胞死亡和凋亡率均显著降低,增殖活性亦显著高于H2O2模型组,同时细胞中MDA的含量以及ROS释放量均降低,而SOD和GSH-Px的含量则升高,说明阿托伐他汀通过调节氧化应激反应和抑制细胞凋亡明显降低H2O2诱导的血管内皮细胞损伤。
丝裂原活化蛋白激酶(MAPKs)能够调控包括细胞生长、发育、分裂、死亡及应激凋亡等在内的多种生理过程[11]。其中,磷酸化的ERK1/2、p38 MAPK由细胞质转移到细胞核中,可调节许多蛋白质、酶和转录因子的活性,进而参与细胞对外部刺激的生物反应[12,13]。越来越多研究表明,ERK1/2、p38 MAPK是动脉粥样硬化发病机制中内皮细胞炎症和凋亡的关键靶点[14]。本研究中,H2O2诱导HUVECs产生大量ROS,进而促使血管内皮功能障碍,同时伴随着内皮细胞的凋亡。同时,模型组中p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK蛋白表达比值上调,而阿托伐他汀组p-ERK1/2/ERK1/2、p-p38 MAPK/p38 MAPK蛋白表达比值则较模型组显著下调。说明阿托伐他汀通过抑制ERK1/2、p38 MAPK磷酸化激活,进而抑制ROS过度产生引起的HUVECs细胞凋亡,从而减轻H2O2诱导的内皮细胞损伤。为进一步验证阿托伐他汀是否通过调节ERK/MAPK信号传导途径影响H2O2诱导的血管内皮细胞的活性,在实验中使用了ERK/MAPK抑制剂U0126及阿托伐他汀与ERK/MAPK激活剂LM22B-10组合。结果表明,用U0126处理后,H2O2诱导的血管内皮细胞的恶性生物学行为受到抑制,ERK1/2和p38 MAPK蛋白的磷酸化水平明显降低。ERK/MAPK激活剂LM22B-10的处理则能够逆转该趋势。以上数据提示,阻断ROS/ERK/MAPK信号通路可能是阿托伐他汀在H2O2诱导的血管内皮功能障碍中发挥保护作用的原因。
综上所述,阿托伐他汀通过抑制ERK/MAPK信号通路改善H2O2诱导的血管内皮细胞凋亡和氧化应激损伤,该研究为阿托伐他汀在心血管领域的应用提供新的证据支持。
