双重RAS阻断与单药治疗在非老年CKD1-3a期糖尿病肾病的疗效及安全性比较分析*
2022-03-15赵贵盛赵洪雯申兵冰
梅 玫,方 利,赵贵盛,张 倩,赵洪雯,申兵冰△
(1.陆军军医大学第一附属医院肾内科,重庆 400038;2.重庆市沙坪坝区人民医院肾内科 400030;3.重庆市西南铝医院血液透析科 401326)
我国糖尿病发病率逐年增高,并且糖尿病肾病已逐渐成为终末期肾病(ESRD)的最主要原因[1]。目前,肾素-血管紧张素系统(renin-angiotensin system,RAS)阻断已成为治疗糖尿病肾病的基础策略[2]。虽然近年来钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂、二肽基肽酶-4(DDP-4)抑制剂等在糖尿病及肾损伤的治疗中取得了重大进展[3-5],但这些新药仍需联合充分的RAS阻断治疗。目前,临床上常用的RAS阻断剂包括血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)和血管紧张素Ⅱ受体阻滞剂(angiotensin Ⅱ type 1 receptor blocker,ARB)。对于RAS阻断策略,目前临床存在的重大争议问题就是:究竟是双重RAS阻断策略好,还是优化剂量的ACEI/ARB单药阻断更佳?早期研究显示,ACEI和ARB联合治疗能更好地减少蛋白尿,保护肾脏。但这些研究的样本量较小,其说服力有限[6]。随后的多项临床试验,包括ONTARGET研究、ALTITUDE研究、VA NEPHRON-D研究[7-9]等却发现联合用药未明显增加心肾获益,反而增加了高血钾症、低血压和急性肾损伤(AKI)的发生风险。所以目前心血管领域的指南[10-11]并未推荐ACEI与ARB联用,倾向于优化剂量的单药阻断仍是首选策略[12-13]。但是,仔细分析上述不支持双重RAS阻断的研究,纳入人群大都存在着年龄较大且本身合并较多心血管危险因素等情况。例如,ALTITUDE研究预计纳入的是年龄>35岁的患者,结果最终入选的受试者平均年龄为65岁。所以,尚不能简单排除RAS双重阻断策略在特定人群的可行性。例如,有研究显示糖尿病肾病患者使用双重RAS阻断疗法后并不出现高钾,且入院率显著降低[14]。年龄和基础情况很可能是影响RAS阻断策略选择的重要因素。那么,在非老年(WHO标准:小于60岁)慢性肾脏病(CKD)1-3a期糖尿病肾病患者人群中,由于其相对年轻且合并心血管危险因素相对较少,早期启动双重RAS抑制的策略是否能有更好的收益/风险比值得探究。所以,本研究选择相对风险较低的非老年CKD1-3a期糖尿病肾病患者,回顾性地评估双重RAS阻断策略在这一人群中的疗效和安全性,以便为下一步的前瞻性随机对照研究提供更多的理论和临床证据支持。
1 资料与方法
1.1 一般资料
经陆军军医大学第一附属医院伦理委员会批准(批准号:KY201994),本研究回顾性筛选了2016年9月至2020年10月陆军军医大学第一附属医院CKD管理系统中经肾活检确诊的CKD1-3a期2型糖尿病肾病患者457例。非老年CKD1-3a期2型糖尿病肾病定义:(1)年龄<60岁;(2)满足2型糖尿病诊断标准[2014年美国糖尿病协会(ADA)糖尿病诊疗指南],伴有糖尿病视网膜病变,同时有肾损伤、蛋白尿,符合糖尿病肾病的临床诊断,并经肾穿刺活检病理证实;(3)患者还应满足估计的肾小球滤过率(eGFR)>45 mL·min-1·1.73 m-2[慢性肾脏病流行病学合作研究公式(CKD-EPI公式)],即CKD-3b期以前。排除标准:(1)合并用药可能影响结果评估者;(2)随访期间有活动性感染者;(3)合并其他非糖尿病性肾病、免疫性疾病、结缔组织疾病、淀粉样变及需要免疫抑制剂治疗者;(4)有任何更复杂的医疗问题,可能干扰研究行为或导致风险增加者,如恶性肿瘤、血液疾病、心脏疾病、肝脏疾病、艾滋病、病毒性肝炎等疾病患者。
经过筛选,45例曾经接受了双重RAS阻断治疗超过1年的非老年CKD1-3a期糖尿病肾病患者被纳入本研究。随后,根据年龄、性别、蛋白尿水平、eGFR、平均动脉压(MAP)等匹配评分,从CKD管理随访系统的历史患者中选择单独使用滴定至最大可耐受剂量ACEI或ARB的患者作为匹配对照(单药治疗组)。整个研究的选择重组过程见图1。所有患者都在CKD管理门诊随访,并记录了临床数据和不良反应。
1.2 方法
随访12个月。观察指标:本研究观察的主要指标是从基线开始的24 h蛋白尿变化情况,12个月内蛋白尿减少50%或更多被认为是治疗显效的标志;观察的次要指标包括eGFR、MAP。安全性指标包括低血压、高钾血症、AKI等不良反应发生情况。
1.3 统计学处理

2 结 果
2.1 基线特征
在CKD管理随访系统中筛得45例非老年CKD1-3a期糖尿病肾病患者接受了超过1年的双重RAS阻断治疗(双重RAS阻断组,包括氯沙坦钾+盐酸贝那普利15例,缬沙坦+培哚普利16例,厄贝沙坦+培哚普利10例,坎地沙坦+培哚普利4例)。随后,通过倾向性得分匹配选择45例年龄、性别、蛋白尿、eGFR匹配的历史对照(单药治疗组),见图1。两组基线临床特征均无明显差异(P>0.05),见表1。
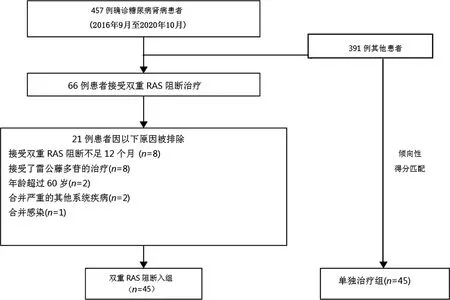
图1 研究纳入流程图
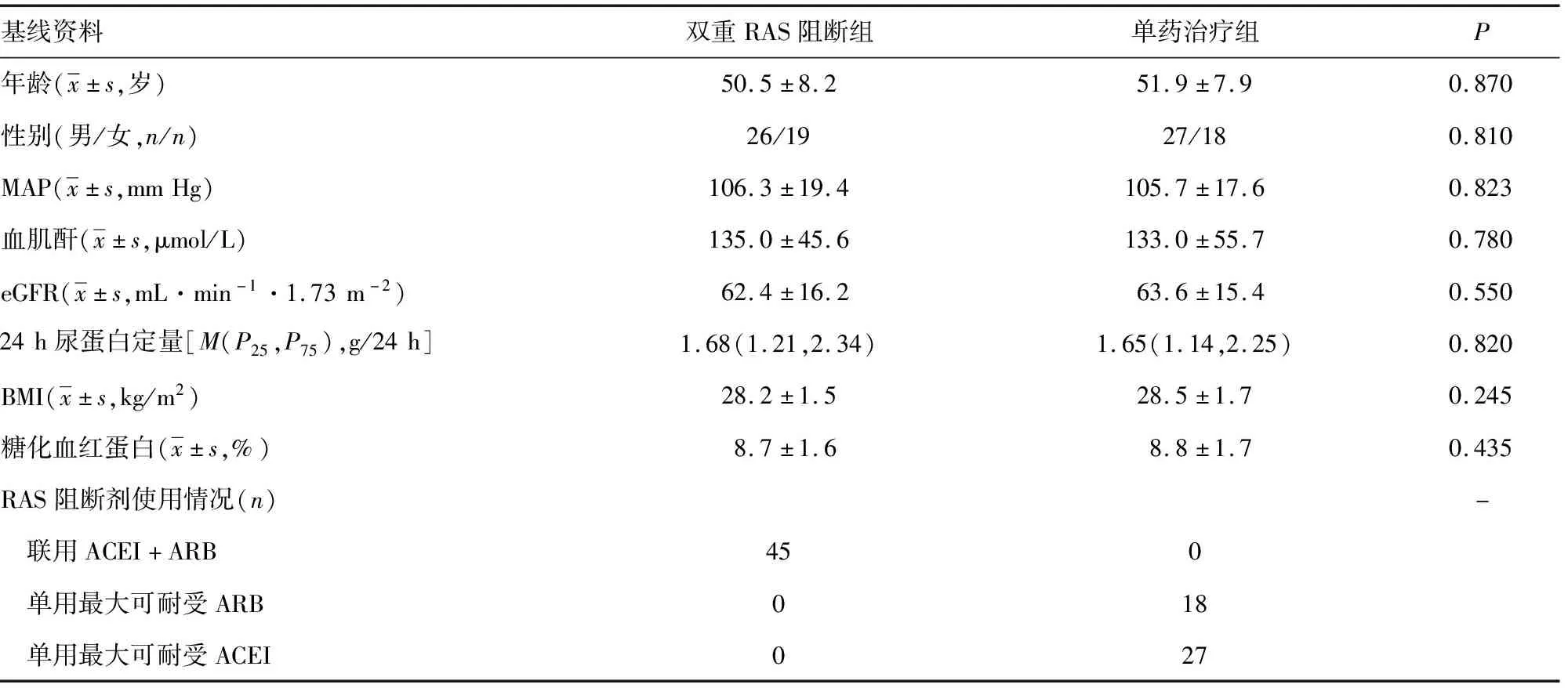
表1 两组患者的基线资料比较(n=45)
2.2 主要指标24 h尿蛋白定量的变化
与基线水平比较,两组患者治疗第3个月开始,24 h尿蛋白定量水平均逐渐下降,除单药治疗组第3个月,两组其余各时间点与基线水平比较,差异均有统计学意义(P<0.05);两组间在治疗第3个月24 h尿蛋白定量水平比较,差异无统计学意义(P=0.608);随访第6、12个月,双重RAS阻断组24 h尿蛋白定量水平均低于单药治疗组,差异有统计学意义(P<0.05),见表2。进一步分析24 h尿蛋白定量水平较基线水平下降50%及以上的患者,结果发现,随访第12个月时,双重RAS阻断组为35例(77.8%),单药治疗组为27例(60.0%),差异有统计学意义(P=0.032)。

表2 两组患者24 h尿蛋白定量变化情况[n=45,M(P25,P75),g/24 h]
2.3 次要指标eGFR的变化
与基线水平比较,两组患者治疗第3个月eGFR稍有下降,差异均无统计学意义(P>0.05);随访第6、12个月eGFR较第3个月稍升高,与基线水平比较,差异均无统计学意义(P>0.05);两组间各时间点eGFR比较,差异均无统计学意义(P>0.05),见表3。

表3 两组患者eGFR变化情况
2.4 次要指标MAP的变化
与基线水平比较,两组在治疗第3、6、12个月MAP均明显下降,差异有统计学意义(P<0.05);两组间各时间点MAP比较,差异均无统计学意义(P>0.05),见表4。
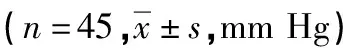
表4 两组患者MAP变化情况
2.5 影响因素分析
用单因素和多因素logistic回归分析确定有效蛋白尿减少率(≥50%)的独立影响因素。多因素分析结果发现,双重RAS阻断[OR=2.97,95%CI(1.99,3.88)]、MAP[OR=0.92,95%CI(0.88,0.96)]是有效蛋白尿减少率的独立影响因素,见表5。
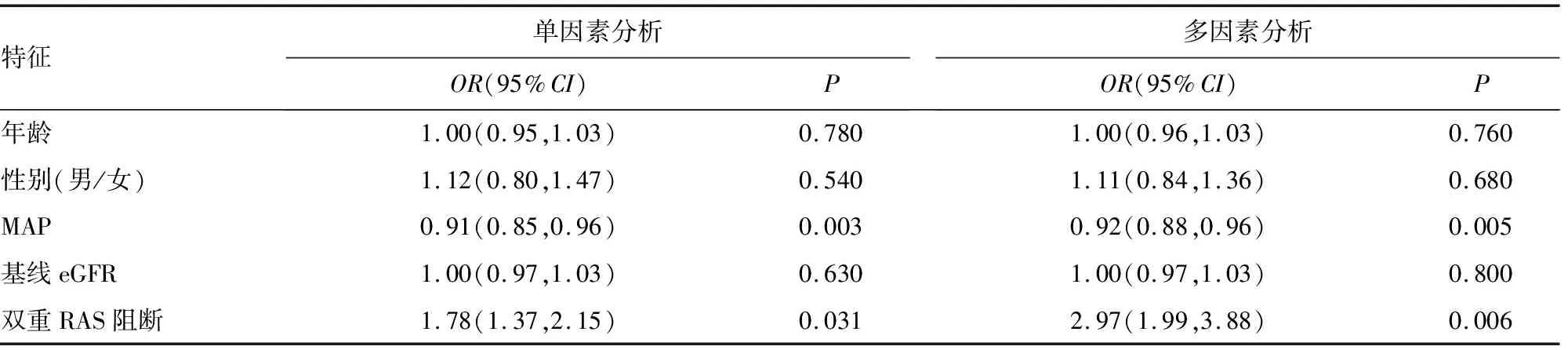
表5 单因素和多因素logistic回归分析影响有效蛋白尿减少率的因素
2.6 不良反应发生情况
双重RAS阻断组8例患者发生不良反应,单药治疗组7例发生不良反应,两组不良反应率比较,差异无统计学意义(17.8%vs.15.6%,P=0.777),且均未出现AKI或其他严重不良反应。两组出现的5例高钾血症(双重RAS阻断组3例,单药治疗组2例)均为轻度高钾,血钾未超过5.8 mmol/L,对症处理后正常且未再出现。双重RAS阻断组在用药1周后出现过1例一过性直立性低血压,表现为起立后头晕,未调整用药,后未再出现,故维持用药及随访。双重RAS阻断组出现2例干咳,单药治疗组中使用ACEI患者出现4例干咳,均为轻微,不影响生活,并出现逐渐耐受情况。双重RAS阻断组出现2例恶心,单用治疗组出现1例恶心。
3 讨 论
从药理机制上分析,ACEI和ARB联用可能取得协同效应,但临床研究结果争议却很大。作者总结了既往的研究数据,分析原因发现可能与既往临床研究纳入患者的人群特征有关。许多不支持双重RAS阻断的临床研究存在纳入人群年龄偏大,本身合并较多心血管危险因素的问题,可能导致不良反应发生率相对较高[15]。然而,对于年龄较小、心血管危险因素较少的人群则缺乏系统评价。所以,简单否定双重RAS阻断策略的价值,尤其是在危险因素较少的特定人群中的价值是值得商榷的。理论上,RAS阻断剂联用的多靶点治疗既能提高RAS的抑制效率,并在保留其各自特有的肾脏保护机制情况下减少剂量依赖的不良反应。RUGGENENTI等[16]在非糖尿病肾病患者的治疗中使用个体化双重RAS阻断疗法方案,发现其较单一RAS阻断疗法能更好地减轻蛋白尿和减缓肾病进程。有研究也证实,双重RAS阻断疗法在调理如IgA肾病的蛋白尿方面较单一RAS疗法更有效率[17-18]。但是,由于对可能出现的高钾和肾损伤等不良反应的担忧,许多临床医生不得不放弃双重RAS阻断策略[19]。然而,对临床顾虑较多的低血压问题,有研究显示低剂量的ACEI和ARB联合使用可获得有效的RAS阻断,而没有造成血压过度下降,并且不良反应极少[20]。也有meta分析结果显示,对RAS的双重阻断是防止糖尿病和肾脏疾病患者进展为ESRD的有效手段[21]。RUGGENENTI等[22]以“欢迎回来”为标题,明确提出了对于RAS的双重阻断策略的重新思考。而ESTERAS等[23]系统评价了联用RAS阻断剂出现高钾血症、低血压和肾损伤的风险,结果发现如果选择恰当的患者并进行严密监控,风险是可控的。来自德国疗养院系统的研究也提示,双重RAS阻断的不良反应风险有可能通过合理的患者教育、用药技巧和严密监控来避免[24]。一项关于双重RAS抑制治疗心力衰竭和肾功能不全的系统评价及meta分析发现,与单药治疗相比,双重RAS阻断降低了所有个体的死亡危险比、心血管死亡或心力衰竭住院率,也降低了ESRD患者的心血管死亡或心力衰竭住院率,以及高钾血症和低血压发生率[25]。但研究也强调在治疗过程中仍需要对特定不良事件进行监测[25]。
所以,虽然目前有研究质疑RAS双重阻断的安全性,但这并不能排除联合治疗策略在特定人群和特定疾病阶段的可行性。目前,我国糖尿病及糖尿病肾病的发病年龄有降低的趋势,双重RAS阻断策略在非老年患者中的效应目前尚无研究。因此,本研究回顾性地分析了在非老年CKD1-3a期糖尿病肾病患者中,双重RAS阻断治疗和单药治疗患者的蛋白尿变化和安全性指标。结果发现:77.8%的双重RAS阻断组患者12个月内24 h尿蛋白定量降低达50%及以上,明显高于单独治疗组的60.0%(P=0.032)。logistic回归分析也表明双重RAS阻断是有效降低蛋白尿的影响因子,证明在CKD早期开始使用双重RAS阻断的策略可能更有效地阻止糖尿病肾损伤的进展。而在12个月的观察期内,双重RAS阻断药物耐受性较好,无严重不良反应发生。这可能与本研究纳入的非老年CKD1-3a期糖尿病肾病患者相对较年轻,病程相对较短,合并心血管危险因素较少,对药物的耐受性较好有关。因此,在非老年CKD1-3a期糖尿病肾病人群中,尽早采用双重RAS阻断治疗策略能更有效地降低患者尿蛋白排泄,且其安全性并不低于单药物治疗组。但是本研究是一项回顾性分析,双重RAS阻断组和单药治疗组的治疗方案并没有标准化,且随访时间较短,未能评估其长期效应,但是至少能够说明双重RAS阻断的潜在获益。
最佳RAS阻断应被定义为能够达到最大阻断疗效的同时,患者不会引起高钾血症、低血压或肾衰竭等不良反应。因此,现在也许到了重新考虑RAS阻断剂联合治疗策略的时机,其可能是目前能够获得的最有效手段,可安全缓解慢性蛋白尿肾病的进展,并提供个体化的剂量和容忍度。如果因为一些可能通过技术手段避免的不良反应而导致这一方案被排除,无疑尤为可惜。本研究回顾性分析结果提示,如果能通过细致的剂量调整和合理的用药人群选择实现个体化治疗,双重RAS阻断策略可成为包括糖尿病肾病在内的患者心肾血管靶器官保护的有效工具。而且,近年来上市的新一代的RAS阻断剂具备更为出色的药理特点,如更好的组织渗透性,更好的调节血管紧张素转换酶2(ACE2)的能力,更优的谷峰比值(T/P比值)和半衰期,可能在很大程度上弥补早期上市药物的缺陷而降低不良反应的发生风险。所以,根据药理特点优选药物设计头对头的随机对照研究,重新评价双重RAS阻断策略在包括糖尿病肾病在内的CKD中的作用是非常有价值的工作。
