rhG-CSF不同给药途径对化疗后中性粒细胞减少症的疗效
2022-03-15张佳思赵永利徐双年王丽华
李 腾,张佳思,魏 玲,赵永利,孙 溦,徐双年,王丽华
(陆军军医大学第一附属医院:1.院办;2.血液科;3.护理教研室,重庆 400038)
化疗后中性粒细胞减少症(chemotherapy-induced neutropenia,CIN)是骨髓抑制性药物使用后最常见的不良反应之一[1]。严重或长时间的中性粒细胞减少可增加患者发生侵袭性感染的风险,甚至继发脓毒症休克或死亡[2]。研究证实,重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)可促进中性粒细胞的恢复,预防中性粒细胞减少性发热(febrile neutropenia,FN),减少抗生素的应用[2-3],还可以提高患者对化疗药物的耐受性[1],以保证化疗效果[4-6],从而改善患者的预后。根据国内rhG-CSF药品说明书和相关指南[7],rhG-CSF的给药途径包括皮下注射(subcutaneous,SC)和静脉注射(intravenous,IV),且两种给药方式在临床实践中均被广泛使用。虽已有研究比较了rhG-CSF两种给药途径对血液病患者CIN的疗效,但所得结论却不尽一致[5,8]。本研究回顾性收集了临床真实世界的数据,运用倾向性评分(propensity-score,PS)匹配和PS回归调整方法,评估rhG-CSF不同给药途径对非霍奇金淋巴瘤(non-Hodgikin′s lymphoma,NHL)患者CIN的疗效,以期为临床CIN患者的管理提供决策依据。
1 资料与方法
1.1 一般资料
经本院伦理审查委员会批准后,以2015年1月至2020年8月于本院血液科行化疗并在化疗结束后接受rhG-CSF治疗CIN的NHL患者308例为研究对象,并按给药途径分为SC组(n=108)与IV组(n=200)。纳入标准:(1)根据《造血与淋巴组织肿瘤WHO分类》[9-10]诊断为NHL;(2)根据肿瘤化疗导致的中性粒细胞减少相关指南和专家共识[2,7,11]诊断为CIN;(3)住院期间接受化疗,并且在该化疗疗程结束后开始使用rhG-CSF;(4)使用的rhG-CSF生产厂商为北京双鹭药业股份有限公司(商品名:立生素)或山东齐鲁药业(商品名:瑞白);(5)rhG-CSF给药剂量和频次为300 μg每天1次或150 μg每12小时1次,当患者中性粒细胞绝对值(absolute neutrophil count,ANC)恢复至或接近2.0×109/L时停药;(6)rhG-CSF给药途径为SC或IV。排除标准:(1)rhG-CSF给药后,因转科、出院或死亡无法观测结局指标者;(2)rhG-CSF间断给药者;(3)rhG-CSF SC与IV交替给药者;(4)rhG-CSF给药期间更换剂量或生产商者;(5)使用长效rhG-CSF者;(6)化疗方案中使用rhG-CSF者;(7)本次住院未接受化疗者;(8)预防性使用rhG-CSF者;(9)临床资料不完整者。
1.2 方法
1.2.1给药方法
在患者化疗疗程结束后且伴有中性粒细胞减少症时,给予rhG-CSF(北京双鹭药业股份有限公司/山东齐鲁药业,商品名:立生素/瑞白)SC或IV,300 μg每天1次或150 μg每12小时1次,连续给药直至患者ANC恢复至或接近2.0×109/L。
1.2.2患者资料收集
使用自制病例登记表采集患者资料,包括:(1)人口统计学特性(性别、年龄、身高、体重);(2)住院号及rhG-CSF给药起始日期;(3)入院时美国东部肿瘤协作组(ECOG)评分;(4)化疗阶段;(5)rhG-CSF给药时情况(有无发热及感染、ANC水平);(6)rhG-CSF注射液生产厂商和给药途径;(7)rhG-CSF用药后情况(ANC恢复至≥0.1×109/L和≥0.5×109/L所需时间、CIN是否恢复及恢复时间、FN持续时间、有无感染)。
1.2.3结局指标定义
(1)中性粒细胞恢复时间:指外周血ANC从给药当天(d0)到其下降经过谷值期后稳定恢复至大于或等于0.1×109/L和大于或等于0.5×109/L所需的时间。(2)CIN恢复速率:为时间事件类型数据,指在rhG-CSF用药期间,患者CIN是否恢复及恢复所需的时间。CIN指化疗后患者ANC<2.0×109/L[12]。(3)FN持续时间:rhG-CSF用药期间出现FN的时间。FN指腋温单次超过38.1 ℃或腋温超过37.8 ℃持续1 h以上[2,13-14],且伴随ANC<0.5×109/L或预计2 d内会降至0.5×109/L及以下[13]。(4)感染发生率:包括微生物学记录的感染和有临床记录但没有微生物证据的感染[14]。所有结局指标观察时间段均为rhG-CSF用药期间。rhG-CSF给药后隔天或每周3次抽血检验血常规,观察ANC的变化。每天护理常规监测体温变化。
1.2.4数据处理
采用PS匹配和PS回归调整以减少选择性偏倚或混杂偏倚。具体步骤:(1)以年龄、性别、ECOG评分、体重指数(BMI)、化疗阶段、rhG-CSF生产商、rhG-CSF给药前有无感染及发热、rhG-CSF给药前ANC水平为自变量,以rhG-CSF给药途径(1=SC,0=IV)为应变量,建立logistic 回归模型,计算每个个体的PS值,并绘制PS组间分布图。(2)设定卡钳值,按照PS值标准差的20%计算[15],约为0.02。(3)PS匹配,分别采用最邻近匹配法、最优匹配法和全匹配法进行组间1∶1或1∶2匹配。(4)平衡性检查,采用标准化平均差(standardized mean difference,SMD),其绝对值小于10%,提示匹配效果良好[15-16]。(5)效应估计:采用广义线性模型对PS匹配后的样本进行组间效应量的估计和假设检验[15]。为进一步校正重要协变量的影响,来自PS模型的协变量均被纳入每个结果模型中[16]。另外,采用PS回归调整,即以各结局变量为应变量,将PS值和rhG-CSF给药途径带入回归模型进行校正,从而估计组间差异[15-16]。
1.3 统计学处理
数据分析和作图采用SPSS25.0(IBM SPSS Statistics 25.0)、R3.6.3(http://www.R-project.org)和GraphPad Prism6。计量资料不符合正态分布,用中位数及四分位数[M(P25,P75)]表示,计数资料采用例数或百分比表示。组间比较(0=IV,1=SC)使用广义线性模型,以获得连续性结局变量的差异估计和二分类结局变量的优势比估计;两组间中性粒细胞恢复速率的差异估计采用Cox比例风险回归模型,采用似然比检验方法进行检验,并对PS匹配后的样本绘制Kaplan-Meier曲线。所有统计检验均为双侧,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料比较
PS匹配前两组总体基线资料见表1。与IV组相比,SC组男性、ECOG评分≤2分、使用rhG-CSF商品名为立生素的患者百分比更高,基线资料组间均衡性较差(SMD绝对值均大于0.1)。PS分布图显示,两组间PS值有较大的重叠范围,共同支撑域良好,适合采用PS法,见图1。通过对多种PS匹配方法的匹配效果进行检验,筛选出组间基线均衡(匹配后所有协变量的SMD绝对值均小于0.1)的1∶2最邻近匹配法(匹配后样本:SC组77例,IV组106例)和全匹配法(匹配后样本:SC组108例,IV组200例),见图2。

A:1∶2最邻近匹配法;B:完全匹配法。

表1 两组患者基线特征比较

图1 组间PS值分布图
2.2 两组患者ANC恢复至≥0.1×109/L所需时间比较
与IV组相比,SC组ANC恢复至≥0.1×109/L所需时间在1∶2最邻近匹配法中提示缩短1.25 d(P=0.011),在完全匹配法中提示SC组缩短0.87 d(P=0.026),在PS回归调整法中提示SC组缩短1.14 d(P=0.006),见表2。
2.3 两组患者ANC恢复至≥0.5×109/L所需时间比较
与IV组相比,SC组ANC恢复至≥0.5×109/L所需时间在1∶2最邻近匹配法中提示缩短1.14 d(P=0.002),在完全匹配法中提示SC组缩短0.79 d(P=0.006),在PS回归调整法中提示SC组缩短0.94 d(P=0.003),见表2。
2.4 两组患者CIN恢复速率比较
通过1∶2最邻近匹配法发现,SC组CIN中位恢复时间为6 d,IV组为7 d,Kaplan-Meier恢复速率曲线见图3A,SC组CIN更快恢复的可能性是IV组的1.59倍(P=0.005);完全匹配法提示CIN中位恢复时间SC组为6 d,IV组为7 d,Kaplan-Meier恢复速率曲线见图3B,SC组更快恢复的可能性是IV组的1.51倍(P=0.002);PS回归调整法提示CIN中位恢复时间SC组为6 d,IV组为7 d,SC组更快恢复的可能性是IV组的1.58倍(P<0.001),见表2。

A:1∶2最邻近匹配法;B:完全匹配法。
2.5 两组患者感染发生率比较
通过1∶2最邻近匹配法发现,相比IV组,SC组感染发生的风险更低(OR=0.42,P=0.049),完全匹配法(OR=0.49,P=0.044)和PS回归调整法(OR=0.52,P=0.030)估计的相应结果也类似,见表2。
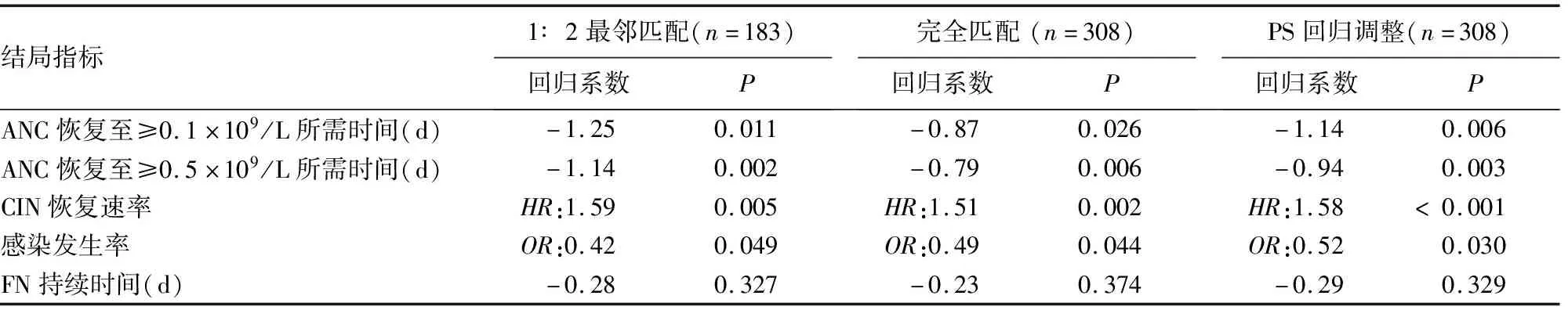
表2 PS匹配和PS回归调整后两组结局指标比较(参照组:IV组)
2.6 两组患者FN持续时间比较
通过1∶2最邻近匹配法发现,与IV组相比,SC组FN持续时间缩短0.28 d(P=0.327),完全匹配法提示SC组缩短0.23 d(P=0.374),PS回归调整法提示SC组缩短0.29 d(P=0.329),差异均无统计学意义,见表2。
3 讨 论
本研究为一项回顾性研究,所有用药均遵循rhG-CSF药品说明书和CIN相关指南。研究聚焦于NHL这一患者群体,采用了3种PS分析方法,研究结果均一致表明,与IV相比,SC rhG-CSF明显缩短了中性粒细胞恢复至≥0.1×109/L和≥0.5×109/L所需时间;SC组较IV组CIN恢复的可能性更高,且感染发生率更低;但在缩短FN持续时间方面,两组间无明显差异。分析其可能机制,在IV给药过程中,rhG-CSF受体早期便达到饱和,未被结合的rhG-CSF被肾脏或受体介导的清除机制消除;在SC给药过程中,缓慢释放机制可能会使rhG-CSF发挥更持久的作用[5,17]。
有研究表明,在接受强化化疗的肺癌晚期患者中,治疗CIN产生同等效果SC rhG-CSF所需剂量仅为IV所需剂量的50%[18]。另一项关于IV与SC rhG-CSF治疗住院血液肿瘤患者CIN的随机对照试验表明,与IV组相比,rhG-CSF SC组中性粒细胞减少症持续时间更短(P<0.001),建议首选皮下给药,以最大化发挥该药物的疗效[5]。一篇关于最佳给药途径的综述中也提到,rhG-CSF SC优于IV[19]。美国临床肿瘤学会在2015年更新的临床实践指南中也同样建议,将SC作为rhG-CSF的首选给药途径[4]。虽然国内2017版CIN规范化管理指南建议rhG-CSF的给药方式为SC或IV[7],但作者发现在2019版的CIN专家共识[2]中,其仅给出了SC作为rhG-CSF的给药途径。在NCCN肿瘤学临床实践指南2021年第2版[20]关于CIN管理的章节中,也仅给出SC作为rhG-CSF的给药方式。以上文献均有力地支撑了本研究结果。
及时有效地改善中性粒细胞减少症的严重程度和持续时间,可使患者按时完成足剂量化疗或剂量密集化疗[4,6,21-22]。SC rhG-CSF不但节约了药物本身的治疗成本,还可能节约患者住院和后续治疗、CIN相关并发症的治疗费用[7,23-24]。因此,当考虑有效性、药物经济成本和潜在治疗成本作为注射途径选择的原则时,在NHL患者中,rhG-CSF SC可能是最佳选择。
本研究尚存在一些不足之处。首先,由于PS方法只控制了可观测变量的影响,对于一些不可测量的混杂因素,仍然可能存在隐形偏差。其次,本研究排除了部分因出院或死亡未能观察到中性粒细胞恢复情况的患者,而非将这部分病例作为删失数据纳入本研究。此外,由于血液肿瘤是一类异质性较大的恶性疾病[25],粒细胞集落刺激因子及其受体在不同种类血液肿瘤中有不同程度的表达异常[26],作者推测rhG-CSF的最佳给药途径可能因疾病诊断而有所差异。因此,对于其他类型肿瘤的CIN,rhG-CSF SC与IV效果的比较还有待深入研究。
综上所述,本研究发现在NHL患者中,rhG-CSF SC较IV可明显降低CIN的严重程度并缩短其持续时间,降低感染发生率,而且未明显影响FN的持续时间。
