miR-27a-3p介导类风湿关节炎滑膜成纤维细胞增殖和侵袭的分子机制研究*
2022-03-15李宁宁郝冬林戴冰冰
李宁宁,雷 蕾,郝冬林,刘 喆,戴冰冰△
(1.大连市中心医院风湿免疫科,辽宁大连 116083;2.苏州市中医医院风湿免疫科,江苏苏州 215008;3.驻马店市中心医院风湿免疫科,河南驻马店 463000)
类风湿关节炎(rheumatoid arthritis,RA)是一种最常见的炎症性疾病,全球范围内发病率约为1%。其主要表现为炎症、滑膜炎、关节软骨及骨损伤,且治疗效果欠佳,40%~70%的患者最终会发展为残疾[1]。病程较长的患者除累及关节外,还可出现间质性肺疾病、心血管疾病等多种关节以外表现[2]。目前,对于RA的治疗已有针对炎症和免疫信号通路的免疫疗法,虽然这些治疗是有效的,但大部分RA患者在脱离药物后出现病情反复或加重[3]。滑膜炎症是由固有免疫和适应性免疫细胞浸润滑膜组织引起的免疫相关疾病,活化的滑膜成纤维细胞(resident synovial fibroblasts,SFs)是RA的主要病理改变[4]。SFs的主要功能是提供滑膜组织结构支持,分泌滑膜液润滑关节,减少摩擦运动,滋养无血管的软骨[5]。而在RA的滑膜中,SFs被活化,表现出细胞凋亡减少、迁移和侵袭增强的特征,成为侵袭性血管膜的主要效应细胞,参与RA的炎症过程[6]。活化态的SFs表现出具有肿瘤细胞样的侵袭性表型,并通过产生白细胞介素(IL)-1β、肿瘤坏死因子α(TNF-α)、IL-6等促炎细胞因子,以及基质金属蛋白酶和血管生成因子在RA的发展中发挥主要作用[7]。
微RNA(microRNAs,miRs)是一种短链的非编码RNA,长度约为22个核苷酸,作为转录后调节因子,在多种细胞功能中发挥关键作用。miRs主要通过与信使RNA(mRNA)的3′非翻译区(3′-untranslation region,3′UTR)或5′非翻译区(5′-untranslation region,5′UTR)结合,特异性地抑制mRNA的翻译或诱导mRNA的降解,以此来沉默靶基因的表达[8]。本研究中发现,类风湿关节炎滑膜成纤维细胞(rheumatoid arthritis synovial fibroblasts,RASFs)中miR-27a-3p可以通过靶向分泌型卷曲相关蛋白1(secreted frizzled-related protein 1,SFRP1)参与RA的病理生理过程,现报道如下。
1 材料与方法
1.1 标本来源
本研究经大连市中心医院和驻马店市中心医院伦理委员会批准,符合《赫尔辛基宣言》,所有参与者均签署书面知情同意书。选取2017—2019年于大连市中心医院和驻马店市中心医院行关节手术的RA患者20例获取滑膜组织标本,男11例,女9例,年龄34~69岁,平均(52±17)岁。所有RA患者均符合美国风湿病学会疾病分类标准[9]。另选取同期于大连市中心医院和驻马店市中心医院行关节置换手术的关节外伤患者10例,获取对照组标本,男5例,女5例,年龄28~67岁,平均(45±13)岁。所有对照组患者无自身免疫病、传染病、恶性肿瘤等其他基础疾病。
1.2 方法
1.2.1细胞培养及转染
获取新鲜滑膜组织,2 h内无菌条件下剪碎,胰蛋白酶2.5 g/L消化2 h,1 000 r/min离心10 min,获得目的细胞。DMEM培养基(美国Invitrogen公司)加10%胎牛血清(美国Gibco公司)、青霉素和链霉素(P/S,美国Gibco公司),于37 ℃、5% CO2条件下培养细胞,细胞生长约80%时传代,选取传代3~8代的RASFs进行试验。以Lipofectamine 2000为载体将miR-27a-3p类似物(mimic组)、抑制剂(inhibitor组)转染入细胞(mimic、inhibitor购自上海吉凯基因化学技术公司),以未处理组为空白对照(NC组),脂质体组为阴性对照(Liposome组)。
1.2.2实时荧光定量PCR(RT-PCR)
从细胞中分离得到总RNA。使用Super RT cDNA合成试剂盒(日本TAKARA公司)将RNA模板逆转录为cDNA。采用特异性引物对miRNA进行RT-PCR检测。选择U6作为管家基因。7500 Fast RT-PCR系统(美国Applied Biosystems公司)进行扩增,采用2-ΔΔCt法计算相对表达水平,重复3次。miR-27a-3p的上游引物序列为5′-ATG GTT CGT GGG TTC ACA-3′,下游引物序列为5′-GTG GCT AAG TTC CGA CG-3′;SFRP1的上游引物序列为5′-GGT CTT AGT TCT GGT TGA TTC-3′,下游引物序列为5′-CTG CTC TTC CGT ATT CTG T-3′;U6的上游引物序列为5′-TTA TGG GTC CTA GCC TGA C-3′,下游引物序列为5′-CAC TAT TGC GGG CTG C-3′。
1.2.3Western blot
提取总蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE,上海碧云天生物技术有限公司)。随后,转移到硝基纤维素膜(美国Millipore公司)。室温下用5%脱脂牛奶封闭膜1 h,然后与SFRP1(1∶2 000,美国Proteintech公司)和β-actin(1∶5 000,美国Proteintech公司)一抗孵育过夜。膜洗涤3次,二抗(1∶5 000,美国Proteintech公司)室温孵育1 h,显影成像,ImageJ分条带灰度值。
1.2.4靶基因预测
基于PITA(genie.weizmann.ac.il/),miRmap(mirmap.ezlab.org/),microT(microrna.gr/microT),miRanda(microrna.org/microrna/home.do),PicTar(pictar.org/),TargetScan(http://www.targetscan.org/)数据库预测miR-27a-3p靶基因。
1.2.5荧光素酶报告试验
设计并合成含有miR-27a-3p结合位点的SFRP1 3′UTR正常片段(WT)及其突变体(MUT),置于pMIR-REPORT载体的报告基因下游区域,获得相应的重组质粒。使用Lipofectamine 2000将miR-27a-3p mimics与重组质粒共转染,48 h后使用双荧光素酶报告基因试剂盒检测萤光素酶相对活性。
1.2.6Transwell
采用Transwell检测细胞侵袭能力。Transwell上室预先涂基质胶(美国BD Biosciences公司),上、下小室分别加入100 μL无血清培养基和600 μL含10%胎牛血清的培养基。细胞接种于上室,在37 ℃孵育24 h。用棉签从小室的上表面去除未迁移的细胞。迁移的细胞用0.1%的结晶紫染色,IX81数字显微镜(日本Olympus公司)计数。
1.2.7细胞增殖检测试验
依据细胞计数试剂盒8(CCK-8)系统(日本Dojindo公司)测定细胞活力。细胞接种在96孔板中(每孔1×104个细胞)。细胞于37 ℃黑暗孵育,于0、24、48、72 h分别加入10 μL CCK-8溶液,再孵育1 h。然后使用酶标仪(瑞士Tecan公司)在450 nm处测定每个孔的吸光度(A450)值。
1.3 统计学处理

2 结 果
2.1 miR-27a-3p在RASFs细胞中过表达
在获取RASFs和SFs后,首先通过RT-PCR检测miR-27a-3p在两种细胞中的表达。与SFs中的表达水平(1.00±0.21)比较,miR-27a-3p在RASFs中表达水平(3.24±0.45,P<0.05)升高,见图1A。随后通过Lipofectamine 2000将miR-27a-3p抑制剂转染入RASFs,共分3组:未处理的RASFs(NC组),空脂质体转入细胞(Liposome组),脂质体携带miR-27a-3p抑制剂转入细胞(inhibitor组)。同NC组比较,Liposome组中miR-27a-3p表达水平无明显变化(0.05),而inhibitor组miR-27a-3p表达水平明显下降(P<0.05),见图1B。

A:miR-27a-3p在RASFs中过表达;B:miR-27a-3p抑制剂抑制miR-27a-3p表达;a:P<0.05。
2.2 miR-27a-3p抑制SFRP1表达
通过PITA,miRmap,microT,miRanda,PicTar,TargetScan数据库对miR-27a-3p可能结合的靶基因进行预测。预测结果显示,分泌型卷曲相关蛋白(SFRPs)家族成员SFRP1可能是miR-27a-3p的潜在靶基因,见图2A。双荧光素酶报告试验显示,与SFRP1-3′UTR-WT NC组相比,miR-27a-3p mimics与SFRP1-3′UTR-WT共转染使荧光素酶活性明显降低(P<0.05),见图2B;而miR-27a-3p mimics与SFRP1-3′UTR-MUT共转染后荧光素酶的活性无明显变化(P>0.05),见图2B。Western blot显示,SFRP1在RASFs中表达低于其在SFs中表达(P<0.05),见图2C。抑制RASFs中miR-27a-3p表达后,SFRP1的表达水平明显升高(P<0.05),见图2D。SFRP1的siRNA能够抑制SFRP1的表达(P<0.05),见图3。

A:miR-27a-3p与SFRP1的靶向关系;B:双荧光素酶报告基因试验证实靶向关系;C:Western blot检测SFRP1蛋白表达;D:抑制RASFs中miR-27a-3p表达后SFRP1表达增加;a:P<0.05。
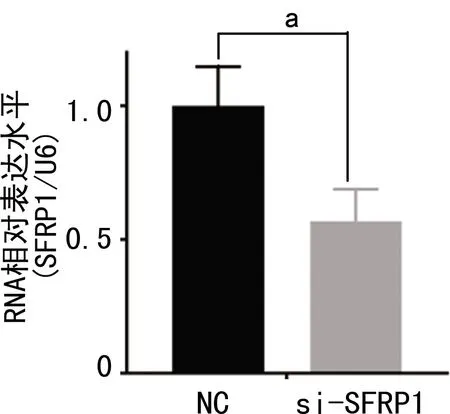
a:P<0.05。
2.3 miR-27a-3p和SFRP1影响RASFs侵袭
Transwell试验中,将miR-27a-3p抑制剂转染RASFs后,穿膜细胞数量从(179±14)个减少到(124±8)个;而在此基础上同时转染si-SFRP1,穿膜细胞数量增加到(155±11)个(P<0.05),见图4。
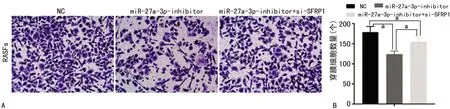
A:细胞侵袭检测图(Transwell,×100);B:转染后穿膜细胞柱状图;a:P<0.05。
2.4 miR-27a-3p和SFRP1影响RASFs增殖
采用CCK-8细胞增殖检测试验评估miR-27a-3p和SFRP1对细胞增殖的影响。在RASFs中抑制miR-27a-3p的表达后,细胞增殖减少,而同时抑制SFRP1后细胞增殖增加(P<0.05),见图5。

a:P<0.05。
3 讨 论
RA是一种慢性炎症性自身免疫性疾病,可导致关节滑膜组织的慢性炎症,进而发展为不可逆的关节破坏,包括滑膜增生、关节肿胀、疼痛、关节炎症和侵袭,以及软骨和滑膜损伤等[10]。与恶性肿瘤细胞类似,RASFs具有内在的能力来抵抗微环境中氧自由基和其他有毒代谢物的攻击[11]。因此,RASFs生物学功能及表型的改变,可促进滑膜血管膜的形成并侵犯邻近的软骨和骨组织,这是RA形成的关键。现有的RA治疗药物可能不直接针对紊乱的RASFs细胞表型,导致对该类患者的治疗有效性不足。RASFs的具体激活机制尚不清楚,但近期研究发现Wnt/catenin通路可能参与了RASFs的激活和RA的发生[12]。
SFRPs是Wnt抑制剂,能够在细胞外与Wnts结合[13]。有报道显示,SFRP1与炎性反应相关,并在RASFs中表达下降[14]。此外,启动子超甲基化引起的SFRP1下调可以激活Wnt/catenin信号通路,降低DNA甲基转移酶1(DNMT1)表达,参与诱导瘢痕疙瘩发育[15]。既往研究报道,miRs可调节免疫反应,参与免疫细胞的增殖、分化,以及某些组织损伤过程[16]。如miR-146a可能是治疗RA的新靶点[17],miR-125b是评估类风湿性关节炎对利妥昔单抗治疗反应的潜在生物标志物[18]。
本研究发现,miR-27a-3p在RASFs中过表达,miR-27a-3p可以靶向作用于SFRP1的3′UTR,抑制SFRP1的表达。在RASFs中抑制miR-27a-3p的表达后,细胞的增殖和侵袭能力减弱,而在此基础上同时抑制SFRP1的表达,细胞的增殖和侵袭能力恢复,提示miR-27a-3p促RA发生、发展的作用是通过抑制SFRP1表达实现的。在一项阿达木单抗联合氨甲蝶呤治疗RA的临床试验中发现,治疗前后血液中miR-27a-3p的表达变化同RA的缓解密切相关[19]。此外,在乳腺癌中过表达的miR-27a-3p参与肿瘤对阿霉素的化疗耐药[20],过表达的miR-27a-3p参与糖尿病肾病肾纤维化[21]等。
综上所述,miR-27a-3p在RASFs中过表达,促进RASFs的侵袭和增殖,而该功能可能是miR-27a-3p通过抑制SFRP1的表达而实现的。但miR-27a-3p/SFRP1轴的上、下游调控关系仍需在后续研究中进一步探讨,该系列研究的顺利实施,有望成为RA靶向治疗的有效靶点。
