吉西他滨联合PD-1单抗对肺癌小鼠肿瘤体内增殖能力的影响*
2022-03-15杨雅萌罗丹凤
杨雅萌,罗丹凤
(1.泉州医学高等专科学校临床医学学院,福建泉州 362011;2.中国人民解放军联勤保障部队第九一〇医院肿瘤内科,福建泉州 362008)
肺癌是全球最常见的恶性肿瘤之一,有较高的患病率和病死率,严重威胁人类生命健康。根据国家癌症中心2017年公布的最新数据显示,我国肺癌发病率和病死率均位居癌症第一位[1]。2018年美国统计数据显示,肺癌新发病例数在男、女性中均位居第二位,在恶性肿瘤病死率中位居第一位[2-3]。由此可见,肺癌是全球范围内对人类健康威胁最大的肿瘤。由于在早期没有明显的临床症状和体征,大多数患者确诊时已经处于晚期。晚期肺癌传统的治疗手段主要包括化疗与靶向治疗,但疗效非常有限。近年来,免疫治疗在肿瘤治疗中的价值引起了大量的关注,尤其是免疫检查点抑制剂更是在临床多肿瘤中得到应用,其中抗程序性死亡受体-1(programmed death 1,PD-1)抗体是研究和应用最为广泛的免疫检查点抑制剂[4-5]。PD-1是一种共刺激分子,属于B7-CD28超家族成员,通常表达于活化的淋巴细胞和单核细胞[6]。PD-1有两个配体,PD-L1和PD-L2均表达于抗原呈递细胞上。PD-1与PD-L1或 PD-L2结合可通过多种机制削弱T淋巴细胞反应,肿瘤细胞能够利用这一特点逃避T淋巴细胞介导的杀伤作用[7]。近年来研究发现,肺癌具有很强的异质性,携带大量编码新抗原的肿瘤突变负荷[8]。然而,由于肿瘤免疫逃逸的存在,机体的免疫系统却无法将这些肿瘤清除。免疫检查点抑制剂抗PD-1/PD-L1抗体的出现为该病的治愈带来了希望。虽然抗PD-1抗体治疗比化疗使患者具有更高的客观缓解率和更长的生存时间,让部分患者达到持久缓解,但接受单一的抗PD-1抗体治疗的肺癌患者中仅有少数有效,大部分仍然不能从治疗中获益,还有一部分初始有效后肿瘤还是再次出现。吉西他滨(GEM)为一种新的胞嘧啶核苷衍生物,在临床上应用非常广泛,是常用的治疗非小细胞肺癌的化疗药物[9-10]。本研究用GEM联合抗PD-1抗体对肿瘤小鼠模型进行干预治疗,观察其对肿瘤的作用机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物及细胞株
本实验所用小鼠均为C57BL/6纯系雌性小鼠,共40只,8~10周龄,体重18~21 g,所有小鼠均购自北京维通利华实验动物有限公司[动物许可证号SCXK(京)2016-0002],小鼠饲养在无特殊病原体(SPF)环境中。本实验符合一般动物实验伦理学原则。本实验所用Lewis肺癌细胞系(LCC)购自中国科学院上海细胞生物研究所,与C57BL/6纯系雌性小鼠具有相同的遗传背景。
1.1.2仪器与试剂
胎牛血清(货号:16000-044)、DMEM培养基(货号:C11995500BT)和胰酶溶液(货号:25200-072),均购自美国Gibco公司;磷酸盐缓冲液(PBS,货号:BF-0011,北京鼎国昌盛生物技术有限公司);PD-1抗体(货号:BE0146,美国BioXcell公司);CD33 PE-Cy7荧光单克隆抗体试剂、CytoFLEX型流式细胞仪(美国BD Biosciences公司);310直热式5% CO2培养箱(美国Thermo公司);Lecia DMI1型倒置显微镜(德国Leica公司)。
1.2 方法
1.2.1细胞培养
取复苏后适量的LCC接种于100 mL的培养皿中,放入10 mL含10%胎牛血清、100 U/mL青霉素和链霉素的DMEM高糖培养基中,置于37 ℃、5% CO2孵育箱中培养。细胞贴壁并覆盖90%皿底时弃去培养基,3 mL胰酶溶液消化3 min,5 mL培养基终止消化,进行细胞传代。待细胞状态较好并处于对数生长期时,胰酶消化收集细胞,使用PBS调整细胞浓度为5×106/mL,置于冰上保存备用。
1.2.2Lewis动物模型建立及分组
取处于对数期的LCC,调整细胞浓度至1×106/mL,用计数板对细胞悬浮液进行计数,接种细胞悬液于小鼠的右大腿上,每只小鼠0.1 mL,并且保证细胞悬液没有渗出,才能确保每只小鼠均有肿瘤形成。10 d后所有小鼠体内均有肿瘤形成,当肿瘤在体内增长至100~200 mm3,用游标尺测量小鼠肿瘤的体积。采用随机数字法把40只小鼠分为空白对照组(NC组)、GEM组、PD-1抗体组(PD-1组)和GEM联合PD-1抗体组(联合组),每组10只。NC组小鼠腹腔注射200 μL/kg的PBS溶液干预,GEM组小鼠腹腔注射50 mg/kg GEM溶液干预治疗[11],PD-1组小鼠腹腔注射PD-1抗体100 μg/kg,联合组小鼠腹腔注射50 mg/kg GEM溶液和100 μg/kg PD-1抗体干预治疗[12],每周2次,共4次。
1.2.3肿瘤生长体积的测定
造模后第2天,用游标尺测量小鼠皮下肿瘤的最大长经和短经,每2天1次,同时计算小鼠体内的肿瘤体积均数,绘制肿瘤的生长曲线。
1.2.4肿瘤生长抑制率测定
实验14 d后,处死所有小鼠取出肿瘤,测量肿瘤体积,计算肿瘤生长抑制率。抑制率=(对照组平均瘤体积-治疗组平均瘤体积)/对照组平均瘤体积×100%。
1.2.5肿瘤微血管密度(MVD)
干预治疗后,处死小鼠并取出皮下肿瘤,将新鲜的肿瘤组织用多聚甲醛进行固定。固定好的组织经脱水、透明、石蜡包埋后,将组织用切片机制成4 μm石蜡切片,将切片放在显微镜下观察,每张切片取6个高倍视野,计数切片中的微血管数,并计算其平均值。
1.2.6TUNEL检测肿瘤细胞凋亡
处死小鼠后,取出小鼠肿瘤组织并固定于4%多聚甲醛溶液中,24 h后采用乙醇进行梯度脱水,二甲苯透明、石蜡包埋,采用石蜡切片机切制成5 μm左右的冠状切面。操作步骤严格按照试剂盒说明书进行,细胞核中有棕黄色颗粒为凋亡细胞,在普通光学显微镜下,随机选取3个视野计数TUNEL染色后细胞的总数量,即为凋亡的细胞数量。
1.2.7免疫组织化学法检测血管内皮生长因子(VEGF)的表达
处死小鼠后,将肿瘤组织取出,用多聚甲醛固定后经石蜡包埋,用免疫组织化学法对组织中的VEGF表达进行检测,以上操作均按照试剂盒说明书进行。最后结果以VEGF阳性所占百分比为标准,随机取5个VEGF分布密集的区域,在高倍显微镜下对其进行计数,阳性VEGF表达为棕黄色或褐色,阴性VEGF表达为淡黄色或无色。
1.3 统计学处理

2 结 果
2.1 各组小鼠一般情况比较
NC组和PD-1组一般情况可见,小鼠饮食、大便均显示正常,未见小鼠消瘦,但可见皮下脂肪减少;GEM组和联合组小鼠均出现一过性消瘦,皮下脂肪也明显减少,实验期间无小鼠死亡。
2.2 各组小鼠肿瘤生长体积比较
NC组、PD-1组、GEM组和联合组小鼠肿瘤质量和肿瘤体积相比较,差异均有统计学意义(F质量=70.72、F体积=163.4,P<0.001);且PD-1组、GEM组和联合组小鼠肿瘤生长均受到不同程度的抑制(P<0.05),见表1、图1。与NC组相比,PD-1组、GEM组和联合组小鼠肿瘤质量和体积均明显降低(P<0.05);且联合组小鼠肿瘤质量和体积均明显小于PD-1组和GEM组(P<0.05),PD-1组和GEM组小鼠肿瘤质量和体积无明显差异(P>0.05),见表1。
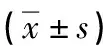
表1 各组小鼠肿瘤质量和肿瘤体积比较

a:P<0.05,与NC组比较;b:与PD-1组、GEM组比较。
2.3 各组小鼠肿瘤生长抑制率比较
NC组、PD-1组、GEM组及联合组小鼠肿瘤生长抑制率分别为0、(38.1±1.51)%、(32.9±4.11)%、(58.5±3.21)%,差异有统计学意义(F=813.5,P<0.05);与NC组相比,PD-1组、GEM组和联合组小鼠肿瘤生长抑制率明显增加(P<0.05);联合组小鼠肿瘤生长抑制率明显高于PD-1组和GEM组(P<0.05),见图2。
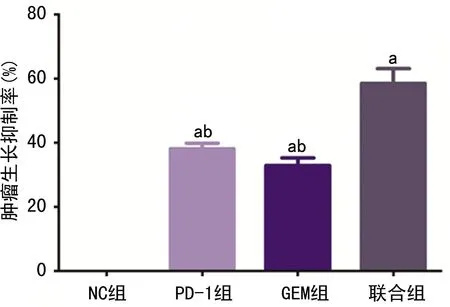
a:P<0.05,与NC组比较;b:P<0.05,与联合组比较。
2.4 各组小鼠肿瘤MVD比较
NC组、PD-1组、GEM组及联合组小鼠肿瘤MVD分别为(59.74±5.34)、(45.90±4.51)、(41.88±4.32)、(7.43±1.20)个/mm2,差异有统计学意义(F=286.3,P<0.001);与NC组相比,PD-1组、GEM组和联合组小鼠肿瘤MVD明显降低(P<0.05);联合组小鼠肿瘤MVD明显低于PD-1组和GEM组(P<0.05),且PD-1组和GEM组小鼠肿瘤MVD无明显差异(P>0.05),见图3。

a:P<0.05,与NC组比较;b:P<0.05,与联合组比较。
2.5 各组小鼠肿瘤细胞凋亡率比较
NC组、PD-1组、GEM组及联合组小鼠肿瘤细胞凋亡率分别为(4.21±1.42)%、(17.35±6.41)%、(17.98±6.23)%、(63.15±9.56)%,差异有统计学意义(F=153.4,P<0.001);与NC组相比,PD-1组、GEM组和联合组小鼠肿瘤细胞凋亡率均不同程度增加(P<0.05);联合组小鼠肿瘤细胞凋亡率比PD-1组和GEM组明显增加(P<0.05),PD-1组和GEM组小鼠肿瘤细胞凋亡率无明显差异(P>0.05),见图4、5。

图4 TUNEL检测肿瘤细胞凋亡率(×200)

a:P<0.05,与NC组比较;b:P<0.05,与联合组比较。
2.6 各组小鼠VEGF表达比较
NC组、PD-1组、GEM组及联合组小鼠肿瘤组织中VEGF阳性表达率分别为(90.21±6.42)%、(82.54±6.31)%、(80.98±6.78)%、(29.76±7.65)%,差异有统计学意义(F=171.0,P<0.001);与NC组相比,PD-1组、GEM组和联合组小鼠肿瘤组织中VEGF阳性表达率均不同程度降低(P<0.05);PD-1组和GEM组小鼠肿瘤组织中VEGF阳性表达率无明显差异(P>0.05);与PD-1组、GEM组比较,联合组小鼠肿瘤组织中VEGF阳性表达率明显降低(P<0.05),见图6、7。

图6 各组免疫组织化学VEGF阳性表达(×400)

a:P<0.05,与NC组比较;b:P<0.05,与联合组比较。
3 讨 论
肺癌是一种常见的恶性肿瘤,其病死率已位居癌症病死率之首,近年来肺癌的发病率持续上升,严重威胁人们的健康[11]。其中非小细胞肺癌占肺癌的70%~80%,且大部分患者确诊时基本处于肺癌晚期。化疗是肺癌晚期的主要治疗方法,但由于化疗药物的不良反应,以及肿瘤患者的血管无序性可阻碍化疗药物进入组织等情况,一定程度上降低了化疗药物的治疗效果[12]。
恶性肿瘤的治疗目的是能够清除肿瘤细胞而又不伤及健康组织。传统治疗如手术、放疗和化疗等在杀死肿瘤细胞的过程中,会不可避免地对机体正常组织造成损伤,而且缺乏特异性,无法彻底清除微小残留病灶或残存的肿瘤细胞,导致其治愈率低,复发率和病死率高。利用免疫系统能够区分“自我”与“非我”、正常组织与恶变组织的特点,来提高治疗效率,减少不良反应,已被称为肿瘤治疗的第4种模式[13-14]。近年来,关于恶性肿瘤的免疫治疗研究取得了重大进展。其中最为瞩目的免疫治疗方式是以 PD-1抗体为代表的免疫检查点抑制剂。PD-1是机体内非常重要的免疫检查点,它可通过与两个配体PD-L1和PD-L2的结合来抑制T淋巴细胞的活化、增殖及细胞因子的产生,该机制对于机体维持免疫耐受发挥重要作用,并且在多种实体瘤中显示出卓越的抗肿瘤疗效[15]。然而,80%的患者单用免疫治疗是无效的(原发性耐药),而且一小部分有效的患者中还会存在部分患者出现复发(继发性耐药)。因此原发性耐药和继发性耐药是应用PD-1抗体治疗肿瘤的最大困扰。为了进一步提高疗效,越来越多的临床研究聚焦于联合治疗,包括与化疗药物联合、与抗血管抑制剂联合及与其他免疫治疗药物联合等[16]。肺癌一线药物GEM是细胞周期特异性抗代谢药物,介导着DNA的合成,和铂类药物联合使用效果最佳,但仍有一部分患者对联合化疗不耐受,这也一定程度地降低了患者的疗效[17]。
本文建立肺癌小鼠模型,分别用GEM、PD-1及GEM联合PD-1对肺癌小鼠进行干预治疗,肿瘤生长情况比较结果显示,联合组小鼠的肿瘤质量和体积均小于GEM组和PD-1组,且肿瘤生长得到了明显的延缓,肿瘤生长抑制率明显升高;但GEM组和PD-1组小鼠的生长情况无明显差异,可见GEM联合PD-1可有效延缓肿瘤的生长,降低肿瘤的质量和体积,明显提高抗肿瘤效应。李源等[18]研究发现,阿帕替尼联合GEM组肿瘤体积、最高标准摄取值(SUVmax值)及血管内皮生长因子受体2(VEGFR-2)阳性表达均明显低于阿帕替尼组和GEM组,阿帕替尼联合GEM可对Lewis肺癌移植瘤产生协同抗肿瘤效应。肿瘤血管生成对肿瘤的生长和发展至关重要,早有研究证实血管的新生可为肿瘤提供一定的营养,促进了肿瘤的生长、转移等。因此,抑制肿瘤血管的生成可有效抑制肿瘤的生长。本研究结果显示,GEM和PD-1共同干预的联合组小鼠肿瘤MVD均低于PD-1组和GEM组,可见GEM联合PD-1可有效抑制血管生成,进而抑制肿瘤的生长。刘相良等[19]研究证实,VEGF靶向药物贝伐珠单抗注射液可抑制肿瘤血管生成,在肿瘤耐药后仍然取得较好的临床疗效,可将化疗联合贝伐珠单抗注射液作为五线化疗方案治疗肺腺癌肝转移所致的高胆红素血症。VEGF是重要的促血管生成因子,能增加血管通透性,促进皮内细胞迁移、增生和肿瘤新生血管生成,促进肿瘤生长和转移。本研究结果显示,联合组小鼠肿瘤组织中VEGF阳性表达率明显低于GEM组和PD-1组,但GEM组和PD-1组无明显差异,可见GEM和PD-1产生协同作用,共同抑制肿瘤中VEGF的阳性表达。有研究表明,阻断VEGF和VEGF受体可促进肿瘤血管结构的正常化,也可改变肿瘤的微环境[20]。
综上所述,GEM联合PD-1单抗可发挥协同作用抑制肺癌肿瘤的生长,降低MVD及VEGF的表达。
