找准关系注重细节 突破高考滴定计算
2022-03-14苗慧霞特级教师
苗慧霞(特级教师)
(河南省三门峡市外国语高级中学)
在高中化学课程标准中,“证据推理与模型认知”化学核心素养就是要在教学中培养学生科学探究知识的思维与方法.在王磊教授的新课标培训会上,有一种观念:例题即是模型.中和滴定类的计算问题是学生学习过程中的难点,学生在学习过程中要学会建立模型,解题时思维要有序,这样才能突破滴定计算类问题.高中阶段的滴定计算,其实也就是关系式的计算,在课本上出现的基本模型就是中和滴定,利用氢离子和氢氧根离子之间的等量关系来进行计算.但在历年的考题中,又逐渐演变为氧化还原滴定、沉淀滴定和配位滴定等.不论是哪一种滴定,关键都是要找准滴定时标准液与待测液恰好反应时,依据指示剂颜色发生变化确定的等当点,根据关系式进行计算.但在高考的滴定计算中,除了要注意关系式之外,还要注重一些细节,比如:配制溶液的体积和取用体积不同、题给的问题是什么、含量是以哪种物质来计算的等.找准关系注重细节,注重分析滴定计算的反应类型和滴定方法,是突破高考滴定计算的有效途径.
1 滴定计算的反应类型
1.1 酸碱滴定
例1(2020年全国Ⅱ卷,节选)苯甲酸可用作食品防腐剂.实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:

实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL 甲苯(密度为0.867 g·mL-1)、100mL 水和4.8g(约0.03mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠.
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣.合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全.将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥.称量,粗产品为1.0g.
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容.每次移取25.00mL 溶液,用0.01000mol·L-1的KOH 标准溶液滴定,三次滴定平均消耗21.50mL的KOH 标准溶液.
本实验制备的苯甲酸的纯度为______;据此估算本实验中苯甲酸的产率最接近于______(填标号).
A.70% B.60% C.50% D.40%

根据题意可列关系式C6H5COOH~KOH
n(C6H5COOH)=n(KOH)=21.5×10-5mol,C6H5COOH 的纯度为
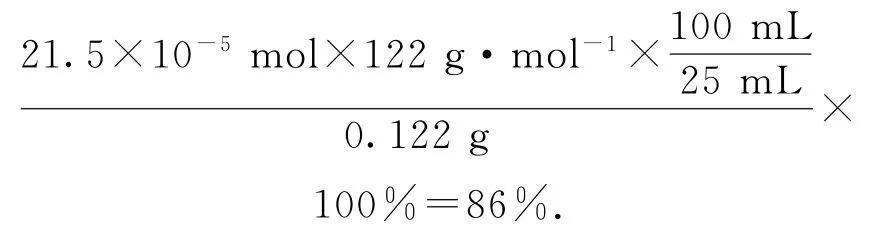
理论上C6H5COOH 的质量为

注意细节:1)配制的是100mL 溶液,每次移取25.00mL溶液,要进行量的换算.2)1.5 mL甲苯(0.867g·mL-1)和4.8g(约0.03mol)高锰酸钾的物质的量进行比较,甲苯的量不足,苯甲酸的物质的量应该按照甲苯进行计算.
变式(2018年北京卷,节选)取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是_________.(已知:H3PO4摩尔质量为98g·mol-1).
答案.
1.2 氧化还原滴定
例2(2018年全国Ⅰ卷,节选)Na2S2O5可用作食品的抗氧化剂.在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL 葡萄酒样品,用0.01000 mol·L-1的碘标准液滴定至终点,消耗10.00 mL.滴定反应的离子方程式为_________,该样品中Na2S2O5的残留量为_________g·L-1(以SO2计).

根据题意可知涉及反应为
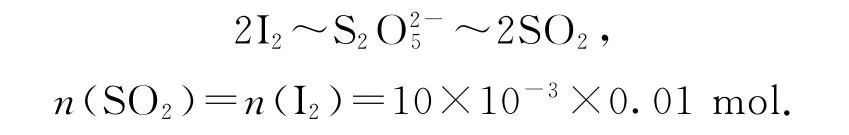
关系式为

Na2S2O5的残留量(以SO2计)为

注意细节:1)测定Na2S2O5残留量时,注意小括号里的计算要求:(以SO2计),需要将计算结果换算成SO2的质量.2)要求计算的单位是g·L-1,因此需要将题中给出的50.00mL葡萄酒样品的计算结果换算成1000.00mL葡萄酒样品中的含量.
变式(2018年全国Ⅱ卷,节选)测定三草酸合铁酸钾中铁的含量.①称量mg样品于锥形瓶中,溶解后加入稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点.
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中.加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL.该晶体中铁的质量分数的表达式为________.
答案
1.3 沉淀滴定
例3采用沉淀滴定法测定产品无水碱式氯化铜中的氯含量:称取10g 产品加硝酸溶解,得到200mL待测液.取20.00 mL 待测液,向其中先加入30.00mL0.1000 mol·L-1的AgNO3溶液,再用0.1000mol·L-1NH4SCN 的标准溶液滴定过量的AgNO3,发生反应:Ag++SCN-=AgSCN↓(已知:AgSCN 是一种难溶于水的白色固体).
(1)滴定时,应选用下列哪种物质作为指示剂________(填标号),到达滴定终点的现象为_________.
a.FeSO4b.Fe(NO3)3c.FeCl3
(2)重复实验操作3次,消耗NH4SCN 溶液的体积平均为12.50 mL.则称取的样品中n(Cl-)为_______mol.

根据反应Ag++SCN-=AgSCN↓列关系式为Ag+~SCN-,所以
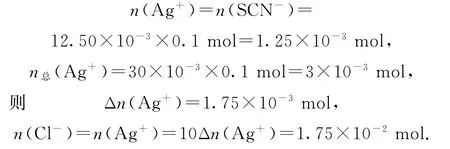
答案(1)b;加入最后1滴NH4SCN 标准溶液时,溶液变为红色,且30s内不变色.
(2)1.75×10-2.
注意细节:1)该反应为回滴,滴定消耗的n(Ag+)其实是总n(Ag+)与需要测定的物质反应后剩余的n(Ag+),因此需要计算与测定物质反应消耗的n(Ag+).2)10g产品溶解,得到200 mL 待测液.取的是20.00mL待测液,因此计算时要记得乘以10.
变式用电子天平称取0.5000g的NiO 样品,加入一定体积的6mol·L-1的盐酸恰好完全溶解,将所得到的溶液配制成250mL 溶液.取出20mL 加入锥形瓶,按照如下滴定原理进行沉淀滴定,最终得到干燥的固体mg,则镍元素的质量分数为________(写出表达式即可).

1.4 配位滴定法
例4(2018年江苏卷,节选)碱式硫酸铝溶液可用于烟气脱硫.室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为

生成物(1-x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率.
通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤、干燥至恒重,得固体2.3300g.
②取碱式硫酸铝溶液2.50mL,稀释至25mL,加入0.1000 mol·L-1EDTA 标准溶液25.00 mL,调节溶液pH 约为4.2,煮沸,冷却后用0.08000 mol·L-1CuSO4标准溶液滴定过量的EDTA 至终点,消耗CuSO4标准溶液20.00mL(已知Al3+、Cu2+与EDTA 反应的化学计量比均为1∶1).
请计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程).

由②可知关系式为Cu2+~EDTA,因此过量的

由Al3+~EDTA 可得
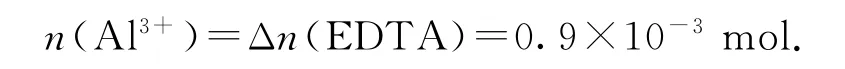
②取碱式硫酸铝溶液2.50 mL,换算成25.00 mL,则n(Al3+)=9×10-3mol.
(1-x)Al2(SO4)3·xAl(OH)3中n(Al3+)∶∶0.01,解得x=7∶17 ≈0.41.
注意细节:1)该反应为回滴,应该计算Δn(EDTA).2)①取碱式硫酸铝溶液25.00 mL,②取碱式硫酸铝溶液2.50mL,所以计算时要换算成等量的溶液.
变式(2017年江苏卷,节选)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O.为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl0.1722g;
③另取25.00mL 溶液A,调节pH 为4~5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式_________.
答案Cu2(OH)3Cl·H2O.
2 特殊滴定方法
2.1 回滴法
对于滴定计算,除了用标准溶液直接滴定被测物质的直接滴定法之外,比如例3 和例4 都用了回滴法,又称剩余滴定法或返滴法.当反应速率较慢或反应物是固体时,滴定剂加入样品后反应无法在瞬间定量反应,可先加入一定过量的标准溶液,待反应定量完成后用另一种标准溶液滴定剩余的标准溶液.例5也是回滴的计算.对于回滴问题,如遇到误差分析时,要注意从滴定过程的误差分析推出计算的误差,由于用了差量,误差分析是相反的结果.
例5(2018年天津卷,节选)
Ⅱ.NOx含量的测定
将VL 气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为,加水稀释至100.00mL.量取20.00 mL 该溶液,加入V1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2mol·L-1K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗V2mL.滴定过程中发生下列反应:
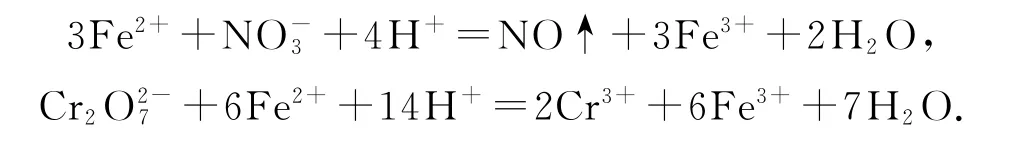
则气样中NOx折合成NO2的含量为____mg·m-3.
答案.
2.2 间接滴定法
对于不能和滴定剂直接发生反应的物质,有时可以通过另一种化学反应间接进行滴定,这种方法称为间接滴定法.即加入适当试剂与待测物质反应,使其被定量地转换成另一种可直接滴定的物质,再用标准溶液滴定此生成物.
例6(2020年江苏卷,节选)次氯酸钠溶液和二氯异氰尿酸钠(C3N3O3Cl2Na)都是常用的杀菌消毒剂.NaClO 可用于制备二氯异氰尿酸钠.二氯异氰尿酸钠优质品要求有效氯大于60%.通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准.实验检测原理为
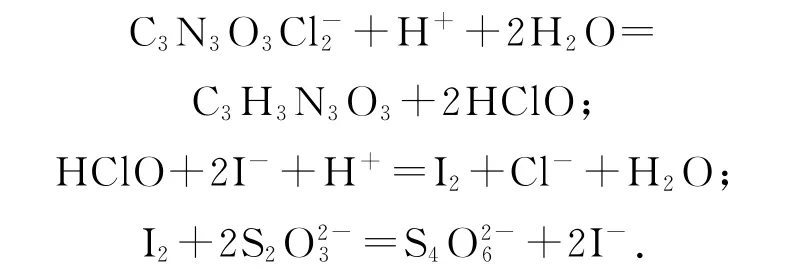
准确称取1.1200g样品,用容量瓶配成250.0 mL溶液,取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min;用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL.
通过计算判断该样品是否为优质品.


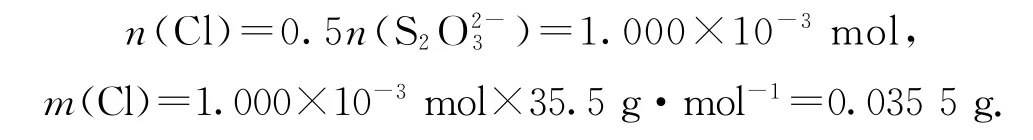
该样品的有效氯为
故该样品为优质品.
变式(2018年全国Ⅲ卷,节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1)可用作定影剂、还原剂.利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度.测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL 的_________中,加蒸馏水至________.
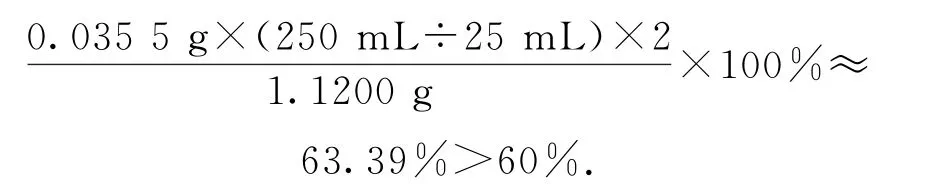
②滴定:取0.00950mol·L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+加入淀粉溶液作为指示剂,继续滴定,当溶液_________,即为终点.平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数).
答案烧杯;容量瓶;刻度线;蓝色褪去;95.0.
(完)
