miR-30a-3p/OCT-1调控肝细胞癌的分子机制研究
2022-03-14贺松琴陈潇李因茵荣光华叶映泉闻炳基罗家玉
贺松琴,陈潇,李因茵,荣光华,叶映泉,闻炳基,罗家玉
目前,肝细胞癌(HCC)抗肿瘤药物治疗的主要策略是使用分子靶向药物(MTAs),其中索拉非尼(Sorafenib)在临床已得到广泛应用,但患者普遍存在明显耐药及较严重的毒副反应[1]。目前全球各种新型的分子靶向药物,如瑞戈非尼(Regorafenib)、仑伐替尼/乐伐替尼(Lenvatinib)以及卡博替尼(Cabozantinib)等均批准用于进展期HCC治疗[2]。这些药物与Sorafenib均有相同的化学机构母核{1-[4-(pyridin-4-yloxy)phenyl]urea},临床易出现与Sorafenib类似的耐药现象或毒副反应。
转录因子OCT-1是Pit-Oct-Unc(POU)转录因子家族的重要成员,能够通过与八聚体序列(AGTCAAAT)基序(motif)结合,介导其下游基因的转录,在包括HCC在内的恶性肿瘤细胞转移与侵袭等重要生理过程中发挥了重要作用[3]。microRNA是一类由RNA聚合酶II(RNAPol II)转录的小分子非编码RNA,能够通过序列特异的方式作用于目标基因的3’非翻译区(3’UTR)降解目的基因的mRNA,最终诱导特定基因的表达沉默[4]。因此,利用微小RNA(miR)的表达载体特异性沉默癌基因的表达是有效的抗肿瘤治疗策略[5]。为此,本研究首先使用在线生物信息学工具预测可能作用于OCT-1的miR-30a-3p,再利用化学合成的方法构建pre-miR-30a-3p的慢病毒表达载体,在此基础上制备包括pre-miR-30a-3p全序列的慢病毒,检测miR-30a-3p对HCC细胞中OCT-1的影响以及对HCC细胞转移与耐药的调控作用。报道如下。
1 资料与方法
1.1 实验材料与实验设备(1)细胞株及细胞培养耗材:高侵袭性HCC细胞系MHCC97-H(中国医学科学院中国协和医科大学基础医学研究所细胞中心);DMEM培养基、胎牛血清(FBS)等为美国Thermo公司产品;60及90 mm直径细胞培养板,细胞培养瓶及6孔、96孔细胞培养板,均为美国Corning公司产品;预装-预灭菌的移液器吸头(包括1000-200、200-20以及1~20l量程)均为美国Axygen公司产品;Transwell培养板、小室为美国Corning公司产品;阳离子脂质体转染试剂为美国Thermo公司产品。(2)试剂盒:RNA提取试剂盒、反转录试剂盒及定量PCR试剂盒等均为美国ABI公司产品;分子生物学使用的各类载体均购买自山东维真公司(Vigene);载体构建实验使用的各种工具酶类,包括限定性内切酶和DNA链接酶为英国NEB公司产品。(3)实验动物:4~6周龄的胸腺缺失(T细胞缺失)的免疫缺陷小鼠购买自北京斯贝福公司,在SPF清洁条件下进行饲养;60Co-预照射灭菌的鼠粮、垫料等购买自军事科学院军事医学研究院实验动物中心;其余动物手术使用的各式器材,包括针持、缝合针、缝合线、粘鼠板、超净手术工作台等均为国产常规器材。细胞培养实验使用的恒温恒湿CO2细胞培养箱为Thermo公司产品;细胞观察实验使用的倒置相差显微镜为日本尼康公司产品;定量聚合酶链式反应(qPCR)实验使用的实时荧光定量PCR仪为美国ABI公司产品(ABI7500);系列量程的移液器为德国Eppendorf公司产品;其余设备,包括台式离心机、冰箱等均为国产常规设备;液相色谱-质谱联用平台为中国医学科学院基础医学研究所公共实验平台保障与提供。
1.2 研究方法
1.2.1 miR预测与载体构建 查询可知OCT1的Gene Symbol为POU2F1,使用在线工具miRDB对作用于POU2F1的miRs进行预测,结合预测评分和人工判读即选取评分最高的miR:miR-30a-3p为OCT-1的调控分子。在此基础上在NCBI数据库中检索得到hsa-pre-miR-30a-3p的全序列,通过化学合成的方法获得包含有半酶切位点的miR-30a-3p的正义与反义序列,二者使用PCR以获得双链DNA片段。在此基础上依据has-pre-miR-30a-3p的半酶切位点对慢病毒载体(pLV)进行酶切后与所获得的miR-30a-3p进行连接,最终获得miR-30a-3p的慢病毒载体并包装获得miR-30a-3p的慢病毒颗粒;将包含有野生型的OCT-1全序列或突变的miR-30a-3p作用位点的OCT-1全序列克隆至pLV载体上,再包装为慢病毒颗粒。
1.2.2 定量PCR实验 依据Liang等[6]方法实验,在MHCC97-H细胞中分别转染对照组、miR-30a-3p以及miR-30a-3p+OCT-1Mut后,收集MHCC97-H细胞提取总RNA样品,对样品进行逆转录并进行qPCR检测。以目标基因相对于内参基因(-Actin)的表达水平计算相对表达水平。(1)OCT-1正向引物5’-GAAACGCACCAGCATAGAGACC-3’,反向引物
5’-GGCGGTTACAGAACCAAACACG-3’;(2)Cyclin D1(ccnd1)正向引物5’-TCTACACCGACAA CTCCATCCG-3’,反向引物5’-TCTGGCATTTTGGAGAGGAAGTG-3’;(3)abcb1正向引物5’-GCTGTCAAGGAAGCCAATGCCT-3’,反向引物5’-TGCAATGGCGATCCTCTGCTTC-3’;(4)abcg2正向引物5’-GTTCTCAGCAGCTCTTCGGCTT-3’,反向引物5’-TCCTCCAGA CACACCACGGATA-3’;(5)snail正 向 引 物 5’-TCAGACGAGGACAGTGGGAAAG-3’,反向引物5’-GCTTGTGGAGCAGGGACATTC-3’;(6)twist正 向 引 物5’-GTACATCGACTTC CTCTACCAG-3’,反向引物5’-CATCCTCCAGACCGAGAAG-3’;(7)内参-actin正向引物5’-CACCATTGGCAATGAGCGGTTC-3’,反向引物5’-AGGTCTTTGCGGAT GTCCACGT-3’。
1.2.3 Transwell实验 依据Fan等[4]方法实验,在MHCC97-H细胞中转染相应载体(control miRNA或miR-30a-3p)后,再使用不含有血清的DMEM培养基收集细胞并重悬细胞制备为细胞悬液,再将制备所得的细胞悬液细胞接种于Transwell板的小室中(每孔接种约20 000个细胞)。在这一过程中(即Transwell实验),对于转移实验,细胞悬液直接接种在Transwell板的小室中;对于侵袭实验,首先在小室中预铺一层ECM胶模拟组织的基底膜,再将MHCC97-H细胞悬液接种在小室中。此后,在Transwell板外室(即24孔板)中加入含有10%FBS的DMEM后孵育小室(即将前述添加有细胞悬液的Transwell细胞小室放入到24孔板中,使小室底部浸润在24孔板内容纳的包含有10%FBS的DMEM中;侵袭实验在37℃孵育14~16 h;转移实验在37℃孵育6~8 h),此后以结晶紫试剂(0.5%w/v)对单克隆进行染色。
1.2.4 细胞单集落形成实验 依据Feng等[7]方法实验,在MHCC97-H细胞中转染相应载体(control miRNA或miR-30a-3p)后收集细胞,将细胞接种于6孔细胞培养板中。经过3~4周的生长,MHCC97-H细胞能够形成单克隆,此时使用结晶紫试剂(0.5%w/v)对单克隆进行染色,使用Image J软件对单克隆的照片进行定量分析,依据克隆总面积相对于6孔板孔的总面积确定各组克隆的数量,再依据对照组为单位1计算相对克隆数量。
1.2.5 MTT实验 依据Chen等[8]方法实验,MHCC97-H细胞中转染相应载体(control miRNA或miR-30a-3p)后再收集细胞,使用系列剂量的分子靶向药物处理细胞约48 h,此后细胞中添加50 mmol/L的MTT试剂,孵育4~6 h后弃去培养基以10%SDS裂解细胞裂解液在490 nm处读取吸光度值,依据O.D.490 nm计算药物作用的抑制率,并依据抑制率计算药物作用的半数抑制率(IC50值)。
1.2.6 药物代谢与清除检测实验 依据Feng等[9]方法实验,MHCC97-H细胞中转染相应载体(control miRNA或miR-30a-3p)后再以1mol/L剂量的Sorafenib处理细胞约12 h,此后弃去培养基上清换成正常DMEM培养基,在系列时间点(0、4、8、12、24、48及72 h时点)收集细胞样品进行超声破碎,再使用有机溶剂(乙腈)将细胞样品中的Sorafenib萃取出来,再使用液相色谱、质谱联用技术检测系列时间点细胞样品中Sorafenib的含量并计算药物在MHCC97-H细胞中的半衰期。
1.3 统计分析 数据采用SPSS 9.0软件分析,计量资料采用Bonferroni校正行方差分析,使用Origin统计分析软件确定药物作用于细胞的半数作用浓度(IC50 values)或药物在细胞中的存留的半衰期。P<0.05为差异有统计学意义。
2 结果
2.1 miR-30a-3p作用于OCT-1的3’UTR抑制其表达 在OCT-1的3’UTR区域存在两个miR-30a-3p的作用位点;miR-30a-3p能够下调MHCC97-H细胞中OCT-1的mRNA表达水平;miR-30a-3p不能够抑制3’UTR区域中miR-30a-3p作用位点突变的OCT-1,此时在MHCC97-H细胞中转染OCT-1突变体,能够恢复细胞中OCT-1的表达。见封二彩图1。

图1 miR-30a-3p作用于OCT-13’UTR的位点序列信息
miR-30a-3p能够下调OCT-1下游基因的表达水平,其中包括:(1)下调细胞增殖相关基因Cyclin D1表达(P<0.05);(2)下调细胞转移与侵袭相关基因Snail和Twist(均P<0.05);(3)下调细胞耐药相关基因ABCB1/MDR-1以及ABCG2/BRCP等(均P<0.05)。见图1。
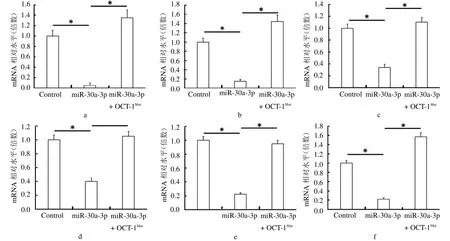
图1 miR-30-3p下调OCT-1及其下游基因的表达水平
2.2 miR-30a-3p作用于OCT-1的3’UTR抑制MHCC97-H细胞的转移与侵袭 在MHCC97-H细胞中转染miR-30a-3p能够抑制MHCC97-H细胞的体外转移与侵袭作用,同时在MHCC97-H细胞中转染miR-30a-3p的同时转染OCT-1的突变体则能够抑制miR-30a-3p的作用。见封二彩图2a~b。
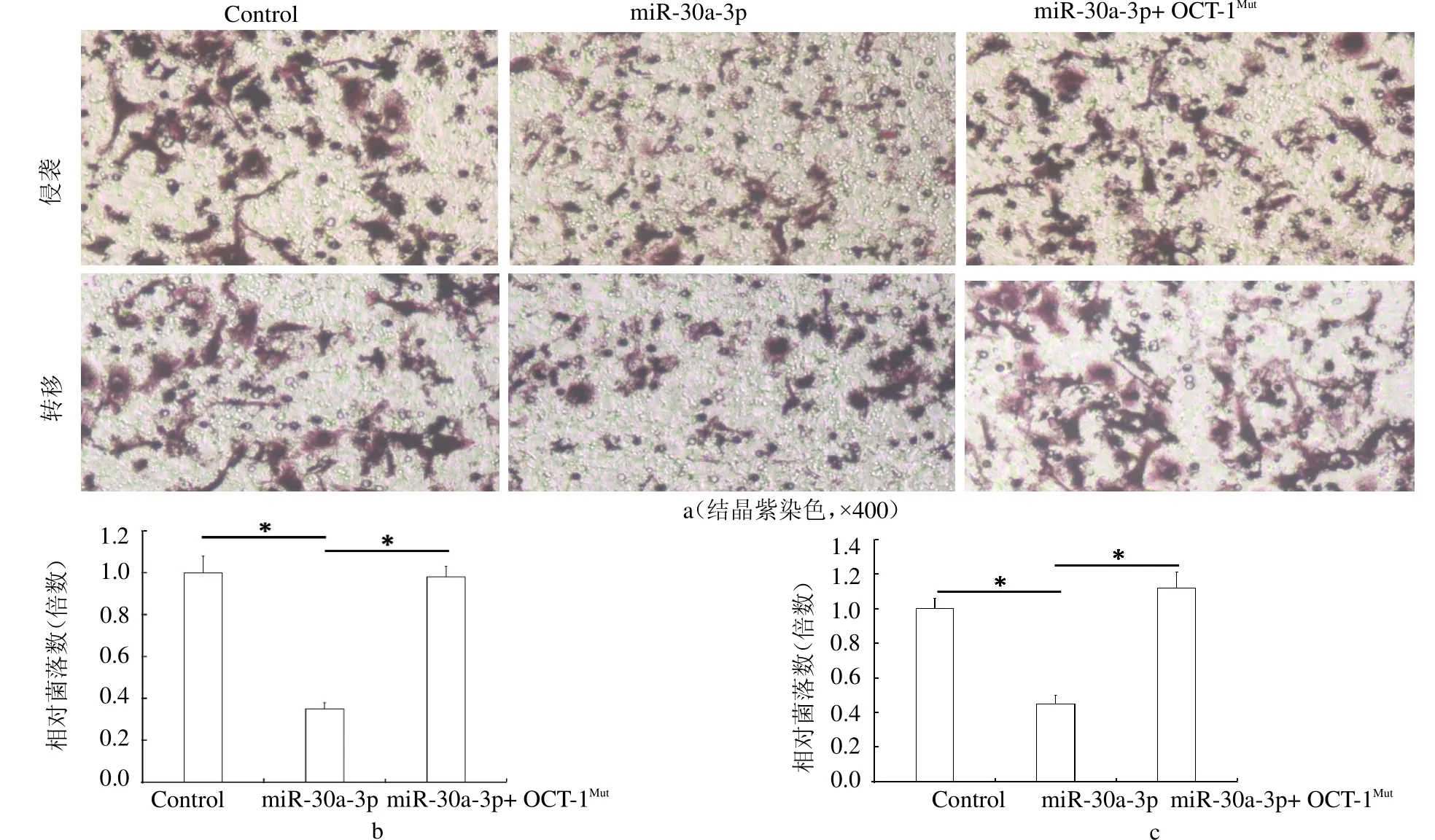
图2 miR-30a-3p抑制MHCC97-H细胞的转移与侵袭作用
MHCC97-H细胞能够突破裸鼠肝包膜进而侵袭进入裸鼠肝脏。在MHCC97-H细胞中转染miR-30a-3p能够抑制MHCC97-H细胞在裸鼠肝脏脏器的侵袭作用,而在MHCC97-H细胞中同时转染OCT-1突变体则能够抑制miR-30a-3p对于MHCC97-H细胞在裸鼠肝脏原位侵袭作用的抗肿瘤活性。见封二彩图2a、c。
2.3 miR-30a-3p作用于OCT-1的3’UTR上调MHCC97-H细胞对分子靶向药Sorafenib的敏感性
在MHCC97-H细胞中转染miR-30a-3p能够显著延缓Sorafenib在MHCC97-H细胞中的代谢与清除作用,Sorafenib的半衰期显著延长:对照组为(25.31±7.99)h,miR-30a-3p组为(43.02±6.67)h。而在MHCC97-H细胞中转染OCT-1突变体则能够抑制miR-30a-3p的作用:miR-30a-3p+OCT-1Mut组Sorafenib的半衰期为(20.55±10.75)h。

图3 miR-30a-3p能够上调Sorafenib对MHCC97-H细胞的杀伤作用
3 讨论
受诊疗技术的限制,HCC患者往往初诊即为进展期。由于进展期HCC具有对传统细胞毒性化疗药物多药耐药的特性,因此常见化疗药物如阿霉素等在HCC治疗中少有应用,仅能够应用于经肝动脉化疗栓塞(TACE)等少数特殊治疗策略。因此分子靶向治疗在HCC治疗中具有重要意义。尽管有大量临床试验进行了相关研究,但仍然仅有Sorafenib等4种分子靶向药物最终获批上市用于进展期HCC患者治疗,这些药物的作用机制类似,都是作用于VEGFR、PDGFR以及Raf等受体酪氨酸蛋白激酶蛋白以及下游MAPK等信号通路最终抑制HCC细胞的增殖、转移、侵袭以及肿瘤血管生成作用[10]。其他药物,包括曲妥珠单抗等都没能通过临床试验。研究和开发新的治疗和干预靶标成为现阶段亟需解决的问题。
本研究阐明了miR-30a-3p/OCT-1在HCC中的作用,发现在HCC细胞中过表达miR-30a-3p具有良好的抗肿瘤作用。作为重要的肿瘤促进因子,OCT-1能够作为转录因子介导多种下游基因的转录,这些因子主要是细胞转移与侵袭相关因子,也包括部分耐药相关因子。这使得OCT-1是HCC治疗的理想干预靶点:抑制OCT-1的活性或下调其表达水平既能够直接抑制HCC的增殖、转移与侵袭作用,同时也能够促进HCC细胞对其他抗肿瘤药物的敏感性。
