蜢虾酱中生物胺降解菌的特性及应用
2022-03-14赵一睿,桑雪,毕景然,张公亮,郝洪顺,侯红漫
赵 一 睿, 桑 雪, 毕 景 然, 张 公 亮, 郝 洪 顺, 侯 红 漫
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
蜢虾酱是中国传统的发酵水产品,具有较高的营养价值和独特的风味,其使用的蜢虾主要分布在渤海,即海水与淡水接壤处[1]。用蜢虾制成的蜢虾酱比其他虾酱具有更低的脂肪和胆固醇含量,更高的虾青素和钙含量。但在露天环境中加工容易受到微生物污染,很难控制蜢虾酱的品质。
生物胺是由氨基酸脱羧形成的具有生物活性的小分子量含氮有机化合物,广泛存在于蛋白质含量丰富的发酵水产品中[2]。摄入过量的生物胺会产生中毒、头痛、呼吸紊乱、心悸、血压变化等毒性作用,因此必须控制发酵水产品中生物胺的含量[3]。目前,利用胺氧化酶来减少食品中生物胺的积累是较有优势和应用前景的方法[4]。
枝芽孢杆菌属常见于发酵食品中,它们与组胺、酪胺、腐胺及尸胺无显著相关性,是蜢虾酱所有细菌中最丰富的5个属之一[1]。许多学者研究发现,该物种可以作为发酵水产品的起始发酵剂。例如,将Virgibacillussp. SK37接种于鱼露样品中,该发酵剂具有在挥发性化合物,谷氨酸含量和总体可接受性方面改善的潜力[5]。从泰国虾酱(Kapi)中分离出的V.halodenitrificansMSK-10P表现出了高蛋白酶活性和高盐环境的耐受性,该菌株应用于Kapi中会加速发酵过程,并提高其营养成分[6]。
本研究从蜢虾酱中筛选出一株不产生物胺的枝芽孢杆菌,通过安全性分析对其作为发酵剂的潜力进行评估,并分析了菌株中胺氧化酶降解生物胺的特性及其在蜢虾酱产品中的应用。
1 材料与方法
1.1 材 料
蜢虾酱,产自山东威海;盐反硝化枝芽孢杆菌(Virgibacillushalodenitrificans),从蜢虾酱中分离出的脱羧酶阴性耐盐菌,实验室保藏;奶酪;纳豆。
组胺、酪胺、腐胺及尸胺,阿拉丁试剂有限公司;丹磺酰氯,大连美仑生物技术有限公司;乙腈和甲醇,色谱纯,斯百全化学有限公司;氯霉素、克林霉素、红霉素、氨苄西林、卡那霉素、链霉素、四环素、环丙沙星,索莱宝生物科技有限公司。
1.2 仪器与设备
S6000高效液相色谱仪,华谱(中国)有限公司;Sorvall ST 16R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;M2多功能酶标仪,Danaher有限公司。
1.3 方 法
1.3.1 菌株的生长条件
菌株在LB肉汤或LB琼脂培养基中37 ℃培养24 h,在LB肉汤中传代培养24 h,在LB琼脂培养基上划线培养24 h后,挑取单菌落在LB肉汤中培养24 h后使用。
1.3.2 生物胺降解能力评价
将种子液以1%的接种量接种于LB培养基中,37 ℃、150 r/min培养24 h,4 ℃、4 000 r/min离心10 min收集菌体,0.05 mol/L、pH 7.0磷酸盐缓冲液(PBS)洗涤2次,然后把菌体重悬到含4种生物胺(组胺、酪胺、腐胺及尸胺)(500 mg/L)的PBS溶液中,调整菌悬液OD600为0.8,在37 ℃、150 r/min下培养48 h。将不含任何细菌细胞的PBS溶液在相同条件下处理作为对照组。分别测定对照组(ρ0)和实验组(ρ1)上清液中的生物胺质量浓度(mg/L),计算生物胺的降解率[7]。
降解率=(ρ0-ρ1)/ρ0×100%
1.3.3 生物胺降解酶的类型及分布
1.3.3.1 胺氧化酶活性测定
用接种环挑取单菌落到白色洁净滤纸中,加入200 μL 1%二甲基对苯二胺盐酸盐溶液,胺氧化酶阳性呈粉红色,逐渐加深,加入200 μL 1% α-萘酚乙醇溶液,阳性0.5 min内呈蓝色,阴性2 min 内不变色[8]。
1.3.3.2 生物胺降解菌中胺氧化酶的分布
取活化好的生物胺降解菌种子液以1%的接种量接种到LB液体培养基中,37 ℃、150 r/min培养24 h,4 ℃、4 000 r/min离心10 min,收集上清液为细胞外组分;沉淀用预冷到4 ℃的PBS溶液洗涤细胞2次,重悬一部分悬浮液被收集为完整细胞组分;另一部分菌悬液用组织研磨器研磨30 min,将混合物在4 ℃、10 000 r/min离心30 min,收集上清液作为细胞内组分。沉淀用PBS溶液洗涤2次,重悬为细胞膜组分。测定各组分生物胺质量浓度,并计算各生物胺的降解率,分析生物胺降解酶的分布[9]。
1.3.3.3 EDTA对胺氧化酶的影响
取活化好的生物胺降解菌种子液以1%的接种量接种到LB液体培养基中,37 ℃、150 r/min培养24 h,重悬于终浓度20 mmol/L的EDTA以及4种生物胺(组胺、酪胺、腐胺、尸胺)(500 mg/L)的PBS溶液中,调整菌悬液OD600为0.8,37 ℃、150 r/min培养48 h。将不含任何细菌细胞的PBS溶液在相同条件下处理作为对照组,测定对照组和实验组上清液中各生物胺质量浓度,并计算各生物胺的降解率,分析EDTA对生物胺降解菌中胺氧化酶的影响[10]。
1.3.4 生物胺降解菌的安全性能评价
1.3.4.1 溶血活性测定
在血琼脂(LB固体培养基中加入5%羊血)上划线检测菌株的溶血活性。溶血反应通过在血琼脂上形成的菌落周围出现透明区(β-溶血:红细胞完全溶解)、绿色区(α-溶血:红细胞血红蛋白转化为高铁血红蛋白)或无任何区域(γ-溶血:无溶血活性)来检测[11]。
1.3.4.2 抗生素耐药性检测
菌株对氯霉素、克林霉素、红霉素、氨苄西林、卡那霉素、链霉素、四环素和环丙沙星8种临床上重要抗生素的敏感性。根据EFSA指南进行选择,测试枝芽孢杆菌属的细菌敏感性。使用基于乳杆菌(ISO 10932—2010)肉汤微量稀释法进行检测[12]。
1.3.4.3 生物膜活性的测定
将菌株种子液与LB液体培养基按体积比1∶100 混合均匀,加入96孔板中,空白对照为LB培养基。37 ℃静置培养24 h后,用排枪除去浮游细菌,用0.01 mol/L PBS溶液洗涤,无水甲醇固定,干燥后加入结晶紫溶液染色15 min,蒸馏水洗涤3次,将平板吹干,加入冰醋酸进行溶解,用酶标仪测定OD590[13],每组做6个平行试验。生物膜形成量的判断标准:ODC=阴性对照的平均值+3×阴性对照的标准差。生物膜分类:OD590≤ODC,无生物膜;ODC
1.3.5 生物胺降解菌的应用潜力
1.3.5.1 蜢虾酱中生物胺的降解
将500 μL活化好的生物胺降解菌种子液添加到100 mL锥形烧瓶中,锥形烧瓶中装有50 g蜢虾酱样品,对照组用500 μL无菌蒸馏水代替菌液培养,37 ℃孵育10 d。离心收集上清液,测定对照组和实验组上清液中各生物胺质量浓度,实验重复3次。分析生物胺降解菌对蜢虾酱中生物胺的影响。
1.3.5.2 其他发酵产品中生物胺的降解
将500 μL活化好的生物胺降解菌种子液添加到100 mL锥形烧瓶中,锥形烧瓶中分别装有50 g的奶酪以及纳豆样品,对照组用500 μL无菌蒸馏水代替菌液培养,37 ℃孵育10 d。离心收集上清液,测定对照组和实验组上清液中各生物胺质量浓度,实验重复3次进行。分析生物胺降解菌对奶酪和纳豆中生物胺的降解情况。
1.3.6 高效液相色谱法的测定
1.3.6.1 生物胺的柱前衍生
参照卢士玲等[14]的方法,取400 μL生物胺提取液,加入80 μL 2 mol/L NaOH使之呈碱性,再加入120 μL饱和NaHCO3溶液缓冲,加入800 μL 10 mg/mL丹磺酰氯丙酮溶液,混合溶液在45 ℃黑暗中反应45 min,加入50 μL氨水终止反应,在室温下反应30 min除去残留的丹磺酰氯溶液,加入550 μL乙腈,在4 ℃、3 000 r/min离心5 min,衍生处理后0.22 μm滤膜过滤。
1.3.6.2 色谱条件
色谱柱C18(4.6 mm×250 mm,5μm),体积流量1 mL/min,紫外检测波长254 nm,进样量10 μL,柱温30 ℃,流动相A为水,流动相B为乙腈,采用梯度洗脱程序,洗脱程序见表1。

表1 梯度洗脱程序Tab.1 The procedure of gradient elution
1.3.7 数据分析
结果以(平均值±标准偏差)的形式表示,所有统计分析均基于重复实验3次,使用SPSS 19.0软件包分析数据,采用单因素方差分析(One-Way ANOVA)确定菌株之间的差异是否显著,使用邓肯式多重比较在5%水平评估处理样品之间差异的显著性,以P<0.05表示具有统计学意义上的显著差异。
2 结果与讨论
2.1 生物胺降解能力的评价
由图1可知,盐反硝化枝芽孢杆菌生物胺降解率分别为组胺13.60%、酪胺15.81%、腐胺18.87%和尸胺10.02%。因此,从蜢虾酱中分离出的盐反硝化枝芽孢杆菌,由于其脱羧酶活性呈阴性,并且具有降解生物胺的能力,故可作为控制食品中生物胺形成的潜在候选菌株。
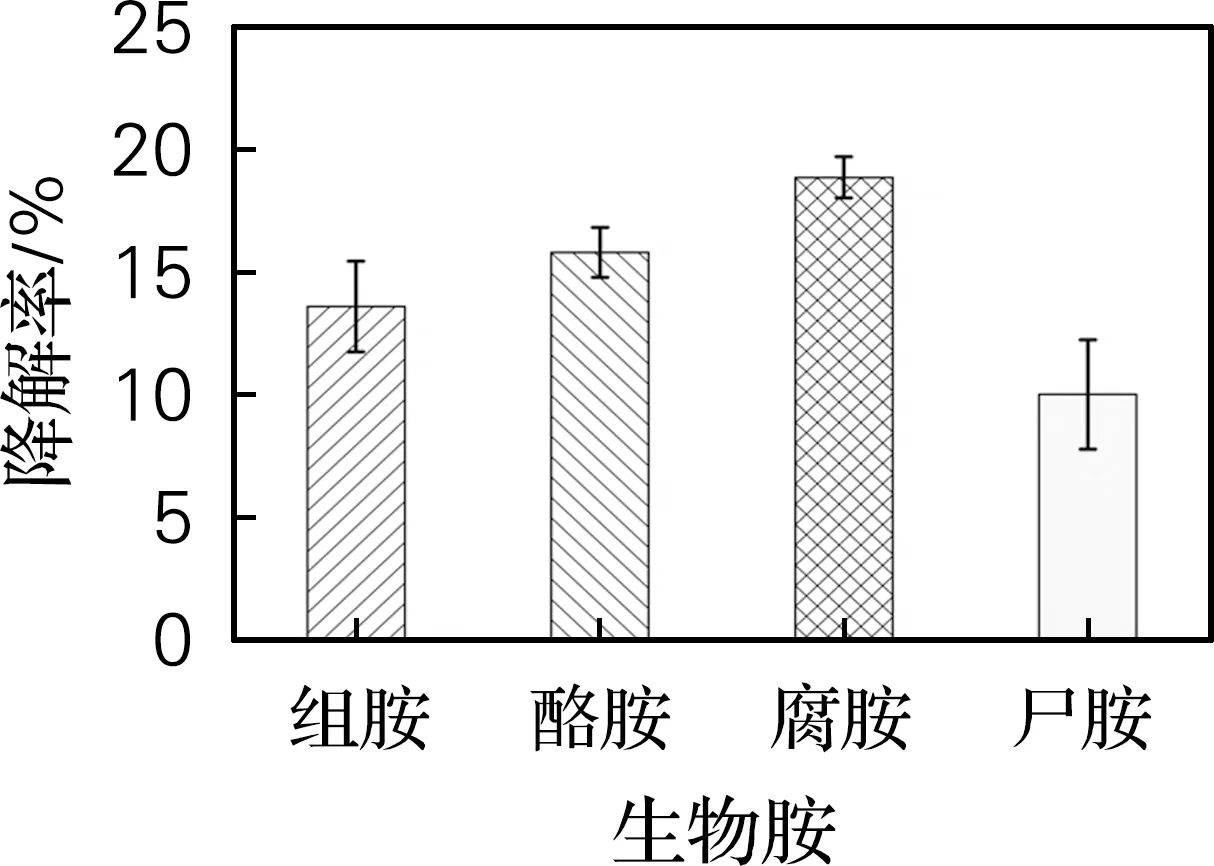
图1 盐反硝化枝芽孢杆菌降解生物胺的能力Fig.1 The ability of Virgibacillus halodenitrificansto degrade biogenic amines
2.2 生物胺降解酶的类型及分布
利用某些微生物产生的胺氧化酶将生成的生物胺降解,是目前去除食品中生物胺最有前景的方式。Wang等[15]发现在发酵香肠中接种具有胺氧化酶活性的葡萄球菌R11,有助于减少组胺的积累。将生物胺降解菌进行胺氧化酶活性分析。图2(a)表明,盐反硝化枝芽孢杆菌呈胺氧化酶阳性,即其降解生物胺起作用的酶为胺氧化酶。
胺氧化酶主要分布在细胞膜或细胞质上[16],为了确定胺氧化酶的位置,制备了盐反硝化枝芽孢杆菌培养后的不同组分,并分别与其完整细胞的生物胺降解能力进行比较。如图2(b)所示,这株生物胺降解菌在细胞外和细胞内组分生物胺降解活性均较低,降解率均低于3%,在细胞膜组分显示出较高降解活性,但是降解率略低于完整细胞,这可能归因于细胞组织研磨器在破碎过程中造成了部分胺氧化酶的失活。因此,可以推断胺氧化酶位于盐反硝化枝芽孢杆菌的细胞膜上。
分析EDTA对生物胺降解菌中胺氧化酶的影响,以初步分析判断胺氧化酶的类型。如图2(c)所示,对于盐反硝化枝芽孢杆菌,未加EDTA组的组胺、酪胺、腐胺和尸胺降解率分别为13.2%、14.7%、15.8%和7.4%,而加EDTA组仅降解了3.0%的腐胺,而对其他生物胺不具备降解活性。有报道表明,含铜的生物胺氧化酶的活性会被EDTA显著抑制[8],因此可以推断出盐反硝化枝芽孢杆菌含有铜胺氧化酶,但是否还存在其他胺氧化酶无法判断,要得到确切的结果需要对酶分子结构、氨基酸序列以及辅酶的结构进行分析。

(a) 胺氧化酶试验
2.3 生物胺降解菌的安全性能评价
由图3可知,盐反硝化枝芽孢杆菌不会诱导溶血(γ溶血);根据EFSA(2012)规定,如果需要将细菌产品用作添加剂,则应评估该菌株对一定范围的人类和兽医学重要性抗生素的敏感性,见表2。结果表明,胺氧化酶位于盐反硝化芽孢杆菌的细胞膜上,说明该菌对常见抗生素敏感。根据MIC数据,所有值均低于EFSA(2012)中提到的断点极限值。生物膜是一个有组织的功能性细菌种群,当细菌形成生物膜时,它们对抗生素的抗性将增强。盐反硝化枝芽孢杆菌的OD590为0.006 1,低于ODC(0.046 4),不具有生物膜形成能力。
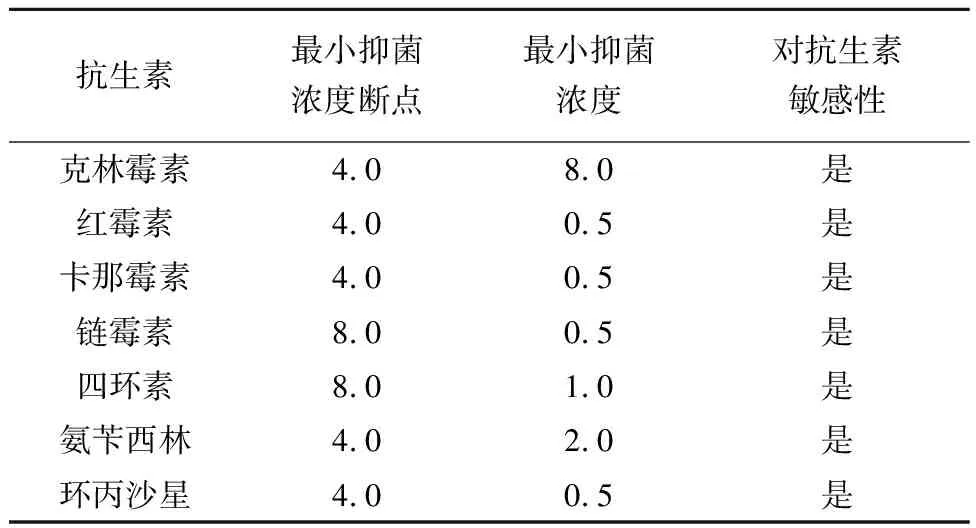
表2 抗生素对生物胺降解菌的最低抑菌浓度Tab.2 Minimum inhibitory concentration of antibioticsagainst biogenic amine degrading bacteria mg/L
2.4 生物胺降解菌的应用潜力
盐反硝化枝芽孢杆菌由于其不产生物胺且具有生物胺降解能力而可能成为控制生物胺的潜在候选者。为了评估其对蜢虾酱中生物胺的降解能力,将500 μL接种物添加到含有50 g蜢虾酱样品的锥形瓶中,在37 ℃培养10 d。经测定,蜢虾酱样品的食盐质量分数(23.47±1.68)%,pH为(6.98±0.14)。未接种菌株的对照组样品显示出较高的生物胺质量浓度,这是由于蜢虾酱中的天然微生物发酵所致。由表3可知,4种生物胺在接入盐反硝化枝芽孢杆菌后都有所降解。表明这株生物胺降解菌可有效降解蜢虾酱中的生物胺,然而复杂的发酵环境,尤其是盐浓度较高的条件下会抑制微生物的生长和繁殖,同时还会降低大多数胺氧化酶的活性[17]。

表3 盐反硝化枝芽孢杆菌降解蜢虾酱中生物胺的能力
2.4.2 盐反硝化枝芽孢杆菌对其他发酵产品中生物胺的降解
为了评估生物胺降解菌对其他发酵产品中生物胺的降解率,选择了生物胺含量较高的奶酪和纳豆作为研究对象,将500 μL接种物分别添加到含有50 g奶酪或纳豆样品中,在37 ℃培养10 d。测定奶酪样品的食盐质量分数(9.25±0.87)%,pH为(6.98±0.14)。纳豆在加工过程中不添加氯化钠,pH为(7.06±0.27)。如表4所示,4种生物胺在接入盐反硝化枝芽孢杆菌后都有所降解,表明该菌作为发酵剂接种于其他发酵产品中,对生物胺仍然有很高的降解能力,故可以应用于蜢虾酱以外的发酵产品。
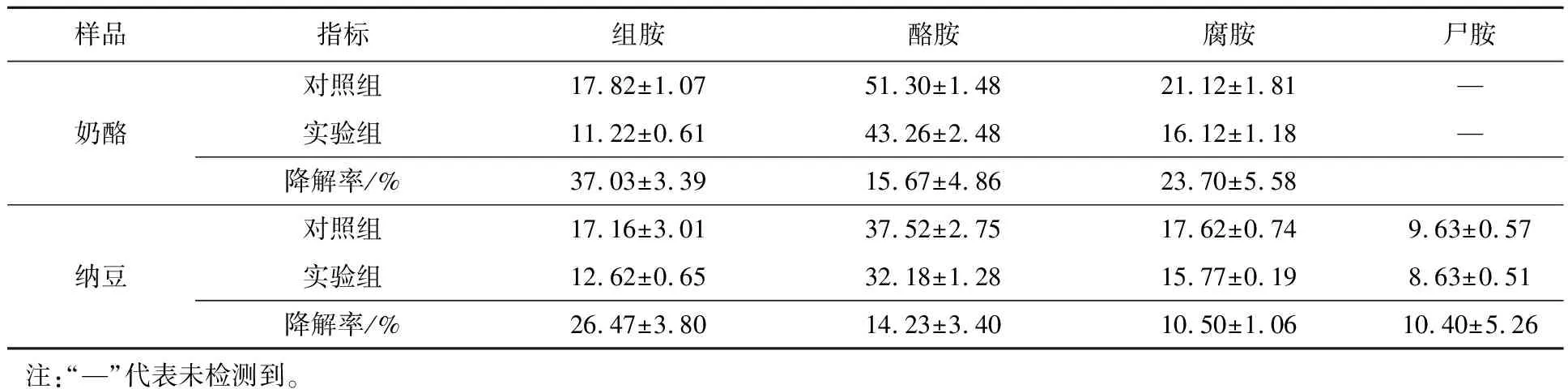
表4 盐反硝化枝芽孢杆菌对奶酪和纳豆中生物胺的降解能力Tab.4 The ability of Virgibacillus halodenitrificans to degrade biogenic amines in cheese and natto mg/L
3 结 论
盐反硝化枝芽孢杆菌呈脱羧酶阴性(不具备产生生物胺的能力),能降解发酵产品生物胺,将该菌接种于蜢虾酱,组胺、酪胺、腐胺和尸胺的降解率分别为11.1%、11.3%、15.5%和4.1%。该菌降解生物胺的酶主要是位于细胞膜上的胺氧化酶,利用胺氧化酶来降低发酵产品中的生物胺是目前最为有效的手段。对盐反硝化枝芽孢杆菌进行安全性能评估,发现其满足相关的安全标准,可以降解产品生产过程中有害生物胺,作为发酵产品中有效的生物控制剂。将该菌应用于其他发酵产品,奶酪中组胺、酪胺和腐胺降解分别为37.03%、15.67%和23.70%;纳豆中组胺、酪胺、腐胺和尸胺降解率分别为26.47%、14.23%、10.50%和10.40%。
